藥品研發質量體系數據完整性的現狀及應對措施
宿慧
摘? 要:學習以及分析藥物數據,并且進行規范性學習,對藥品檢查報告中的數據完整性問題缺陷項(CFD2017—2018年度)進行分析,對平時工作中存在的常見問題進行總結,對計算機化附錄中的要求采取新版《藥品生產質量管理規范(2010年修訂)》以及CFDA《藥品數據管理規范》征求意見稿中的標準,并且對藥品研發質量體系數據完整性工作進行針對性的分析,并且根據分析結果制定出最佳的應對措施。
關鍵詞:藥品研發? 質量體系數據完整性? 現狀? 應對措施
藥品研發質量體系是在藥品研發過程中最為重要的部分之一,其主要包括兩個部分,即項目管理以及數據完整性。我們要想使得藥品研發能夠呈現市場全球化、趨同化發展,則需要加強藥品研發質量體系建設[1]。其中保證數據完整性需要保證整個產品數據生命周期的數據采集一致、可靠、準確以及合理,保證數據完整性需要適當的風險管理系統以及質量管理系統,包括要時刻遵循良好的文件規范以及合理的科學原則[2]。該文研究與分析藥品研發質量體系數據完整性的現狀及應對措施,現報道如下。
1? 研發QA和藥廠QA的區別
NMPA、FDA最新的藥品注冊法規政策是研發質量體系目標的主要法律基礎,在項目實施的過程中,指導原則包括GMP、GXP以及ICH等,實施理念為QbD,要求以環、法、測、機、人、料等主題,使得風險以及質量相互并存,使得質量管理體系中不成熟的工藝以及方法進行轉變,轉變為較為成熟的工藝,要求所研發出來的產品以及資料完全符合NMPA的相關要求[3]。
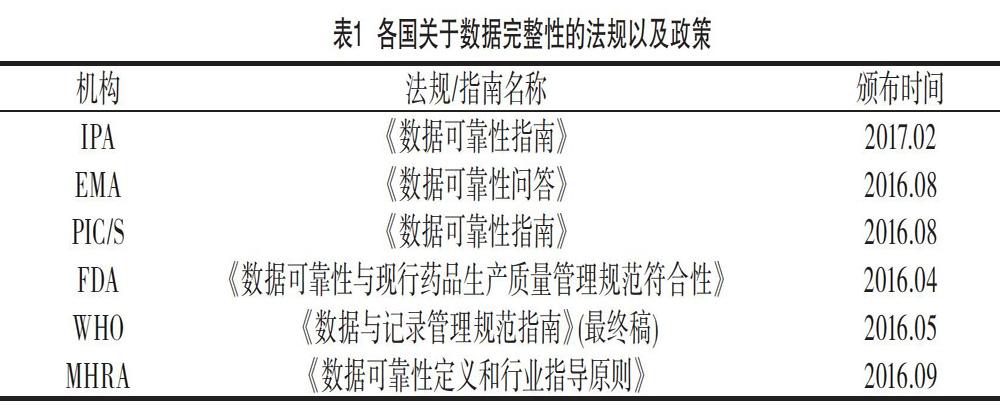
2? 各國關于數據完整性的法規以及政策
關于數據完整性,各國均有相關的法規以及政策,世界上主要的制藥大國均有較為完整的法規體系,各國主要的法規政策如表1所示。
我國相關的法律法規主要為GMP計算機系統附錄,除此之外,隨著社會的發展,此附錄已經無法滿足人們的需求,因此CFDA分別兩次頒布了《藥品數據管理規范》的征求意見稿,頒布時間分別為2016年9月以及2017年8月。
3? 我國近兩年藥品研發數據完整性的現狀
根據大量研究數據顯示,我國藥品注冊生產現場核查(2017年度),通過率較高,高達82.0%,僅有18.0%的企業主動申請撤回注冊申請,撤回注冊申請的主要理由為數據可靠性問題。我國藥品注冊生產現場核查(2018年度),通過率較高,高達93.4%,僅有6.6%的企業主動申請撤回注冊申請,但是此年度的數據可靠性問題(數據無法溯源、申報資料不真實)已經不再突出,主要出現的問題包括工藝驗證不科學、偏差及超標調查不充分、生產質量管理規范執行不足[4]。
國家食品藥品監督管理局在2017—2018年度對檢查數據進行跟蹤調查,發現規范化問題是主要的數據可靠性問題,雖然篡改數據、操作數據以及記錄不真實等問題均有出現,但是并不是主要的問題。
4? 應對措施
4.1 人才培訓
整個數據生命周期的主體之一便是人員,需要定期培訓與考核循環對實驗及相關人員、QA及技術骨干,主要培訓的內容為實驗的操作記錄的規范書寫以及專業知識等,幫助對象深入理解質量體系文件,以此來確保實際操作以及文件相一致,要及時書寫試驗記錄,不可寫成回憶錄。
4.2 加強實驗室儀器設備的管理
計算機系統的主要部分便包括儀器設備,是產生電子數據的主體,所以保證數據完整性的重要部分也包括嚴格管理儀器設備[5]。要求參考國際制藥工程協會ISPE的GAMP5指南,隨后進行3Q認證,認證時需要使用實驗室的LC-MS、GC、HPLC以及UV等[6]。
4.3 對于數據異常的處理
主要分為兩個階段來處理異常數據,即小試摸索階段、中試及中試以上階段,前者階段需要確認問題,不需要書寫異常數據報告,而后者則需要按照流程進行調查,書寫異常數據報告[7-9]。
4.4 建立研發質量體系的內審機制
要求公司內部的資深研發人員根據項目的重要階段以及關鍵節點來記錄試驗過程中產生的數據、資料、圖譜以及文件,從多角度來審查,將存在的問題反饋給研發QA,并且可以召開內部會議研討出最佳的解決方案。
5? 結語
該文研究與分析藥品研發質量體系數據完整性的現狀及應對措施,該文從研發QA和藥廠QA的區別、各國關于數據完整性的法規以及政策、我國近兩年藥品研發數據完整性的現狀以及應對措施等進行敘述,但是本人能力有限,看待問題具有局限性,還望相關學者批評與指正。
參考文獻
[1] 馮功,梁毅.對完善藥品生產企業數據完整性的思考[J].中國藥房,2017,28(13):1732-1735.
[2] 陳震,楊建紅,張彥彥,等.影響我國化學藥品仿制藥質量因素的問卷調查分析[J].中國新藥雜志,2017,26(13):1477-1483.
[3] 張鐵軍,韓文濤,韓靜.數據完整性對中國制藥企業GMP檢查的影響分析[J].中國新藥雜志,2017,26(9):985-989.
[4] 曹忠芹.中藥藥品說明書和美國藥品說明書的體裁對比分析[J].中草藥,2017,48(5):1045-1050.
[5] Shameer K, Badgeley M A, Miotto R, et al. Translational bioinformatics in the era of real-time biomedical, health care and wellness data streams[J].Briefings in Bioinform-atics,2017,18(1):105-124.
[6] 萬鮮紅.運用病歷檢查導引單提高護理病歷查檢的完整性和準確性[J].中國藥物與臨床,2017,17(10):1553-1555.
[7] 周立軍,張力偉,王雪,等.我國區域產品質量信息披露研究——基于內容完整性的評價探索[J].科技管理研究, 2017,37(10):238-242.
[8] 汪六英.藥品研發質量體系數據完整性的現狀及應對措施[J].廣州化工,2019(3):161-163.
[9] 劉愛勤.藥品檢驗質量控制的必要性及規范措施探討[J].健康之路,2017(8):260.

