GSK2606414對酒精聯合棕櫚酸誘導AML12細胞凋亡的影響
王家玉?周浩雄?田軒?郭云蔚

【摘要】目的 探究內質網應激抑制劑GSK2606414在預防酒精聯合棕櫚酸誘導的AML12細胞凋亡的作用及機制。方法 選取C57BL/6雌性小鼠10只,隨機分為對照組(n = 5)及模型組(n = 5)。采用Lieber-DeCarli液體飲食誘導小鼠酒精性脂肪肝模型。免疫組織化學法、蛋白免疫印跡法及實時定量PCR法檢測內質網應激相關蛋白活化轉錄因子4(ATF4)和CCAAT/增強子結合蛋白同源蛋白(CHOP)的表達水平。使用酒精加棕櫚酸處理AML12鼠正常肝細胞24 h后檢測ATF4及CHOP的改變情況。利用GSK2606414抑制劑預處理AML12細胞,隨后使用酒精加棕櫚酸處理,蛋白免疫印跡法檢測ATF4及CHOP的表達,TUNEL法檢測細胞凋亡情況。結果 血清ALT、AST水平及病理結果均證實酒精性脂肪肝小鼠模型建立成功,模型組ATF4和CHOP蛋白的表達高于對照組(P均< 0.001)。酒精加棕櫚酸刺激AML12肝細胞后ATF4和CHOP的蛋白表達水平升高(P均< 0.001)。使用GSK2606414抑制劑預處理AML12細胞與未預處理組相比,ATF4和CHOP的蛋白表達受到抑制(P均< 0.05),細胞凋亡減少。結論 GSK2606414抑制劑可改善酒精聯合棕櫚酸誘導的AML12細胞凋亡,其機制可能與其能抑制內質網應激有關。
【關鍵詞】酒精性脂肪肝;內質網應激;GSK2606414;細胞凋亡
Effect and mechanism of GSK2606414 on the apoptosis of AML12 cells induced by alcohol combined with plamitic acid Wang Jiayu, Zhou Haoxiong, Tian Xuan, Guo Yunwei. Department of Gastroenterology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Guo Yunwei, E-mail: guoyw1973@ hotmail. com
【Abstract】Objective To explore the role and mechanism of endoplasmic reticulum stress inhibitor GSK2606414 in preventing the apoptosis of AML12 cells induced by alcohol combined with palmitic acid. Methods C57BL/6 female mice were randomly divided into the control group (n = 5) and model group(n = 5). The mouse models with alcoholic steatohepatitis were established by Lieber-DeCarli liquid diet. Immunohistochemistry, Western blot and RT-PCR were adopted to detect the expression levels of endoplasmic reticulum stress-related proteins ATF4 and CHOP. After normal liver cells of AML12 mice were treated with alcohol and palmitic acid for 24 h, the changes in the expression levels of Activating transcription factor-4(ATF4) and CCAAT/Enhancer binding protein homologous protein (CHOP) were detected. AML12 cells were pretreated with endoplasmic reticulum stress inhibitor GSK2606414, and then treated with alcohol and palmitic acid. Western blot was employed to detect the expression levels of ATF4 and CHOP, and TUNEL assay was utilized to determine the cell apoptosis. Results Serum ALT and AST levels and pathological results confirmed that the alcoholic steatohepatitis mouse model was successfully established. The expression levels of ATF4 and CHOP proteins in the model group were significantly higher than those in the control group (both P < 0.001). The expression levels of ATF4 and CHOP protein were significantly up-regulated after AML12 hepatocytes were stimulated with alcohol and palmitic acid (both P < 0.001). Compared with the non-pretreatment group, the expression levels of ATF4 and CHOP proteins were significantly inhibited and cell apoptosis was remarkably reduced in the AML12 cells pretreated with GSK2606414 inhibitor (both P < 0.05). Conclusion GSK2606414 can mitigate the AML12 cell apoptosis induced by alcohol combined with palmitic acid, probably due to the inhibitory effect upon the endoplasmic reticulum stress.
【Key words】Alcoholic steatohepatitis;Endoplasmic reticulum stress;GSK2606414;Apoptosis
酒精性肝病是由于長期飲酒引起的肝損傷,是世界范圍內慢性肝病的常見原因之一,可由單純性酒精性脂肪肝發展為酒精性肝炎、肝纖維化、肝硬化甚至肝癌[1-3]。內質網是真核細胞的重要細胞器,在分泌蛋白的合成和加工,脂質合成以及鈣的存儲與釋放中起重要作用[4]。它對內外環境刺激極其敏感,當其功能紊亂時導致錯誤折疊與未折疊蛋白在腔內聚集。近年來,酒精誘導的內質網應激和細胞蛋白質穩態的破壞已被認為是導致肝臟疾病的重要機制[5-7]。在本研究中,我們應用GSK2606414作為內質網應激抑制劑,探討其在酒精性脂肪肝的作用及機制,這為預防治療酒精性脂肪肝損傷提供了新的線索。
材料與方法
一、實驗動物
無特定病原體(SPF)C57BL/6b雌鼠10只,8 ~ 9周齡。所有小鼠飼養于中山大學附屬第三醫院實驗動物中心,保持室溫25℃,光暗周期12 h/12 h,
飼養期間小鼠自由進食飲水。本動物實驗倫理經中山大學實驗動物管理與使用委員會審批通過(IACG-F318-1103)。
二、實驗試劑及儀器
1.主要試劑及抗體
F12培養液(Gibco)、乙醇(Sigma, 美國)、棕櫚酸(Sigma, 美國)、GRP78(Proteintech, 中國)、ATF4(Proteintech, 中國)、CHOP(Proteintech, 中國)、β-actin(Sigma, 美國)、DAB顯色液(Vector),HE染液(雷根生物);TUNEL試劑盒(塞維爾,中國)。AML12小鼠正常肝細胞為中山大學附屬第三醫院消化內科實驗室保有細胞。
2.主要儀器
顯微鏡(Leica,Germany),SDS-PAGE電泳槽(BIO-RAD, US),轉膜儀(BIO-RAD, US),PCR 儀(Las),Nanodrop 2000微量紫外分光光度計(Thermo Scientific, US),低溫高速冷凍離心機(Thermo Scientific, US)等。
三、實驗方法
1.酒精性脂肪肝小鼠動物模型建立
選用8 ~ 9周齡的C57BJ/6L背景的雌性小鼠,將10只小鼠隨機分為對照組和模型組,每組5只小鼠。予含Lieber-DeCarli的對照飲食或酒精飲食持續喂養15 d,第16日模型組予酒精灌胃溶液(5 g/kg),對照組予麥芽糖灌胃溶液(9 g/kg)禁食8 h后收集小鼠血液及肝組織。
2. HE染色
將制備好的蠟塊預冷后進行切片,經脫蠟和梯度水化之后,滴加蘇木素染核2 min,蒸餾水沖洗,于磷酸鹽緩沖液(PBS)中返藍,之后用伊紅染色30 s,蒸餾水沖洗后在顯微鏡下觀察染色效果,中性樹膠封片。
3.油紅染色
取冰凍切片于蒸餾水中充分洗滌,加入油紅工作液染1 h,避光密封。水洗后蘇木素染核并用中性樹膠封片,顯微鏡下觀察拍照。
4.免疫組織化學染色
將制備好的蠟塊遇冷后進行切片,經脫蠟和梯度水化后室溫下靜置于3%雙氧水中作用10 min。將玻片放入pH為9.0的檸檬酸鈉緩沖液中高壓熱修復3 min,待室溫冷卻后取出玻片,于室溫下牛血清白蛋白(BSA)封閉30 min,分別加入對應一抗4℃敷育過夜,PBS沖洗5 min后滴加二抗(1∶300),37℃孵育2 h,PBS沖洗后滴加二甲基聯苯胺(DAB)顯色,于蒸餾水中終止反應,蘇木素染核后用中性樹膠封片。顯微鏡下觀察拍照。
5.蛋白免疫印跡法
根據總蛋白提取裂解液說明書按步驟操作,取適量蛋白樣本進行電泳,應用轉膜儀將蛋白印跡轉移至硝酸纖維素膜上,用5%牛奶封閉1 h,分別加入對應一抗后4℃敷育過夜,三羥甲基氨基甲烷鹽緩沖液(TBST)洗滌10 min,滴加二抗(1∶5000)室溫孵育2 h,TBST洗滌15 min,化學發光法發光顯像,采用Image J圖像分析軟件進行結果分析。
6. AML小鼠正常肝細胞培養及處理
將細胞接種于6孔板中,用含10%胎牛血清的F12培養基培養,分組如下:空白對照組(細胞正常培養,不予任何處理)、50 m[mol/L(M)]酒精+250 μM棕櫚酸組、100 mM酒精+250 μM棕櫚酸組、200 mM酒精+250 μM棕櫚酸組、200 mM酒精+250 μM棕櫚酸組+ GSK2606414抑制劑組(在加入酒精及棕櫚酸前30 min加入1 μM GSK2606414預處理)。繼續孵育24 h后行相關檢測。
7.實時定量PCR法
根據RNA快速提取試劑盒說明書提取組織總RNA,紫外分光光度計測定RNA純度與濃度,逆轉錄后測定目的基因。
8. TUNEL
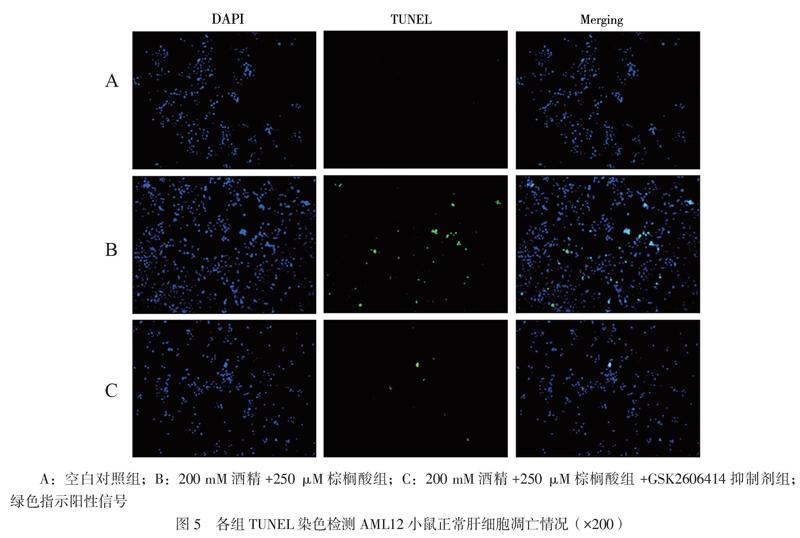
選取空白對照組、200 mM酒精+250 μM棕櫚酸組、200 mM酒精+250 μM棕櫚酸組+GSK2606414抑制劑組,根據塞維爾公司的TUNEL產品說明書進行操作,檢測3組凋亡細胞,DAPI顯色后細胞核呈藍色,顯微鏡下觀察細胞凋亡情況。
四、統計學處理
應用SPSS 23.0和GraphPad prism 8.0軟件進行統計學分析及作圖。正態分布數據均以表示, 2組間比較采用兩獨立樣本t檢驗, 多組間比較采用單因素方差分析,多重比較采用Dunnet-t檢驗。P < 0.05為差異有統計學意義。
結果
一、小鼠肝臟損傷的評估
模型組小鼠血清ALT、AST[(97.7±6.3)U/L,?(211.0 ±15.3)U/L]水平均對高于對照組小鼠 [(23.8±2.6)U/L, (97.4±1.6)U/L],差異均有統計學意義(tALT = 10.860, tAST = 7.364,P均< 0.001)。HE染色結果顯示,對照組小鼠肝組織結構清晰,肝細胞完整、條索明顯且排列整齊,肝小葉結構正常。而模型組小鼠肝小葉結構紊亂,出現大量明顯的脂肪空泡及炎性細胞浸潤。油紅染色可觀察到對照組小鼠肝臟切片中無顯著紅色脂肪組織部分,而在模型組小鼠肝臟中可見大量紅色脂肪組織,提示酒精組肝臟脂肪變性明顯。以上結果表明小鼠造模成功,見圖1。
二、小鼠肝臟中內質網應激表達情況
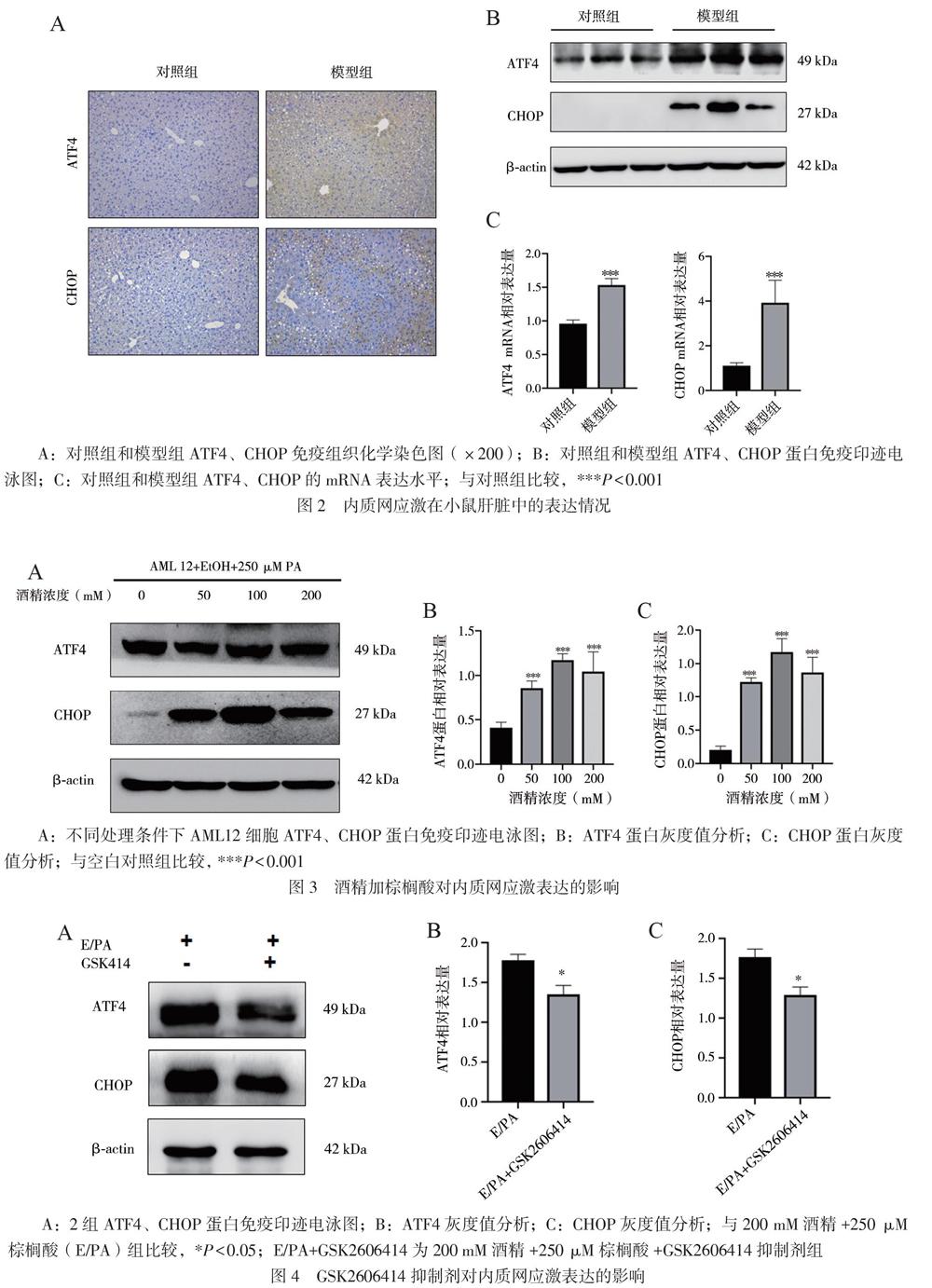
根據免疫組織化學及蛋白免疫印跡分析結果顯示,模型組小鼠內質網應激相關蛋白ATF4及CHOP表達水平均高于對照組;模型組小鼠肝組織中ATF及CHOP的表達水平亦均高于對照組,差異有統計學意義(t = 11.530、6.206,P均< 0.001),見圖2。
三、酒精聯合棕櫚酸干預AML12細胞內質網應激表達情況
使用酒精聯合棕櫚酸處理AML12鼠正常肝細胞24 h后,與空白對照組相比,蛋白免疫印跡法灰度分析結果顯示,空白對照組 ATF4/β-actin為?0.409±0.035,各處理組50、100、200 mM ATF4/β-actin依次0.858±0.047,1.17±0.041,1.040±0.128;對照組 CHOP/β-actin為0.204± 0.032,各處理組50、100、200 mM CHOP/β-actin依次為1.230±0.035,1.670±0.116,1.370±0.131。各處理組50、100、200 mM內質網應激相關蛋白ATF4及CHOP表達均高于未處理組(FATF4=20.620,FCHOP=49.570,P均< 0.001),見圖3。
四、GSK2606414抑制劑對AML12細胞內質網應激表達情況的影響
與200 mM酒精+250 μM棕櫚酸組相比,200 mM酒精+250 μM棕櫚酸+GSK2606414抑制劑組ATF4及CHOP蛋白表達受到抑制(tATF4 = 5.555,tCHOP = 5.806,P均< 0.05),見圖4。
五、GSK2606414抑制劑對AML12細胞凋亡的影響
3組細胞采用TUNEL法檢測細胞凋亡情況,與空白對照組相比,酒精+櫚酸組細胞凋亡情況明顯升高,而加入GSK2606414抑制劑后,肝細胞凋亡情況得到明顯改善,見圖5。
討論
全世界約有50%的因肝病導致的死亡與慢性飲酒有關,由于異常的脂肪生成和脂肪酸β-氧化,酒精性脂肪肝被認為是一個惡性循環,目前也沒有絕對有效的藥物能夠徹底治愈酒精性肝病[8]。酒精性肝病的進展似乎是各種潛在過程的相互作用,長期飲酒會誘發內質網應激,破壞細胞周期進程,促進肝臟疾病進一步發展[9]。
內質網應激是體內眾多疾病病理過程中的重要損傷機制之一。由于外源性應激源的存在使得內質網的功能受到干擾,內質網中大量未折疊或錯誤折疊的蛋白成為內質網應激源,活化GRP78蛋白并選擇性地激活位于內質網應激膜上的蛋白激酶R樣內質網激酶(PERK)、ATF6及內質網核信號轉導蛋白1,繼而活化其相應的下游信號通路,下游分子通過調控基因轉錄與蛋白合成等,介導細胞的生存、損傷及死亡[10]。GSK2606414是PERK信號通路的選擇性抑制劑,在發生內質網應激的細胞中給予GSK2606414處理后,可有效抑制PERK蛋白的自身磷酸化活化,繼而抑制下游的eIF2 /ATF4/CHOP信號通路[11]。既往實驗表明GSK2606414可以抑制棕櫚酸誘導的JNK信號通路的活化和原代小鼠肝細胞的細胞凋亡[12]。在本研究中,我們選取野生基因背景的小鼠,應用NIAAA建立的慢性酒精喂養加急性酒精灌胃的模型,有效復制了酒精性脂肪肝患者中經常慢性飲酒伴隨過度飲酒者的飲酒行為和慢加急性肝損傷[13-14]。
Wang等[15]研究發現構建酒精加棕櫚酸細胞模型相對于傳統方法更有效的模擬出體外的酒精性脂肪肝模型。我們在AML12細胞實驗上通過酒精協同棕櫚酸共同干預,誘導細胞發生脂肪樣變,也成功在體外模擬出酒精性脂肪肝損傷模型。本研究結果表明,通過病理組織觀察及血清指標檢測, 結果顯示酒精性脂肪肝模型誘導成功,同時其內質網應激表達水平亦出現了明顯的升高。接下來的細胞實驗亦證明了這一點,酒精加棕櫚酸處理AML12細胞后內質網應激表達情況均高于未處理組,應用GSK2606414抑制劑預處理細胞后,其內質網應激表達水平受到了抑制且細胞凋亡明顯減輕,進而改善了慢性酒精性肝損傷。在酒精性肝病研究過程中能量代謝也是當下研究的熱點之一,越來越多的證據表明,內質網和線粒體都是肝臟能量穩態的關鍵因素,肝臟的胰島素抵抗與線粒體功能障礙,內質網應激,脂質和Ca2+穩態改變有關[16-17]。既往有研究發現內質網與線粒體之間存在物理接觸的線粒體關聯性內質網膜(MAM)結構是細胞中重要的相互作用之一。內質網與線粒體接觸位點允許兩種細胞器在功能上相互調節,從而影響各項細胞活動,如能量代謝以及細胞死亡和存活的調節[18-19]。因此本實驗也為下一步酒精性肝病其他的相關機制研究提供了思路。
綜上所述,我們的研究表明在酒精性脂肪肝中內質網應激表達水平升高,而GSK2606414抑制劑預處理后可明顯抑制內質網應激來減輕肝細胞凋亡情況。因此,GSK2606414作為一種內質網應激的抑制劑,有望作為一種新型的靶點來治療酒精性脂肪肝。
參 考 文 獻
[1] 中華醫學會肝病學分會脂肪肝和酒精性肝病學組,中國醫師協會脂肪性肝病專家委員會.酒精性肝病防治指南(2018更新版).中華肝臟病雜志, 2018,26(3):188-194.
[2] Singal AK, Bataller R, Ahn J, Kamath PS, Shah VH. ACG clinical guideline: alcoholic liver disease. Am J Gastroenterol,2018,113(2):175-194.
[3] Seitz HK, Bataller R, Cortez-Pinto H, Gao B, Gual A, Lackner C, Mathurin P, Mueller S, Szabo G, Tsukamoto H. Alcoholic liver disease. Nat Rev Dis Primers,2018,4(1):16.
[4] Srinivasan MP, Bhopale KK, Amer SM, Wan J, Kaphalia L, Ansari GS, Kaphalia BS. Linking dysregulated AMPK signaling and ER stress in ethanol-induced liver injury in hepatic alcohol dehydrogenase deficient deer mice. Biomolecules, 2019, 9? (10):560.
[5] Xia SW, Wang ZM, Sun SM, Su Y, Li ZH, Shao JJ, Tan SZ, Chen AP, Wang SJ, Zhang ZL, Zhang F, Zheng SZ. Endoplasmic reticulum stress and protein degradation in chronic liver disease. Pharmacol Res,2020,161:105218.
[6] 侯羽菲, 陳吉.酒精性肝病治療的新進展. 世界最新醫學信息文摘,2018,18:156-159.
[7] Gu Y, Yang Y, Cao X, Zhao Y, Gao X, Sun C, Zhang F, Yuan Y, Xu Y, Zhang J, Xiao L, Ye J. Plin3 protects against alcoholic liver injury by facilitating lipid export from the endoplasmic reticulum. J Cell Biochem,2019,120(9):16075-16087.
[8] Teschke R. Alcoholic liver disease: alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects. Biomedicines,2018,6(4):106.
[9] Ji C. New insights into the pathogenesis of alcohol-induced ER stress and liver diseases. Int J Hepatol,2014,2014:513787.
[10] Walter P, Ron D. The unfolded protein response: from stress pathway to homeostatic regulation. Science,2011,334(6059):1081-1086.
[11] Axten JM, Medina JR, Feng Y, Shu A, Romeril SP, Grant SW, Li WH, Heerding DA, Minthorn E, Mencken T, Atkins C, Liu Q, Rabindran S, Kumar R, Hong X, Goetz A, Stanley T, Taylor JD, Sigethy SD, Tomberlin GH, Hassell AM, Kahler KM, Shewchuk LM, Gampe RT. Discovery of 7-methyl-5-(1-{[3-(trifluoromethyl)phenyl]acetyl}-2,3-dihydro-1H-indol-5-yl)-7H-pyrrolo[2,3-d]pyrimidin-4-amine (GSK2606414), a potent and selective first-in-class inhibitor of protein kinase R (PKR)-like endoplasmic reticulum kinase (PERK). J Med Chem,2012,55(16):7193-7207.
[12] Win S, Than TA, Le BH, García-Ruiz C, Fernandez-Checa JC, Kaplowitz N. Sab (Sh3bp5) dependence of JNK mediated inhibition of mitochondrial respiration in palmitic acid induced hepatocyte lipotoxicity. J Hepatol,2015,62(6):1367-1374.
[13] Bertola A, Mathews S, Ki SH, Wang H, Gao B. Mouse model of chronic and binge ethanol feeding (the NIAAA model). Nat Protoc,2013,8(3):627-637.
[14] Lamas-Paz A, Hao F, Nelson LJ, Vázquez MT, Canals S, Gómez Del Moral M, Martínez-Naves E, Nevzorova YA, Cubero FJ. Alcoholic liver disease: utility of animal models. World J Gastroenterol,2018,24(45):5063-5075.
[15] Wang F, Tipoe GL, Yang C, Nanji AA, Hao X, So KF, Xiao J. Lycium barbarum polysaccharide supplementation improves alcoholic liver injury in female mice by inhibiting stearoyl-CoA desaturase 1. Mol Nutr Food Res,2018,62(13):e1800144.
[16] Fu S, Yang L, Li P, Hofmann O, Dicker L, Hide W, Lin X, Watkins SM, Ivanov AR, Hotamisligil GS. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endo-plasmic reticulum stress in obesity. Nature,2011,473(7348):528-531.
[17] Kim YS, Kim SG. Endoplasmic reticulum stress and autophagy dysregulation in alcoholic and non-alcoholic liver diseases. Clin Mol Hepatol,2020,26(4):715-727.
[18] Tubbs E, Theurey P, Vial G, Bendridi N, Bravard A, Chauvin MA, Ji-Cao J, Zoulim F, Bartosch B, Ovize M, Vidal H, Rieusset J. Mitochondria-associated endoplasmic reticulum membrane (MAM) integrity is required for insulin signaling and is implicated in hepatic insulin resistance. Diabetes,2014,63(10):3279-3294.
[19] English AM, Schuler MH, Xiao T, Kornmann B, Shaw JM, Hughes AL. ER-mitochondria contacts promote mitochondrial-derived compartment biogenesis. J Cell Biol,2020,219(12):e202002144.
(收稿日期:2020-12-08)
(本文編輯:楊江瑜)

