高效液相色譜法測定海洋生物中牛磺酸的含量
柳小英 毛麗沙 鮑敏潔 周瑾 金火喜


摘要[目的]建立牛磺酸的高效液相色譜分析方法,并通過該方法測定不同海洋生物中牛磺酸的含量。[方法]應用鄰苯二甲醛(OPA)柱前衍生法,研究流動相比例、流速、衍生劑比例、衍生時間等因素對牛磺酸檢測的影響。[結果]當牛磺酸∶OPA=1∶2,衍生時間2 min,流動相乙腈∶水=15∶85,流速為0.5 mL/min,檢測波長為360 nm時,牛磺酸濃度為10~400 μg/mL時具有良好的線性關系(R2>099),平行樣品的相對標準偏差為2.9%~7.4%。利用該方法檢測不同海產品中牛磺酸的含量,所選擇的海洋貝類、甲殼類、魚類中均含有牛磺酸,其中海瓜子中含量最高,達11.2 mg/g。不同組織比較,魚肉中牛磺酸含量較高,而鰓中較低。[結論]該研究結果豐富了海洋生物中牛磺酸含量的數據,為進一步研究牛磺酸在不同組織中的合成機制提供了參考。
關鍵詞海產品;高效液相色譜;牛磺酸
中圖分類號S-3文獻標識碼A文章編號0517-6611(2017)31-0001-03
Abstract[Objective]The aim was to establish the analytical method of taurine by high performance liquid chromatograph and detect the taurine content in different seafood tissues. [Method]The precolumn derivatization of ophthalaldehyde (OPA) was used to detect the taurine by studying the effects of flow phase ratio, flow rate, ratio of derivatization agent and derivatization time. [Result]The linear range (R2> 0.99) was in the range of 10-400 μg/mL at the taurine∶OPA=1∶2, derivatization time 2 min, acetonitrile∶water=15∶85, flow rate 0.5 mL/min, wavelength 360 nm. The relative standard deviation of the parallel samples was 2.9%-7.4%. The content of taurine in different seafood was tested by using this method. The results showed that taurine was determined in all selected marine shellfish, crustaceans and fish. The highest content of taurine was observed in the baby clam, which was up to 11.2 mg/g. Compared with different tissues of fish, the content of taurine in muscle was the higher, while the lower in gill. [Conclusion]The results of this study enrich the data of taurine content in marine life, and provide reference for the further study of the synthesis mechanism of taurine in different tissues.
Key wordsSeafood;High performance liquid chromatography;Taurine
牛磺酸,分子式C2H7NO2S,是一種含硫的特殊氨基酸,在體內不參與蛋白質合成,以游離狀態存在。牛磺酸具有廣泛的生理功能,它的缺乏能造成視網膜退化,最終導致失明[1];具有保護肝細胞的作用,能降低細菌毒素、次級膽酸及四氯化碳等對肝的損傷[2-3];具有良好的抗氧化功效,能有效降低腦組織的氧化損傷[4-5];能促進免疫器官的發育,增強動物的免疫機能[6-7];能促進動物對某些營養物質的吸收和轉運,從而促進動物的生長發育[8-9]。此外,研究還發現牛磺酸對動物的大腦發育有著至關重要的作用,牛磺酸的缺乏會導致中樞神經系統發育受阻,智力低下[10-11]。因此,在嬰幼兒時期,飲食中需適當補充一定量的牛磺酸,特別是用牛乳代替母乳喂養的嬰幼兒。隨著對牛磺酸研究的不斷深入,其越來越多的生理作用被挖掘。牛磺酸不僅在臨床上被用于心血管、糖尿病、眼部等疾病的治療[12-14],還被用作食品添加劑添加到一些功能飲料及營養保健品中。
牛磺酸廣泛分布于哺乳動物和海洋生物中。哺乳動物的主要臟器,如心臟、腦、肝臟等中均含有一定量的牛磺酸;海洋生物是牛磺酸的天然寶庫,尤其是螺類、貝類等軟體動物,其牛磺酸含量十分豐富[15-17]。據文獻報道,牡蠣、翡翠貽貝、馬氏珠母貝和蠑螺,其體內牛磺酸的含量均超過8 000 mg/kg[18]。隨著對牛磺酸研究的日漸深入,其檢測方法也日趨完善。從早期靈敏度較低的滴定法和比色法等逐漸發展到現在的氨基酸自動分析法和高效液相色譜法(HPLC)等。氨基酸自動分析法由于設備價格昂貴且使用范圍較窄(一般僅用于檢測分析氨基酸),限制了其廣泛使用。高效液相色譜法是目前檢測牛磺酸最主要的方法,根據衍生試劑的不同又分為異硫氰酸苯酯(PITC)衍生法、丹磺酰氯(Dansyl-Cl)衍生法[19]和鄰苯二甲醛(OPA)衍生法[15-17]等,其中鄰苯二甲醛衍生法由于安全無毒、操作簡便而備受青睞。
目前,有關海洋生物體內牛磺酸的檢測已有相關文獻報道,但基本都針對單一物種。
為此,筆者采用鄰苯二甲醛為衍生劑,巰基乙醇為保護劑,建立了峰形良好、快速準確的牛磺酸檢測方法,并用該方法檢測了不同海洋生物體內牛磺酸的含量。
1材料與方法
1.1材料
1.1.1試驗材料。
美國紅魚、貽貝、白蛤等海洋生物購于舟山市樂購超市。
1.1.2試劑與藥劑。
牛磺酸、鄰苯二甲醛、乙腈(色譜純)、硼酸、氫氧化鈉、巰基乙醇、磷酸氫二鈉、磷酸二氫鈉等試劑均購于阿拉丁公司。
衍生試劑:稱取0.01 g鄰苯二甲醛,用1.00 mL甲醇溶解,再加入0.01 mL巰基乙醇,用硼酸鈉緩沖液(0.4 mol/L,pH 9.5)定容至10.00 mL,在冰箱中密封避光保存。牛磺酸標準液(1 mg/mL):稱取0.05 g牛磺酸,用磷酸緩沖液(pH 7.4)定容至50.00 mL。
1.1.3儀器。
Agilent 1200高效液相色譜儀(美國Agilent公司),Agilent XDB-C18色譜柱(4.6 mm × 150.0 mm,5 μm),FS-1高速勻漿機(江蘇金壇市環宇科學儀器廠)。
1.2方法
1.2.1牛磺酸分析方法的建立。
在1.5 mL離心管中加入250 μL牛磺酸標樣,于37 ℃恒溫水浴鍋預熱3 min,加入一定量衍生劑進行衍生化反應2 min。反應液經0.45 μm微孔濾膜過濾,立刻進樣20 μL于高效液相色譜儀中,記錄其峰面積及其保留時間。根據峰型、保留時間等指標對流動相比例、流速等條件進行優化。初始條件:色譜柱XDB-C18,乙腈∶水=20∶80,牛磺酸∶衍生劑=1∶2,流速0.5 mL/min,衍生3 min,波長360 nm。
1.2.2牛磺酸標準曲線的繪制。
將牛磺酸標準液(1 mg/mL)用磷酸緩沖液(pH 7.4)依次稀釋成0.40、0.20、0.10、0.05、0.02、0.01 mg/mL 6個濃度梯度。按照“1.2.1”所述步驟對牛磺酸濃度進行測定。以牛磺酸濃度為橫坐標,峰面積為縱坐標制作標準曲線。
1.2.3精密度測試。
分別取0.01、0.10、0.40 mg/mL的牛磺酸標準溶液,按照“1.2.1”所述步驟對牛磺酸濃度進行測定。每種濃度平行測定3次,記錄峰面積,并計算相對標準偏差。
1.2.4樣品中牛磺酸含量檢測。
取20 g洗凈的海洋生物組織(肉、內臟、鰓等),加入2.5倍體積磷酸鹽緩沖液(0.02 mol/L,pH 7.4),在冷水循環控溫下勻漿30 min后離心20 min(4 ℃,8 000 r/min)去沉淀。上清液中加入2倍體積的無水乙醇脫蛋白,10 000 r/min離心15 min,按照上述方法檢測上清液中牛磺酸的含量。
2 結果與分析
2.1流動相比例選擇
選用乙腈與水作為流動相,分別選擇體積比15∶85、20∶80、30∶70、40∶60進行試驗。由表1可知,隨著乙腈比例的增加,牛磺酸與相鄰峰的分離度變差,保留時間不斷縮短,但吸收峰面積也逐漸減小。在牛磺酸濃度為0.10 mg/mL下,當乙腈∶水=20∶80時,牛磺酸達到基線分離,保留時間為2.98 min,峰面積為172.8;當乙腈∶水=15∶85時,牛磺酸保留時間延長到3.92 min,但峰面積增加到345.3;繼續減小乙腈的比例,保留時間會進一步延長。綜合考慮吸收峰面積及保留時間,選擇流動相乙腈和水的比例為15∶85。
2.2流動相流速選擇
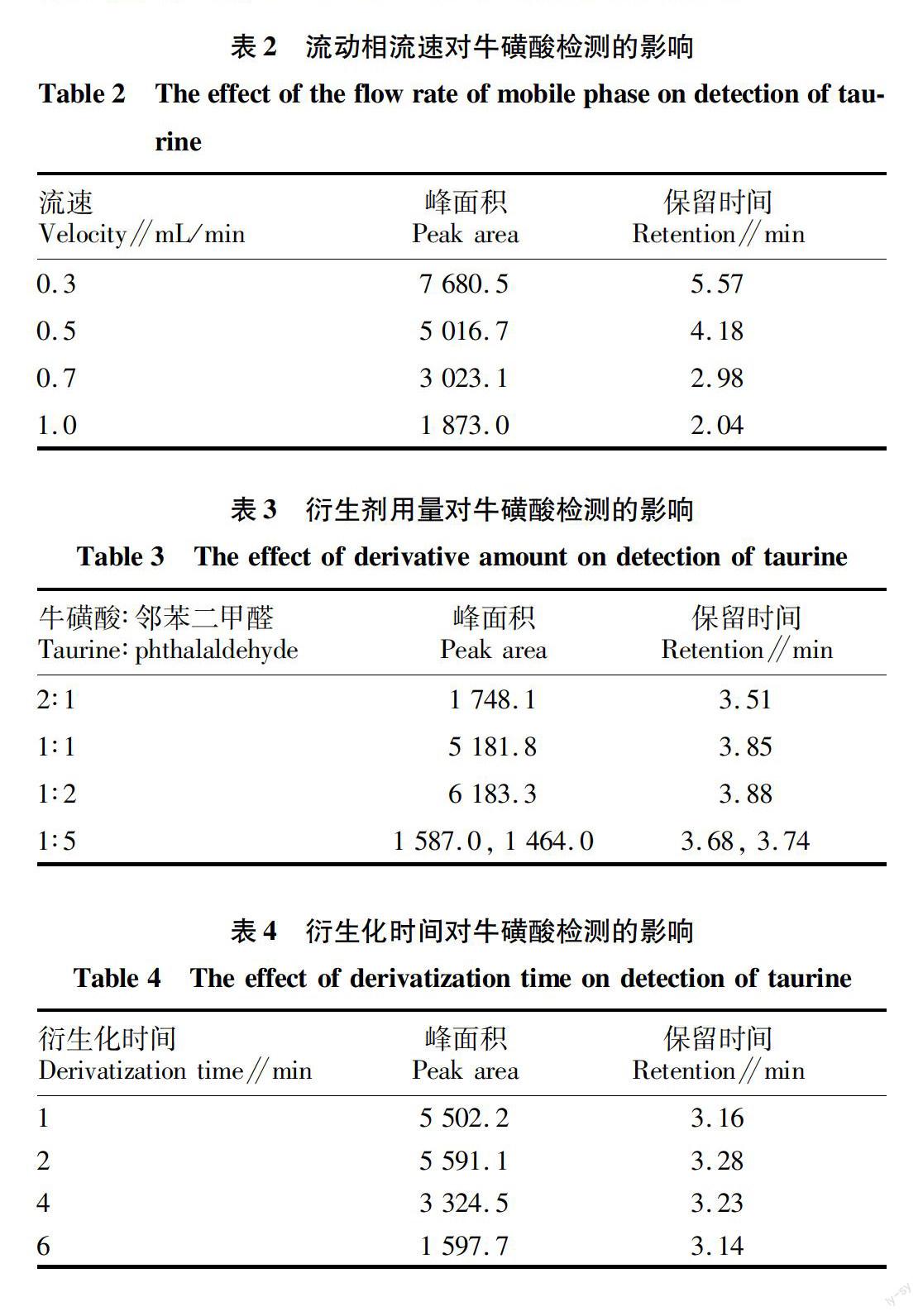
流動相流速是影響高效液相色譜檢測的重要因素,流速太慢,目標物質保留時間延長,峰型變寬;流速增快可以縮短保留時間,但過快則容易導致目標物質尚未完全檢測,峰面積變小。該試驗選擇波長360 nm,乙腈和水(15∶85)為流動相,考察不同流速(0.3、0.5、0.7、1.0 mL/min)對牛磺酸(1.0 mg/mL)檢測的影響。結果發現,不同流速下牛磺酸均有良好的分離效果,但保留時間和峰面積均隨流速的增大而減小(表2)。綜合考慮峰面積和保留時間,選擇0.5 mL/min為最終流動相的流速。
2.3衍生劑用量的選擇
衍生劑用量也是影響牛磺酸檢測的重要因素,衍生劑過少,反應不完全,結果準確性差;衍生劑過多則容易影響峰型。該試驗選擇不同量的衍生劑(牛磺酸標樣和衍生劑鄰苯二甲醛的摩爾比為2∶1、1∶1、1∶2、1∶5),通過觀察峰面積和峰型,最終確定衍生劑的最適用量。由表3可知,隨著衍生劑用量的增加,牛磺酸峰面積也逐漸增加,保留時間則變化不大。但當衍生劑與底物摩爾比達5∶1時,牛磺酸標樣出現2個分裂峰,保留時間分別為3.68和3.74 min,分離度差,未達到基線分離,說明衍生劑過量確實會影響峰型。綜上考慮,最終選擇底物牛磺酸與衍生劑鄰苯二甲醛摩爾比為1∶2。
2.4衍生時間的選擇
牛磺酸與衍生試劑鄰苯二甲醛反應迅速,靈敏度高,但衍生產物并不穩定,衍生時間過長,產物分解,峰面積減小。該試驗考察了不同衍生時間(1、2、4、6 min)對牛磺酸檢測的影響。由表4可知,衍生時間為2 min時,牛磺酸峰面積達到最大;繼續延長衍生時間,峰面積逐漸減小,衍生時間為6 min時,峰面積下降至1 597.7,說明衍生物已經部分分解。因此,確定衍生時間為2 min。
2.5牛磺酸標準曲線
在上述最優條件下,牛磺酸標樣的色譜如圖1所示。以牛磺酸標準品濃度為橫坐標,峰面積為縱坐標制得牛磺酸標準曲線(圖2)。當牛磺酸濃度在10~400 μg/mL時,牛磺酸的濃度與峰面積呈良好的線性關系,回歸方程為y=6.516 3x+30.192,R2=0.997 3。
2.6方法的精密度
選擇3個不同濃度的牛磺酸標樣,分別為低濃度(10 μg/mL)、中濃度(100 μg/mL)和高濃度(400 μg/mL),同一樣品重復測定3次,峰面積見表5。該3種濃度的牛磺酸標樣的相對標準偏差分別為2.9%、7.4%和3.4%,說明該方法的精密度較高,具有良好的重現性。
2.7海洋生物樣品中牛磺酸含量的檢測
選擇了十幾種常見的海洋生物,對其不同組織中牛磺酸含量進行了檢測。由表6可知,所選擇的海洋生物,包括貝類、魚類和甲殼類,均檢測到相當濃度的牛磺酸。特別是貝類和螺類,其牛磺酸含量十分豐富,如芝麻螺中含量達10.3 mg/g,而海瓜子中更是高達11.2 mg/g,蟶子、蛤蜊和血蛤中含量也較高。據文獻報道[18],牡蠣、蠑螺和翡翠貽貝中牛磺酸含量在8 000 mg/kg以上,馬氏珠母貝中含量更是高達13 830 mg/kg。該試驗中,蟶子、芝麻螺和海瓜子中牛磺酸含量也在9 000 mg/kg以上。由文獻報道和該試驗結果可知,牛磺酸在貝類和螺類中最豐富。相比于貝類和螺類,海洋魚類中牛磺酸含量相對偏低,但不同組織內牛磺酸含量有所不同。一般來說,魚肉中牛磺酸含量較高,而鰓中則較少,如大黃魚,魚肉中牛磺酸含量為4.8 mg/g,而鰓中只有0.8 mg/g。此外,牛磺酸含量在內臟中的分布也因魚種的不同而不同。在海鱸魚的肝臟、腸和鰓3種內臟中,肝臟中牛磺酸含量最高,為4.6 mg/g,而鰓中含量最低,為1.8 mg/g。然而,在美國紅魚的3種內臟中,牛磺酸含量的差異并不大。
迄今為止,有關海洋生物中牛磺酸含量的檢測已有不少文獻報道,該研究是對前人工作的進一步補充和豐富。當然,生物體內牛磺酸的含量受到其生長環境的影響,同一種生物在不同的生長水域和季節以及不同的個體大小,其牛磺酸含量均可能存在差異。因此,不同的學者對同一種生物進行測量,可能會得到不同的結果。
3結論
該研究成功建立了快速準確的牛磺酸高效液相色譜分析方法。應用鄰苯二甲醛(OPA)為柱前衍生試劑,衍生時間2 min,牛磺酸∶OPA=1∶2,流動相乙腈∶水=15∶85、流速為05 mL/min,色譜柱Agilent Eclipse XDB-C18,檢測波長為360 nm。該方法牛磺酸含量在10~400 μg/mL時具有良好的線性關系(R2>0.99),平行樣品的相對標準偏差為2.9%~
74%。不同海產品中牛磺酸含量檢測結果表明,所選擇的海洋生物中均含有一定量牛磺酸,尤其是貝類和螺類中含量最豐富,最高達11.2 mg/g。不同組織比較,魚肉中牛磺酸含量較高,而內臟中鰓中含量較低。該試驗結果豐富了海洋生物中牛磺酸含量檢測的相關研究,為進一步研究和分析牛磺酸在不同組織中的合成機制提供了參考。
參考文獻
[1] 張劍利,蘇小玫.牛磺酸與視網膜功能的關系[J].眼科,2003,12(5):311-313.
[2] 李靜員,楊雅娟,馮艷,等.牛磺酸對實驗性肝纖維化大鼠保護作用的研究[J].天津中醫藥,2017,34(5):336-340.
[3] ABDRABOU A A,ZOHEIR K M,AHMED H H.Potential impact of curcumin and taurine on human hepatoma cells using Huh7 cell line[J].Clin Biochem,2012,45(16/17):1519-1521.
[4] WINIARSKA K,SZYMANSKI K,GORNIAK P,et al.Hypoglycaemic,antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits[J].Biochimie,2009,91(2):261-270.
[5] 李樂慧,徐兆發,劉巍,等.牛磺酸對甲基汞致大鼠腦氧化損傷的保護作用[J].環境與職業醫學,2014,31(6):469-471.
[6] 曾德壽,高振華,趙京輝,等.牛磺酸對肉仔雞生產性能、免疫器官發育及抗氧化能力的影響[J].中國獸醫學報,2009,29(6):774-778.
[7] SCHULLERLEVIS G B,PARK E.Taurine and its chloramine:Modulators of immunity[J].Neurochemical research,2004,29(1):117-126.
[8] MATSUNARI H,FURUITA H,YAMAMOTO T,et al.Effect of dietary taurine and cystine on growth performance of juvenile red sea bream Pagrus major [J].Aquaculture,2008,274(1):142-147.
[9] KIM S K,TAKEUCHI T,YOKOYAMA M,et al.Effect of dietary taurine levels on growth and feeding behavior of juvenile Japanese flounder Paralichthys olivaceus[J].Aquaculture,2005,250(3/4):765-774.
[10] RAK K,VLKER J,JRGENS L,et al.Neurotrophic effects of taurine on spiral ganglion neurons in vitro[J].Neuroreport,2014,25(16):1250-1254.
[11] KHIMSUKSRI S,WYSS J M,THAEOMOR A,et al.Perinatal taurine exposure programs patterns of autonomic nerve activity responses to tooth pulp stimulation in adult male rats[J].Adv Exp Med Biol,2013,775(4):121-134.
[12] BESSHO M,MURASEMISHIBA Y,IMAGAWA A,et a1.Possible contribution of taurine to distorted glucagon secretion in intraislet insulin deficiency:A metabolome analysis using a novel αcell model of insulindeficient diabetes[J].PLoS One,2014,9(11):113254.
[13] SCHAFFER S W,SHIMADA K,JONG C J,et al.Effect of taurine and potential interactions with caffeine on cardiovascular function[J].Amino Acids,2014,46(5):1147-1157.
[14] 孫建,許振,徐雷.牛磺酸滴眼液聯合淚道探通治療新生兒淚囊炎的療效觀察[J].齊齊哈爾醫學院學報,2014,35(4):539-540.
[15] 葉思平,陳悅嬌,陳海光,等.高效液相色譜測定益智仁中的牛磺酸含量[J].食品科學,2013,34(10):204-206.
[16] 陳申如,胡陽,倪輝,等.高效液相色譜法測定牡蠣中牛磺酸含量[J].中國食品學報,2013,13(2):193-198.
[17] 高加龍,章超樺,劉書成,等.鄰苯二甲醛柱前衍生高效液相色譜法測定馬氏珠母貝中牛磺酸含量[J].廣東海洋大學學報,2007,27(1):55-58.
[18] 譚樂義,章超樺,薛長湖,等.牛磺酸的生物活性及其在海洋生物中的分布[J].湛江海洋大學學報,2000,20(3):75-79.
[19] UBUKA T,OKADA A,NAKAMURA H.Production of hypotaurine from Lcysteinesulfinate by rat liver mitochondria[J].Amino Acids,2008,35(1):53-58.

