CT引導微波消融結合載藥栓塞微球經肝動脈化療栓塞治療原發性肝癌的臨床療效
王秀香,李海霞,李輝,王明月,代樹本
(滄州市第三醫院,1.CT室;2.放射科;3.肝病一科;4.內鏡室,河北 滄州 061001)
調查[1]顯示,僅有20%~25%的原發性肝癌患者可進行肝切除術,剩余患者均因漏診或誤診等錯過手術治療最佳時期。近年來,微波消融術由于具有確切的療效及穿透性強、消融范圍廣等優勢被越來越多的患者和醫生認可,并將其視為一線治療手段[2-3]。肝動脈化療栓塞術(TACE)是一種非手術的方式,可將腫瘤供血動脈精確栓塞,使抗腫瘤藥物得以充分發揮作用,避免化療藥物在患者全身范圍內過度暴露,臨床應用率較高。另外,近年研究[4]的一大熱點就是新型栓塞劑,載藥微球(durg-eluting bead,DEB)可以同時實現載藥和栓塞,是一種優良的栓塞材料。DEB-TACE通過經動脈注射釋放攜帶抗癌藥物微球直接作用于腫瘤血供,實現藥物釋放及腫瘤血管栓塞。關于兩種療法聯合治療原發性肝癌的報道目前國內外尚無。基于此,本研究擬觀察CT引導微波消融(CT-MWA)結合載藥栓塞微球經肝動脈化療栓塞(DEB-TACE)治療原發性肝癌的臨床療效及分析影響術后無瘤生存時間的危險因素。
1 資料與方法
1.1 一般資料
回顧性分析2017年1月至2021年2月滄州市第三醫院收治的80例原發性肝癌患者的臨床資料。按照治療方式不同將患者分為研究組和對照組,每組各40例。其中,研究組男性25例,女性15例,年齡35~78歲,腫瘤直徑13~76 mm;對照組男性26例,女性14例,年齡34~69歲,腫瘤直徑14~75 mm。兩組患者性別、年齡、肝功能分級及腫瘤直徑等一般資料比較,差異無統計學意義(P>0.05)。見表1。納入標準:(1)符合原發性肝癌診斷標準[5];(2)經病理學及影像學檢測結果證實;(3)Child-Pugh肝功能分級A或B;(4)生存期預計≥6個月。排除標準:(1)有器官移植史;(2)門靜脈主干癌栓或累及左/右支的癌栓;(3)遠處轉移;(4)嚴重凝血障礙及出血傾向者;(5)嚴重傳染性者。
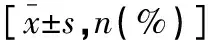
表1 兩組患者一般資料比較
1.2 治療方法
兩組患者均采用DEB-TACE技術,使患者采取仰臥位置,同時術中采用心電監護。吸取200 μm CalliSpheres微球6 mL,靜置0.5 h后棄去上清,剩余液體溶于等比混合的5%葡萄糖溶液及吡柔比星30 mg(深圳萬樂藥業生產),充分混合搖勻,按照等比例加入碘佛醇后搖勻備用。選取股動脈進行賽爾丁格法穿刺,并選取肝動脈附近進行遠端造影,影像學確定病灶部位及血流分布后將載藥微球以1 mL/min勻速且緩慢的注入供血動脈,觀察造影情況,若造影劑出現流速減慢或完全停滯現象,則停止注射。5 min后可根據情況再次進行血管造影,同時觀察是否完全將腫瘤供血血管處栓塞,術后止血包扎。囑咐患者臥床靜置6 h。
研究組于兩周后聯合用CT-MWA進行治療,術前給予患者禁水禁食,局麻后在CT影像學引導下盡可能避免損傷胃腸管、膽囊及重要血管,選擇進針路徑。消融范圍以完全覆蓋至腫瘤邊緣1 cm為宜,時間范圍為3~6 min,功率范圍為30~55 W。術中持續檢測患者生命指標,術畢邊退針邊消融針道。術后對患者進行鎮痛等對癥治療。
1.3 觀察指標
1.3.1 臨床療效評價 參照實體瘤療效評價標準(re-sponse evaluation criteria in solid tumors,RECIST)于手術結束后1個月對患者術后臨床療效進行判定。術后肝癌病灶體積減少>50%,且在近1個月內疾病未出現進展為完全緩解(CR);肝癌病灶體積減少25%~50%為部分緩解(PR);病灶體積減少<25%,且未發現有新的腫瘤病灶為疾病穩定(SD);肝癌病灶體積出現增大且增大范圍>25%,或有新的出現為疾病進展(PD)。臨床有效率=完全緩解率+部分緩解率[6]。
1.3.2 肝功能及腫瘤標志物 (1)肝功能:于治療前及治療后的兩周采用全自動生化分析儀(東芝LST008)對患者肝功能指標ALT、AST、TBIL及ALB進行檢測。檢查前禁食、禁水12 h,于清晨空腹取12 mL肘靜脈血。將其分別放置于2支試管,1支用于檢測肝功能,將試管放置于-4 ℃的環境下按照3 000 r/min的速度進行離心處理,取上層血清檢測肝功能。(2)腫瘤標志物:另1支用于檢測腫瘤標志物水平。腫瘤標記物陽性標準如下:甲胎蛋白>40 ng/mL;CA199>37 U/L[7]。
1.3.3 不良反應發生情況 記錄并比較兩組嘔吐、發熱、腹痛及腹脹等不良反應的發生情況,對比治療安全性。
1.4 統計學分析
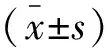
2 結果
2.1 兩組患者治療有效率比較
治療后,研究組患者治療有效率高于對照組(P<0.05)。見表2。

表2 兩組患者治療有效率比較[n(%)]
2.2 兩組治療前后肝功能指標比較
治療后兩周內,兩組ALT、AST、TBIL均降低,且研究組低于對照組(P<0.05);ALB均升高,且研究組高于對照組(P<0.05)。見表3。

表3 兩組治療前后肝功能指標對比
2.3 兩組不良反應發生率比較
治療后,兩組患者均出現嘔吐、發熱、腹痛及腹脹等不良反應,研究組不良反應發生率(10.0%)較對照組(30.0%)更低(P<0.05)。見表4。

表4 兩組不良反應發生率對比[n(%)]
2.4 影響無瘤生存及總生存時間的單因素分析
腫瘤多發、腫瘤大小>3 cm及甲胎蛋白值>20 μg/L患者的平均無瘤生存時間更短(P<0.05);有肝病病史、腫瘤數量多發、腫瘤大小>3 cm及單純采用DEB-TACE術式平均總生存時間更短(P<0.05)。見表5。

表5 影響無瘤生存及總生存時間的單因素分析
2.5 影響無瘤生存期及總生存期的多因素分析
Child-Pugh分級B級、腫瘤數量多發、腫瘤大小>3 cm、甲胎蛋白>20 μg/L、單純采用DEB-TACE手術方式的患者平均無瘤生存時間更短(P<0.05);存在肝病病史、腫瘤數量多發、腫瘤大小>5 cm及單純采用DEB-TACE手術方式的患者平均總生存時間更短(P<0.05)。見表6及表7。

表7 影響生存時間的多因素分析
3 討論
原發性肝癌在確診時大多已經是中晚期,患者肝組織灌注困難,肝功能受損嚴重,患者生活質量和生存質量極低[8]。對中晚期肝癌患者來說,采用手術切除的方式局限性較大,極易受到肝功能、病灶大小等因素的影響,整體治療效果不佳[9]。
DEB-TACE是一種新型介入治療方式,可將腫瘤部位的供血有效阻斷,并通過將化療藥物注入腫瘤部位有效殺滅腫瘤細胞[10]。現有研究[11]指出,DEB-TACE具有更高的安全性及更優的治療效果,尤其在延長兩年生存率方面,栓塞載藥脂微球的使用可有效提高肝癌治療效果,延長生存期,腫瘤的復發率較低,臨床價值顯著[12]。肝動脈栓塞化療可靶向化療藥物至腫瘤部位,但是將血供阻斷的方式會導致化療藥物作用范圍有限,治療效果不佳且病情易反復。載藥微球具有栓塞和載藥功能,是一種優良的栓塞材料[13],借助離子交換機理高效吸附抗腫瘤藥物,使藥物在腫瘤部位實現平穩釋放,提高血藥濃度,減少對機體正常細胞的損傷,降低副作用[14]。
經皮微波消融的優點是消融范圍廣、穿透性強、療效確切,是近年來廣泛用于臨床的重要治療方法[15]。該方式的治療原理在于可以利用腫瘤細胞耐熱性較正常細胞更差,借助微波的熱量凝固腫瘤細胞來治療疾病。同時經皮微波消融操作相對簡便,患者接受度高,合并肝硬化的患者也可采用此方法治療,且對療效影響較小,可提升生存率[16]。
本研究中研究組整體療效較對照組明顯,且治療安全性較高,提示CT-MWA聯合DEB-TACE可有效抑制腫瘤病灶,提高預后。DEB-TACE具有親水性和精確定制的特質,可攜帶高濃度的化療藥物,延長作用于腫瘤細胞的時間,CalliSpheres微球可混懸協載及吸附化療藥物,通過控制藥物在腫瘤部位的藥代動力學實現緩釋功能,降低副作用。同時,載藥微球可通過碘油的導熱性能有效提升消融療效,改善腫瘤標志物水平。在改善肝功能方面,研究組優于對照組(P<0.05),表明聯合治療可進一步改善患者肝腎功能[17]。研究[18-19]指出,腫瘤難治愈的主要原因在于其易轉移和易復發的特性,因此,無論進行肝移植、肝切除還是消融術等,局部治療的方式難以從根本上解決腫瘤轉移和復發的問題。本研究中Child-Pugh分級﹑甲胎蛋白>20 μg/L、腫瘤直徑>5 cm及腫瘤多發等均是影響患者生存期的獨立危險因素,對于符合上述指標的患者,腫瘤復發的概率較大,因此并不適合肝移植和肝切除等有創的治療方式。術前對患者病情進行評估,根據病情選擇合適的治療方式,并在治療后進行定期進行隨訪,可有效控制病情。

