非小細(xì)胞肺癌患者PBMC中SITR1、Nrf2表達(dá)的臨床意義及與預(yù)后的相關(guān)性
何震宇 宋星儀 師澤元 安小康
非小細(xì)胞肺癌(non-small-cell carcinoma,NSCLC)是肺癌最常見的一類分型,也是全球癌癥相關(guān)死亡的主要原因,約75%的患者發(fā)現(xiàn)時已處于中晚期,5年生存率很低[1-2]。目前關(guān)于NSCLC患者的治療方法主要為手術(shù)、化療、放療等,治療介入越早,患者預(yù)后越好[3]。有研究報道核轉(zhuǎn)錄因子E2相關(guān)因子2(nuclear factor E2-related factor 2,Nrf2)是一種重要的轉(zhuǎn)錄因子,可通過抑制機(jī)體氧化應(yīng)激和促腫瘤炎癥來降低患者癌癥的風(fēng)險,但許多癌癥表現(xiàn)出Nrf2活性升高[4];沉默信息調(diào)節(jié)因子1(Silent information regulator 1,SITR1)是腫瘤的啟動子,激活機(jī)體內(nèi)癌基因、創(chuàng)建了有利于腫瘤生存和發(fā)展的微環(huán)境[5]。本研究探討Nrf2、SITR1在NSCLC患者PBMC中的表達(dá)及其臨床意義,并采用Kaplan-Meier法分析SITR1、Nrf2表達(dá)與預(yù)后的關(guān)系。
1 資料與方法
1.1 一般資料
選取2016年1月至2018年12月在我院接受治療的NSCLC患者84例為研究對象。納入標(biāo)準(zhǔn):①經(jīng)病理組織學(xué)確診為NSCLC;②相關(guān)病歷資料完整。排除標(biāo)準(zhǔn):①術(shù)前接受其它治療者;②合并其他腫瘤患者;③臨床病理資料缺乏者;④合并其他自身免疫性疾病;⑤合并原發(fā)性器官功能障礙;⑥患者無法進(jìn)行正常溝通交流。本研究納入患者年齡范圍53~71歲,平均(61.58±8.87)歲;其中男性59例,女性25例;中高分化44例,低分化40例;腫瘤直徑≤5 cm有48例,>5 cm有36例;有淋巴結(jié)轉(zhuǎn)移37例;TNM分期[6]:Ⅰ+Ⅱ期33例,Ⅲ+Ⅳ期51例。另取84例同期健康體檢人員外周血作為對照,其中男性49例,女性35例;年齡51~76歲,平均年齡(62.39±8.14)歲。
1.2 方法
在NSCLC患者治療前,采集84例NSCLC患者和84例健康體檢者的外周靜脈血5 mL,去血漿后,以磷酸鹽緩沖液補(bǔ)充至原體積,應(yīng)用PBMC提取試劑盒(來源:北京匯智和源生物技術(shù)有限公司;貨號:082A01.11)對外周血中的PBMC進(jìn)行提取。-80 ℃速凍箱中處理后的PBMC置于液氮罐,儲存?zhèn)溆谩J褂昧魇郊?xì)胞儀檢測PBMC中SITR1、Nrf2蛋白表達(dá),于PBMC中加入1%多聚甲醛1 ml,室溫固定,加入SITR1、Nrf2抗體20 μL,室溫避光反應(yīng)30 min,加IgC-F1TC 20 μL,室溫避光反應(yīng)30 min,洗滌后上機(jī),選用兔抗人igCl-FITC作為同型對照,記錄SITR1、Nrf2陽性表達(dá)量。嚴(yán)格按照試劑盒的說明書進(jìn)行實驗操作。2個指標(biāo)為同一批樣本分批檢測,高于中位陽性蛋白表達(dá)為高表達(dá)組、低于中位值為低表達(dá)組。
1.3 治療與隨訪方法
NSCLC患者均接受肺癌根治手術(shù)治療,包括腫瘤組織切除術(shù)。術(shù)后根據(jù)患者自身情況予以放療、化療等治療。治療后1年內(nèi)每3個月來我院門診復(fù)查1次,之后每半年(6個月)至少復(fù)查一次,隨訪時間為3年(36個月),截止至2021年12月。記錄患者隨訪狀態(tài)(死亡、存活或其他)。
1.4 統(tǒng)計學(xué)處理
2 結(jié)果
2.1 2組受試者SITR1、Nrf2陽性表達(dá)量比較
NSCLC患者PBMC中SITR1、Nrf2蛋白陽性表達(dá)量均高于健康體檢組(P<0.05)。見表1。
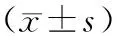
表1 2組受試者PBMC中SITR1、Nrf2陽性表達(dá)量比較
2.2 不同臨床特征NSCLC患者PBMC中各指標(biāo)陽性表達(dá)情況
NSCLC患者PBMC中各指標(biāo)陽性表達(dá)量與其年齡、性別、分化程度、吸煙史無關(guān)(P>0.05),NSCLC患者PBMC中各指標(biāo)陽性表達(dá)量與淋巴結(jié)轉(zhuǎn)移、腫瘤直徑、TNM分期有關(guān)(P<0.05)。見表2。
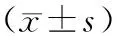
表2 不同臨床特征NSCLC患者PBMC中各指標(biāo)陽性表達(dá)情況
2.3 NSCLC患者PBMC中SITR1表達(dá)水平與3年生存率的關(guān)系
隨訪至截止至2021年12月,總生存率為39.29%(33/84)。SITR1蛋白陽性表達(dá)量中位值為0.87,以中位表達(dá)水平為界將NSCLC患者分為SITR1高表達(dá)組和低表達(dá)組。SITR1高表達(dá)組3年累計生存率為16.67%(7/42),顯著低于SITR1低表達(dá)組61.90%(26/42)(χ2=18.018,P<0.001)。見圖1。

圖1 SITR1高表達(dá)和低表達(dá)患者生存曲線比較
2.4 NSCLC患者PBMC中Nrf2表達(dá)水平與3年生存率的關(guān)系分析
Nrf2蛋白陽性表達(dá)量中位值為1.41,以中位表達(dá)水平為界將NSCLC患者分為Nrf2高表達(dá)組和低表達(dá)組。截止值2021年12月,Nrf2高表達(dá)組3年累計生存率為23.81%(10/42),顯著低于Nrf2低表達(dá)組的54.76%(23/42)(χ2=8.435,P=0.004)。見圖2。

圖2 Nrf2高表達(dá)和低表達(dá)患者生存率比較
3 討論
NSCLC約占所有肺癌的85%,在人體內(nèi)的發(fā)生與發(fā)展是復(fù)雜的病理變化,由于大部分肺癌患者確診時已處于腫瘤晚期,相關(guān)治療手段有限,復(fù)發(fā)和耐藥性導(dǎo)致其臨床治愈率不高[7]。目前臨床中尚缺乏有效、特異度高的指標(biāo)對患者的預(yù)后和病理特征進(jìn)行分析,因此對于NSCLC的病理機(jī)制仍有待進(jìn)一步研究[8]。有研究[9-10]報道SIRT1是一種依賴煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的酶,屬于人的第3類去乙酰化酶,通過催化NAD+依賴的目標(biāo)蛋白的去乙酰化來參與機(jī)體細(xì)胞生長、代謝等生理過程;其基因表達(dá)與腫瘤免疫細(xì)胞浸潤水平之間存在相關(guān)性,進(jìn)而調(diào)控其生物學(xué)功能,在肺癌的免疫逃逸機(jī)制中起著重要作用。Nrf2是氧化應(yīng)激反應(yīng)和藥物解毒的基因,受到異常刺激下,大量的Nrf2進(jìn)入細(xì)胞核,磷酸化后進(jìn)而誘導(dǎo)下游基因表達(dá)異常,從而激活NSCLC患者體內(nèi)抗氧化反應(yīng),調(diào)節(jié)細(xì)胞對毒性和氧化損傷的防御[11-12]。基于此,可通過檢測PBMC來反映NSCLC患者免疫水平。故而本研究旨在探討Nrf2、SITR1在NSCLC患者PBMC中的表達(dá)及與預(yù)后的相關(guān)性。
本研究結(jié)果顯示,在NSCLC患者SITR1、Nrf2蛋白陽性表達(dá)量均高于健康體檢組,SITR1、Nrf2可為NSCLC患者外周血鑒別差異的蛋白。本研究進(jìn)一步結(jié)果顯示,NSCLC患者PBMC中各指標(biāo)陽性表達(dá)與淋巴結(jié)轉(zhuǎn)移、腫瘤直徑、TNM分期情況比較有統(tǒng)計學(xué)上的差異;提示隨著SITR1、Nrf2陽性蛋白表達(dá)升高,NSCIC患者病理特征可能出現(xiàn)趨向于惡化,表明二者可視為潛在的評估患者預(yù)后的重要指標(biāo);結(jié)果同馬永峰、朱學(xué)應(yīng)等研究類似[13-14]。本研究還對NSCLC患者患者進(jìn)行為期3年隨訪發(fā)現(xiàn),SITR1、Nrf2高表達(dá)組生存率顯著低于其低表達(dá)組;表明SITR1、Nrf2高表達(dá)組患者生存時間更短,對應(yīng)患者極易復(fù)發(fā)或惡性腫瘤轉(zhuǎn)移,預(yù)后較差。這可能是由于SIRT1通過代謝依賴性和非代謝依賴性方式調(diào)節(jié)先天性和適應(yīng)性免疫反應(yīng);Nrf2會引起NSCLC患者表皮生長因子受體基因突變,導(dǎo)致惡性腫瘤進(jìn)展事件發(fā)生,激活相關(guān)耐藥基因而引起NSCLC患者對于相關(guān)治療的藥物產(chǎn)生耐藥性,從而降低術(shù)后治療的效果,進(jìn)一步影響患者術(shù)后轉(zhuǎn)歸[15-16]。因此可通過抽取NSCLC患者外周血來檢測SIRT1、Nrf2表達(dá)作為判斷其預(yù)后的指標(biāo)。
綜上所述,NSCLC患者外周血PBMC中SITR1、Nrf2陽性表達(dá)率與腫瘤TNM、淋巴結(jié)有無出現(xiàn)轉(zhuǎn)移、腫瘤最大徑有關(guān);且SITR1、Nrf2高表達(dá)水平患者3年生存率顯著降低。NSCIC患者術(shù)后易發(fā)生復(fù)發(fā)和轉(zhuǎn)移事件,需積極監(jiān)測患者外周血PBMC中SITR1、Nrf2表達(dá),及時進(jìn)行干預(yù)。但本研究臨床樣本量較少,且所有患者均來自同一地區(qū),后續(xù)研究仍需進(jìn)一步追蹤加以分析。

