直腸癌腹腔鏡根治術經自然腔道取標本對患者術后恢復、胃腸激素、機體體液和細胞免疫的影響
婁安華 牛國浩 徐崇娟
直腸癌是臨床較為常見的消化道惡性腫瘤,流行病學調查顯示[1],隨著生活方式以及飲食結構的不斷變化,高蛋白高脂肪飲食的增加,運動量的相對降低,直腸癌的發病率呈現顯著上升趨勢[2]。當前關于直腸癌患者的治療,大多采取手術治療,而過去的開腹手術造成的創傷比較大,術后患者的恢復較慢,同時術后的迷走神經興奮以及疼痛感造成患者的氧化應激顯著升高,對于患者的預后具有負面影響。目前臨床的研究認為[3],在保證手術的安全性以及有效性的基礎上,最大程度減少手術所產生的創傷是當前臨床研究的熱點。隨著不斷發展的腹腔鏡技術,微創手術逐步在直腸癌患者的手術治療中得到了廣泛的應用。但是近年來,在對直腸癌患者的手術治療中,在局部病灶部位進行戳孔,經原有手術路徑對其腫瘤組織進行取出,是否會增加直腸癌的復發以及轉移風險[4],治療的有效性以及安全性受到了質疑[5]。所以在臨床對直腸癌患者的腹腔鏡手術治療中,需要對患者的腹腔鏡手術的入路、手術措施以及患者術后的應激反應等各項措施進行優化,降低手術對患者造成的刺激,在不影響治療效果以及淋巴結清掃的前提下,通過各項措施的優化,改善預后。本研究主要通過對直腸癌患者手術治療方案的優化及對患者術后恢復、胃腸激素、機體體液和細胞免疫的影響差異分析,以期為臨床治療提供參考。
1 資料與方法
1.1 基本資料
選取2020年1月至2022年1月住院并治療的直腸癌患者86例作為研究對象,其中男性患者46例、女性40例,體重指數平均為(24.56±2.66)kg/cm2,年齡55~65歲,平均年齡為(60.40±2.09)歲,臨床TNM分期:T1~T2期33例、T3~T4期53例,臨床Duke分期:A期11例、B期32例、C期38例、D期5例,臨床分型:隆起型13例、潰瘍型60例以及浸潤型13例。隨機將86例患者分為2組,其中觀察組41例實施腹腔鏡經自然腔道取標本手術,對照組45例實施常規腹腔鏡手術,2組患者的一般資料可比(P>0.05),詳見表1。全部的患者均簽署相關的知情同意書,并經倫理委員會論證通過。

表1 2組患者的一般資料對比
患者入選的標準:①全部符合直腸癌相關的診斷標準[6],術前采取腸鏡檢查以及病理學檢查進行確認;②未發現遠處播散;③患者的ASA評級為1~2級,所有患者均知情同意;④環周直徑<3 cm;⑤所有患者均需要進行化療治療;⑥所有患者的腫瘤位置均為腫瘤的位置距離下緣3~10 cm。排除標準:①入組前進行果放療或化療;②有腹部手術史;③術中發現粘連或者遠處播散;④患者自身免疫疾病;⑤患者其他惡性腫瘤;⑥入院前3天出現感染患者。
1.2 方法
全部的患者均實施腹腔鏡手術治療,觀察組的患者則實施經自然腔道取標本手術(NOSES)治療。
腔鏡手術:在對患者進行取氣管插管聯合靜脈復合全身麻醉后,采取截石位,建立氣腹后,分別在患者的臍下以及下腹部位進行鉆孔,分別在腹腔鏡以及超聲刀進行置入后,在距離腫瘤上15 cm位置,利用超聲刀切斷腸系膜和乙狀結腸系膜的血管之后,采用超聲刀進一步解剖清掃盆腔區域,分別對兩側的后腹膜進行切開后,充分暴露兩側的輸尿管,同時在患者的主動脈方向進行向下側進行分離,最遠端可以到達患者的肛門尾部的韌帶上方,根據腫瘤的部位,如果腫瘤的位置距離下緣5~10 cm,則對患者的采取全直腸系膜切除手術,在肛提肌的上緣則可以保留3~5 cm的腸道。同時將腫瘤組織在會陰部位進行取出后,及時對病灶部位的淋巴結進行清掃。
經自然腔道取標本手術:在以上腹腔鏡手術中,在對病灶部位的腫瘤進行切除后,針對高位直腸癌患者病灶部位的標本經肛門進行取出,同時經肛門置入吻合器,與近端的腸道進行吻合。
手術后,針對患者的術后病理情況,對TNM分期為T3~T4患者均采取XELOX方案化療:奧沙利鉑于化療第1天使用,使用劑量為85 mg/m2,靜脈滴注3 h。卡培他濱每日2500 mg/m2,連用2周,間隔1周,繼續治療,每日總劑量分早晚兩次于飯后半小時用水吞服。21天為1個周期,化療3個周期。
1.3 觀察指標
1.3.1 胃腸相關功能恢復情況 分別對比2組患者手術結束后的排氣所需要的時間、腸鳴音恢復的具體時間及開始進食所需要的時間。
1.3.2 圍術期相關指標 分別對比2組患者術中出血量、手術時長、切除病灶的長度及總的清掃淋巴結量。
1.3.3 免疫相關指標 分別采集2組患者4 ml空腹靜脈血,3600 r速度,15 min時長離心,取上清液,采用德國西門子全自動生化分析儀(型號為RLMax型)測定受試者的血清的補體及IgM、IgA、IgG濃度水平,試劑購自南京基蛋生物科技有限公司。
1.3.4 胃腸激素水平 分別對比2組患者術前以及術后的胃動力素以及胃泌素的水平。
1.3.5 術后相關并發癥 分別對比2組患者術后發生切口感染、腸梗阻以及腹腔粘連等總的并發癥發生概率情況。
1.3.6 術后指標 分別對2組患者的術后下床時間以及止痛藥物使用次數進行比較。術后止痛藥物主要是指術后72小時內使用靜脈鎮痛泵(芬太尼10~12 μg/kg/day)次數。
1.4 統計學方法
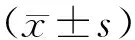
2 結果
2.1 2組患者的胃腸功能恢復情況比較
觀察組患者的腸鳴音具體的恢復時間、排氣所需要的時間以及開始進食所需的時間均較對照組更短,差異明顯(P<0.05),詳見表2。
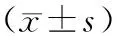
表2 2組患者的胃腸功能恢復情況比較
2.2 2組患者的圍手術期指標比較
2組患者的切除病灶長度、手術時間、術中出血量和總的淋巴結清掃量間的對比并無差異(P>0.05),見表3。
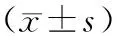
表3 2組患者的圍手術期指標比較
2.3 2組患者的免疫功能比較
2組患者治療結束后補體C3、補體C4、IgA、IgG、IgM均顯著升高,且觀察組患者的補體C3、補體C4、IgA、IgG、IgM顯著高于對照組,差異明顯(P<0.05),詳見表4。

表4 2組患者的免疫功能比較
2.4 2組患者的術后指標比較
觀察組患者的術后首次下床時間以及術后止痛藥物使用次數低于對照組,差異存在統計學意義(P<0.05),詳見表5。
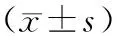
表5 2組患者的術后指標比較
2.5 2組患者的胃腸激素水平比較
2組患者的胃動力素以及胃泌素均發生顯著改變,且觀察組患者的胃動力素較對照組患者更高,而胃泌素較對照組更低,差異明顯(P<0.05),詳見表6。
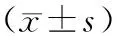
表6 2組患者的胃腸激素水平比較
2.6 2組患者總的并發癥發生率比較
觀察組患者出現腸梗阻、切口感染等總的并發癥發生率為7.32%(3/41),較對照組的24.44%(11/45)更低(χ2=4.61,P=0.03),見表7。

表7 2組患者總的并發癥發生率比較(例,%)
3 討論
在對直腸癌患者的手術中,通過對其采取腹腔鏡進行治療,較小的切口建立人工氣腹后,在一定程度上提升了手術的視野,降低由于手術創傷造成的術后感染和相關的應激反應,對于患者的預后方面意義很大[7]。同時在實際臨床對患者的治療期間,通過腹腔鏡高倍視野的仔細觀察,有效對局部區域的病灶組織和血管實施分離后并結扎,更好地減少了術后患者的出血量。既往的研究已經證實,相比傳統的腹腔鏡手術而言[8],經肛門腹腔鏡進行手術治療,患者的術后出血量較低,預后較好,同時機體的恢復能力得到有效提升[9]。但是在對患者腹腔鏡治療期間,需要對患者腹腔實施手術,腫瘤的組織以及手術中的吻合器需要通過正常的創口進行置入,在此過程中,腫瘤的組織和吻合器很容易對局部的病灶區域產生炎性反應和氧化應激反應,對于患者的預后具有負面影響。所以在對患者的腹腔鏡手術中,急需要對腹腔鏡手術進行優化改良。
在本研究中,通過對患者的圍手術期指標的分析,腹腔鏡手術患者的術后出血顯著降低,并不是由于腹腔鏡手術造成的視野的縮小對機體的病灶部位的清除以及淋巴結的清掃產生不利的影響[10]。相反,在對患者腹腔鏡手術中,切除手術部位的長度以及淋巴結的清掃數量之間的差異不存在統計學意義[11],提示在腹腔鏡手術中,由于手術過程中的氣腹作用,操作者的手術視野得到進一步提升,因此可以顯著提升患者的治療效果[12]。同時在對患者采取腹腔鏡切口腫瘤組織的取出的過程中,由于患者局部病灶的應激反應較高,其血液循環能力以及腸道蠕動能力發生顯著改變,也是造成患者腸道激素水平改變的重要原因[13]。而在本研究中,通過對患者的胃動力素以及胃泌素水平的比較,觀察組患者的胃動力素以及胃泌素水平得到顯著的改善,劉洋等[14]通過對直腸癌患者采取腹腔鏡手術治療中,與常規的腹腔鏡手術而言,其腸道應激反應以及胃腸激素分泌紊亂情況得到顯著改善,與本研究結果一致。而在對術后腸鳴音具體的恢復時間、排氣所需要的時間以及開始進食所需的時間等情況的分析中,觀察組患者的以上指標顯著優于對照組,分析認為,在腹腔鏡手術切除后,采用自然腔道取出腫瘤組織,對于腹腔內其他受擾動組織的刺激性作用較小,術后臨床恢復較快。同時在對患者的術后感染等并發癥總的發生率分析中,由于觀察組患者采取自然腔道取出病理組織,降低病理組織在取出時對正常組織的侵擾,對于降低患者術后并發癥的概率方面具有積極的作用。而在分析其免疫相關功能的影響中,由于腹腔鏡自然腔道取出手術對于機體的刺激性小,同時在對患者的腹腔鏡手術過程中,還可以通過對機體的腹腔鏡的放大作用[15],對于局部病灶部位的解剖位置具有顯著的視野,對直腸的腸系膜的牽拉以及游離提供較好的空間,對于淋巴結的清除具有積極的意義。而在此過程中,由于手術對于周邊組織損傷較小,所以不會影響胃腸道管壁上內分泌細胞的分泌功能[16],同時局部組織的血流以及細胞之間的彌散作用增強[17],進一步調節患者的胃腸運動功能[18]。所以通過對兩組患者的免疫功能的分析,觀察組患者的體液免疫以及細胞免疫功能顯著優于對照組。采用自然腔道進行腫瘤組織以及手術器械的取出,可有效降低術中腫瘤組織對局部組織的浸潤以及刺激性作用,同時提升患者的免疫細胞水平,對患者的預后意義重大。
但是本研究存在某些局限性,由于納入的樣本量存在限制,在臨床的推廣方面還需要日后擴大樣本給予相應的驗證。
綜上所述,對直腸癌患者采取腹腔鏡手術,并在此手術中以自然腔道進行組織取出優化,可促進患者的術后恢復,顯著改善胃腸激素、機體體液和細胞免疫功能。

