白細胞介素-35對肝細胞癌患者CD4+CD25+CD127dim/-調節性T細胞的調控作用
李 彧 李連香 奚逢瑜 薛敬東 葉苗青 楊躍青 黨 珊 張 鴻 段降龍 高 瑛
近5年我國肝細胞癌(hepatocellular carcinoma,HCC)發生例數占全球42.5%,根據2020年報道,我國HCC發病率居所有惡性腫瘤第5位,死亡率居第2位[1]。以抗程序性死亡受體-1(programmed death-1,PD-1)抗體及抗PD-L1抗體為代表的免疫檢查點分子抑制劑的發現為HCC治療提供了新的思路[2],進一步說明免疫因素在HCC發生發展中的發揮重要作用。以細胞因子和免疫細胞構成的復雜免疫網絡參與了HCC發病,白細胞介素-35(interleukin-35,IL-35)是一種新發現的細胞因子,屬于IL-12細胞因子家族成員,是由EB病毒誘導基因3(Epstein-Barr virus-induced gene 3,EBI3)和IL-12p35構成的異源二聚體,主要由調節性T細胞(regulatory T cells,Treg)分泌,并可正反饋促進Treg功能,在肝臟疾病中發揮重要的免疫調控作用[3]。但IL-35對HCC患者Treg的調控作用尚未見相關報道。因此,本研究擬以HCC患者為研究對象,觀察HCC患者IL-35的表達和Treg的比例,利用體外細胞培養體系,觀察外源性IL-35對HCC患者Treg活性的調控效應。
1 材料與方法
1.1 研究對象
入組2018年12月至2019年6月在陜西省人民醫院和陜西省中醫醫院就診的HCC患者。入組標準:①年齡18~65歲;②取得知情同意;③診斷符合《原發性肝癌診療規范(2019年版)》[4]的標準;④未接受過手術、化療、放療、介入、靶向或免疫治療。排除標準:①合并其他惡性腫瘤;②合并心臟、肝臟、腎臟等重要器官系統功能衰竭或嚴重感染;③合并自身免疫性疾病;④妊娠及哺乳期婦女。入組同時期年齡和性別匹配的健康志愿者作為正常對照(normal control,NC)。本研究方案已通過陜西省人民醫院和陜西省中醫醫院倫理委員會審批,所有志愿者均簽署知情同意書。
1.2 研究方法
1.2.1 血漿和外周血單個核細胞(peripheral blood mononuclear cells,PBMC)分離 采集EDTA抗凝外周血20 ml,1000 r/min離心10 min后采集上層血漿凍存于-80 ℃備用。下層血細胞使用人淋巴細胞分離液(北京索萊寶科技有限公司)、采用密度梯度離心法分離PBMC,凍存于液氮中備用。
1.2.2 CD4+CD25+CD127dim/-Treg純化 使用人CD4+CD25+CD127dim/-調節性T細胞純化試劑盒II(德國美天旎公司)純化Treg。取107個PBMC,加入10 μl CD4+CD25+CD127dim/-T細胞生物素抗體雞尾酒(包含生物素標記的抗人CD8、抗人CD19、抗人CD123和抗人CD127),混勻、孵育、洗滌后加入LD分離柱,收集穿過分離柱的未標記細胞即為CD4+CD127dim/-細胞。純化的CD4+CD127dim/-細胞加入10 μl CD25 Microbeads,混勻、孵育、洗滌后加入LD分離柱,收集未穿過分離柱的標記細胞即為CD4+CD25+CD127dim/-Treg。
1.2.3 細胞刺激培養 所有HCC患者的PBMC(105個)加入重組人IL-35(美國Peprotech公司;終濃度1 ng/ml)[5-6]刺激培養24 h后收集細胞和培養上清。隨機選擇19例HCC患者純化的CD4+CD25+CD127dim/-Treg加入重組人IL-35(終濃度1 ng/ml)刺激培養24 h,洗滌2次去除外源性IL-35,然后取104個刺激后的CD4+CD25+CD127dim/-Treg,與105個自體PBMC共培養系統,48 h后收集細胞和培養上清。
1.2.4 流式細胞術檢測CD4+CD25+CD127dim/-Treg比例 將PBMC轉入FACS管中,PBS洗滌2次,加入抗人CD3-PerCP、抗人CD4-FITC、抗人CD25-APC、抗人CD127-PE(均購自美國BD公司),于4 ℃避光孵育30 min,使用FACS Calibur流式細胞儀進行檢測。
1.2.5 實時熒光定量PCR法檢測EBI3、IL-12p35、PD-1、T細胞免疫球蛋白和黏蛋白結構域蛋白-3(T cell immunoglobulin and mucin domain-containing protein 3,TIM-3)、淋巴細胞活化基因3(lymphocyte-activation gene-3,LAG-3)mRNA相對表達量 提取細胞總RNA,將1 μg總RNA反轉錄為cDNA。使用PrimeScript RT Reagent Kit(Perfect Real Time)(寶日醫生物技術有限公司)進行反轉錄,反轉錄反應體系:5×PrimeScript Buffer (for Real Time) 2 μl、PrimeScript RT Enzyme Mix I 0.5 μl、Oligo dT Primer (50 μM) 0.5 μl、Random 6 mers (50 μM) 0.5 μl、總RNA 1 μg,加入RNase Free水調整總體積至10 μl。反轉錄條件:37 ℃ 15 min、85 ℃ 5 s。使用TB Green Premix實時定量PCR試劑盒(寶日醫生物技術有限公司)進行實時定量PCR,實時熒光定量PCR體系:TB Green Premix Ex Taq II (Tli RNaseH Plus) (2×) 10 μl、PCR上游引物 (10 μM) 0.8 μl、PCR下游引物 (10 μM) 0.8 μl、ROX Reference Dye (50×) 0.4 μl、RT反應液 2 μl,滅菌水 6 μl。實時定量PCR反應條件:預變性:95 ℃ 30 s 1個循環,PCR反應 95 ℃ 5 s、60 ℃ 30 s 40個循環。PCR引物參考既往發表文獻[7,8]合成。
1.2.6 酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)法檢測血漿IL-35水平和培養上清中干擾素-γ(interferon-γ,IFN-γ)、IL-10、IL-35水平 使用武漢華美生物公司商品化ELISA試劑盒進行檢測,操作按說明書進行。將100 μl樣品和標準品加入包被的ELISA平板中,室溫孵育90 min后,棄液體甩干后加入100 μl生物素標記的抗體工作液,室溫孵育60 min,洗板后加入100 μl辣根過氧化物酶結合工作液,室溫孵育30 min,洗板后加入TMB底物溶液90 μl,室溫孵育15 min后加入終止液50 μl。450 nm波長處讀取吸光度,通過繪制標準曲線計算樣本中細胞因子水平。
1.2.7 細胞計數試劑盒-8(Cell Counting Kit-8,CCK-8)法檢測細胞增殖 使用CCK-8試劑盒(武漢碧云天公司)進行細胞增殖檢測,在培養的最后的4 h向培養液中加入10% CCK-8溶液,培養結束后在450 nm波長處讀取吸光度,通過已知細胞數量的吸光度值繪制標準曲線,計算樣本中的細胞數量。
1.3 統計學處理
應用SPSS 23.0軟件進行數據統計分析。首先對計量資料進行正態性檢驗,所有計量資料均符合正態分布,采用均數±標準差表示,計量資料的組間比較采用t檢驗或配對t檢驗,相關性分析采用Pearson相關性分析,計數資料的組間比較采用卡方檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 HCC患者和NC的一般資料比較
本研究共入組51例HCC患者和25例NC,一般資料見表1。

表1 HCC患者和NC一般資料比較
2.2 CD4+CD25+CD127dim/-Treg比例和IL-35在HCC患者中的變化
通過前向角光散射(forward scatter,FSC)和側向角光散射(side scatter,SSC)去除碎片和死亡細胞,在以CD3+CD4+T細胞門內,檢測CD25+CD127dim/-細胞(圖1)。HCC組CD4+CD25+CD127dim/-Treg比例顯著高于NC組。HCC組血漿IL-35水平顯著高于NC組。HCC組PBMC中EBI3和IL-12p35 mRNA相對表達量均顯著高于NC組,見表2。HCC組中CD4+CD25+CD127dim/-Treg比例與血漿IL-35水平呈顯著正相關(γ=0.400,P=0.0036,圖2)。

圖1 HCC組和NC組PBMC中CD4+CD25+CD127dim/-Treg典型流式檢測散點圖

圖2 HCC組CD4+CD25+CD127dim/-Treg比例與血漿IL-35水平相關性分析
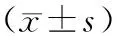
表2 HCC組和對照組血漿IL-35和PBMC中EBI3、IL-12p35 mRNA相對表達量比較
2.3 IL-35對HCC患者CD4+CD25+CD127dim/-Treg比例和EBI3、IL-12p35 mRNA相對表達量的影響
51例HCC患者分離的PBMC使用重組人IL-35刺激培養24 h后,CD4+CD25+CD127dim/-Treg比例較無IL-35刺激時升高。PBMC中EBI3和IL-12p35 mRNA相對表達量經IL-35刺激后較無IL-35刺激顯著升高,見表3。
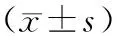
表3 IL-35對HCC患者PBMC中CD4+CD25+CD127dim/-Treg比例和EBI3、IL-12p35 mRNA相對表達量的影響
2.4 IL-35對HCC患者CD4+CD25+CD127dim/-Treg中免疫檢查點受體、誘導細胞增殖和細胞因子分泌的影響
19例HCC患者純化的CD4+CD25+CD127dim/-Treg經IL-35刺激后,免疫檢查點受體PD-1、TIM-3和LAG-3 mRNA水平均升高,其抑制自體PBMC增殖的能力增強,共培養系統中細胞數量減少。在共培養上清中,IFN-γ分泌水平在經IL-35刺激的Treg中顯著降低,而IL-10和IL-35分泌水平在經IL-35刺激的Treg中顯著升高,見表4。
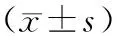
表4 IL-35對HCC患者CD4+CD25+CD127dim/-Treg免疫檢查點受體、誘導細胞增殖和細胞因子分泌的影響
3 討論
IL-35在腫瘤疾病過程中主要發揮抑制抗腫瘤免疫應答的作用。抑制小鼠腫瘤微環境中IL-35表達可增強T細胞增殖、增加T細胞效應功能和抗原提呈活性、抑制免疫檢查點受體(包括:PD-1、TIM-3和LAG-3),降低T細胞功能衰竭[9]。但IL-35的表達變化在不同腫瘤中卻存在差異。IL-35在乳腺癌[10]、前列腺癌[11]、急性髓系白血病[12]、結直腸癌[13]患者外周血中的水平升高,但是,在非小細胞肺癌患者外周血IL-35水平與健康對照者比較無明顯變化,僅在腫瘤微環境中的浸潤水平較未發生腫瘤的肺部顯著升高[14]。本研究所發現的HCC患者血漿IL-35水平升高的結果與既往報道一致[6,15]。同時,本研究從轉錄水平證實HCC患者PBMC中IL-35組成亞基EBI3和IL-12p35 mRNA相對表達量均顯著升高,與血漿蛋白表達水平一致。由于Treg是IL-35的主要來源,本研究進一步對CD4+CD25+CD127dim/-Treg在HCC患者的水平進行了分析,與既往的研究結果一致[16],HCC患者外周血Treg比例較對照者顯著升高。更為重要的是,HCC患者血漿IL-35水平與CD4+CD25+CD127dim/-Treg比例呈顯著正相關,進一步說明CD4+CD25+CD127dim/-Treg是HCC患者IL-35的主要來源之一,參與HCC的發病過程。
IL-35在肝臟疾病過程中發揮重要的免疫調控作用。在慢性乙型肝炎和慢性丙型肝炎感染過程中,IL-35在增強調節性Treg免疫抑制活性的同時可抑制效應性Th17細胞功能,也可抑制CD8+T細胞毒性作用,從而抑制病毒性肝炎誘導的肝臟炎癥應答,發揮免疫抑制功能[5,17-18]。在慢加急性肝衰竭和HCC疾病過程中,IL-35主要促進免疫檢查點分子的表達,降低細胞毒性分子表達,從而抑制CD8+T細胞的抗腫瘤效應[6,19]。但有關IL-35對HCC患者Treg功能調控的研究罕見報道。在呼吸機相關肺炎中的研究發現,外源性IL-35對刺激患者支氣管肺泡灌洗液純化的Treg可增強其免疫抑制活性,主要表現為細胞增殖減弱、抑制性細胞因子分泌增強、促炎因子分泌較少[20]。本研究亦發現,外源性IL-35可促進HCC患者PBMC中CD4+CD25+CD127dim/-Treg的比例,也可增加IL-35亞基EBI3和IL-12p35 mRNA水平,提示IL-35可增強Treg比例和IL-35表達,對Treg發揮正反饋作用,這與在結腸癌中的發現一致[21]。更為重要的是,外源性IL-35也可調控HCC患者Treg的免疫抑制功能,IL-35可促進HCC患者Treg中免疫檢查點受體的表達[22],抑制PBMC增殖以及分泌抑制性細胞因子的能力均增強,IFN-γ分泌水平降低,以上結果均提示IL-35可通過增強Treg的免疫抑制活性參與HCC免疫發病,促進HCC疾病進展。
綜上所述,HCC患者外周血中存在升高表達的IL-35和CD4+CD25+CD127dim/-Treg,Treg作為IL-35的主要來源,在HCC疾病過程中可能發揮正反饋作用,促進Treg的增殖和活性,進一步誘導HCC疾病中的免疫耐受,促進HCC疾病進展。

