多模態MRI在乳腺非腫塊性病變中的診斷價值
王寶鋒 馬彥高 李 義 曾憲強 王榮勤 杜新峰
美國放射學會組織依據動態增強掃描,根據異常乳腺強化病灶的形態學特征,將其分為點狀、腫塊以及非腫塊樣強化(NMLE)[1]。NMLE不具有腫塊特征,無明確占位效應,病灶內夾雜正常乳腺腺體、脂肪或間質成分,從而呈現不連續強化,因而缺乏典型的影像表現[2-3]。MRI可進行多參數、多方位成像分析,且無輻射作用,安全性較高,在臨床診斷中具有重要作用[4-5]。因此本研究對131例NMLE患者進行多模態MRI診斷,分析其應用價值,為臨床提供參考。
1 資料與方法
1.1 一般資料
選取2019年1月至2020年12月在本院接受治療的71例惡性NMLE患者,計為惡性組;另選同時期60例良性NMLE患者作為對照,計為良性組。惡性組:年齡30~50(40.64±7.81)歲;病程1.0~5.0(3.25±1.00)年;體重指數19.0~24.0(20.97±1.80)kg/m2。良性組:年齡31~49(41.00±7.90)歲;病程1.0~5.0(3.31±1.10)年;體重指數19.0~23.9(20.85±1.71)kg/m2。上述兩組患者的年齡、病程、體重指數均無統計學差異(P>0.05),本研究經倫理委員會允許。
納入標準:確診為NMLE,在病灶內夾雜有正常腺體以及脂肪組織;為女性患者;患者在研究前,并未接受過NMLE相關治療,且并無乳腺手術史;患者自愿參與此次研究,并簽署知情同意書。
排除標準:患者具有占位效應病灶;患者有乳腺穿刺活檢史或有乳腺癌手術治療史。
1.2 MRI檢查方法
(1)常規掃描。采用西門子Verio3.0T磁共振對患者進行乳腺檢查。患者頭先進、取仰臥位,雙乳自然下垂、置于線圈中央。先對患者進行T2WI序列掃描,TR/TE=4000/70 ms、間距=0.5 mm、層厚=5.0 mm、FOV=340 mm×340 mm;再行T1WI序列,TR/TE=6/2.3 ms,間距、層厚分別為2 mm、1.2 mm,FOV=340 mm×340 mm、反轉角=10°;EPI-DWI序列掃描,TR/TE=8300/85 ms,間距、層厚分別為2 mm、4 mm、FOV=360 mm×147 mm,b值=50、800 s/mm2。
(2)定量動態增強掃描。先行T1WI-FS快速小角度回波掃描,TR/TE=3.41/0.9 ms、間距=0.54 mm、層厚=2.00 mm、FOV=340 mm×340 mm,翻轉角分別為5°、10°、15°,獲得三組不同翻轉角圖像。在保持相同的參數、翻轉角為15°的情況下,進行連續動態增強掃描;第1時相結束后,采用高壓注射泵,依次為患者注射對比劑扎噴酸葡胺0.2 mmol/kg以及20 mL生理鹽水,注射速度均為5.0 mL/s,共采集30期時相,單次時間為10 s。
1.3 圖像處理
由2名工作年限為10年的影像診斷醫師分別對MRI影像資料進行評估,診斷、記錄MRI征象 ,意見不同時,需重新進行評估、協商討論,直至診斷達到一致。
(1)NMLE分布方式:NMLE分布方式有6種,分別為局灶(單個、小,異常強化灶局限于1/4象限)、線樣(強化為線條狀,走形不同與導管)、區域(范圍較大的強化,與周圍組織界限不清晰)、多區域(多區域強化,其間為正常脂肪以及腺體組織)、小葉節段樣(以乳頭為尖端的圓錐形)以及彌漫分布(廣泛、彌散分布)。
(2)內部強化特征:一共4種,均勻(融合一致的強化)、簇樣環形(多個病灶圍成環形強化、不均勻區域)、簇集樣(鵝卵石柔和般腫塊)、混雜(正常組織隨機分隔)。
(3)測量表觀擴散系數(apparent diffusion coefficient,ADC)。對增強后第一期圖像進行矢狀位、冠狀位重建;后選定病灶強化實質20~50 mm2感興趣區域(region of interest,ROI),選擇時應盡量避開壞死、囊變區以及出血區域。繪制ADC圖,計算ADC值。
(4)體素內不相關運動擴散加權成像(intravoxel incoherent motionimaging-diffusion weighted imaging,IVIM-DWI)分析。將所有的圖片采入Omni-Kinetics軟件,計算容量轉移常數(Ktrans)=對比劑從血管滲入血管外細胞間質的運轉系數,血管外細胞外間隙容積比(Ve)=血管外容積/細胞外間隙容積,速率常數(Kep)=Ktrans/Ve。
(5)繪制時間-信號強度曲線(time-signal strength curve,TIC),并對其進行分型。Ⅰ型,整體持續強化為流入性,并無明確的峰值;Ⅱ型增強早期信號上升,后段維持在一個平臺水平,變化幅度不超過10%,為平臺型;Ⅲ型,早期迅速強化,中晚期變化超過10%,為流出型。
1.4 統計學方法
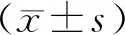
2 結果
2.1 良惡性NMLE患者MRI征象單因素分析
在NMLE 6種分布方式中,惡性患者中小葉節段樣患者多于良性患者(P<0.05),其余分布方式均無差異(P>0.05);惡性患者的內部強化特征主要為簇集樣強化,良性患者主要為混雜、簇集樣強化,兩組患者的均勻、簇集樣特征率差異具有統計學意義(P<0.05),其余無差異(P>0.05);良、惡性NMLE患者的TIC類型存在差異(P<0.05),同時Ⅲ型主要為惡性NMLE患者,見表1。

表1 良惡性NMLE患者MRI征象單因素分析
2.2 NMLE患者MRI征象相關性Logistic回歸分析
ADC值、Ktrans、Kep均是NMLE良惡性的獨立影響因素(P<0.05),小葉節段樣、均勻、簇集樣、TIC類型Ⅱ型均不能作為診斷NMLE良惡性的參考因素,構建NMLE病理診斷方程式:Log=-5.884-(0.712ADC值)+(1.023Kep)+(0.809Kep),見表2。

表2 MRI征象對NMLE良惡性相關性Logistic回歸分析
2.3 NMLE病理診斷模型對NMLE良惡性的診斷價值
Hosemer-Lemeshow檢驗χ2=0.016,P<0.0001;NMLE病理診斷模型診斷NMLE惡性的AUC為0.953,敏感度、特異度分別為90.14%、88.33%,cut-off為>5.544(約登指數=0.785、95%CI為0.921~0.984)。見圖1。

圖1 NMLE病理診斷模型對NMLE良惡性的診斷價值
3 討論
超聲可通過NMLE病灶內部回聲強度、血流信號、邊緣特征以及周圍組織浸潤情況來判斷病灶性質[6-7],病變區域表現為低回聲或中等回聲,對于強回聲微鈣化較為敏感;但超聲影像的灰階不夠顯著,微小鈣化是其診斷的薄弱領域[8]。與此同時超聲結果受操作技師、診斷醫師以及設備的影響,對于醫師的職業能力要求較高,診斷結果受人為因素較大[9-10]。此外,雖然X線也能顯示NMLE病灶的微鈣化、結構扭曲以及腺體密度異樣等征象,能夠彌補超聲灰階不顯著的缺點,但是對于致密型乳腺的顯像結果較差,易造成漏診,且有輻射。MRI具有較高的軟組織分辨率,且能夠顯示乳腺病灶區域微小病變,對于NMLE病變具有重要診斷價值[11-12]。
本研究結果顯示,NMLE惡性患者分布方式主要為小葉節段樣,且兩組間患者的小葉節段樣分布率存在差異。分析原因,這可能是因為區域型、彌漫型則多為乳腺腺病;而節段型多為浸潤性導管癌以及導管內原位癌。NMLE惡性患者的內部強化特征主要為簇集樣,這是因為正常乳腺腺體、脂肪組織在強化區域內為簇樣環形,簇樣環形通常為乳腺炎性等良性病變;而導管原位癌、浸潤性導管癌通常表現為簇集樣強化,病灶區域導管內伴有微小或無浸潤[13]。需要注意的是,少量良性NMLE患者也可能出現小葉節段樣分布以及簇集樣強化,所以在實際臨床診斷中,需要結合多種MRI參數進行綜合分析,以提高臨床診斷精確率。同時,DCE-MRI可以清晰顯示病灶的形態,顯示內部血供以及病理改變情況。本研究顯示兩組患者的TIC分型存在差異,良性、惡性患者均大多數為Ⅰ型、Ⅱ型,這是因為惡性NMLE多為導管原位癌,血供少,對比劑后期消散速度較慢,不會出現快速消散的情況;但同時研究結果也顯示,TIC分型為Ⅲ型時,患者為惡性的可能性更高。在MRI征象相關性Logistic回歸分析中,TICⅢ型并不是NMLE惡性診斷的危險因子。分析原因,可能是因為NMLE的內部正常腺體、脂肪成分較多,會造成部分容積效應,因此血流動力學特征的測定受到影響[14-15]。同時,惡性的NMLE常為導管原位癌,其內部血供較大后,鈣化多,而在其他類型的NMLE中也具有此特點,因此導管原位癌的TIC并不具有特異性,需要結合多種參數進行綜合分析。
研究表明,DWI可以實現無創反應組織水彌散狀態,其統計值ADC對于乳腺病變的診斷具有重要價值[15]。本研究結果顯示NMLE惡性患者的ADC值低于良性患者,且其差異具有統計學意義,這可能是因為惡性病灶內腫瘤細胞的繁殖頻繁、細胞核大,細胞間質少,組織水分子擴散運動收到一致,因此呈現高信號、低ADC值。劉靚等[16]的研究中表示,ADC值可輔助診斷乳腺癌良惡性,當ADC值≤1.3×10-3mm2/s時患者為惡性腫瘤。然而ADC值也存在一定的缺陷,因為人體內中處理水分子的擴散運動,還有毛細血管微循環灌注的“擴散假象”,對于疾病的診斷具有一定干擾作用,而基于毛細血管微循環灌注的IVIM可以有效避免這一缺點。本研究結果顯示,惡性患者的Ktrans、Kep高于良性患者,這是因為惡性患者病灶組織血管豐富、內皮細胞不完整,其血管通透性更高,對比劑的滲透速度因此加快,所以惡性患者對比劑從血管內向血管外擴散的速度以及運轉系數更大,Ktrans、Kep可作為診斷NMLE良惡性的重要參考因素。此外,本研究ROC分析也顯示,Hosemer-Lemeshow檢驗顯示NMLE病理診斷模型對NMLE惡性的AUC高達0.953。李晏等[17]的研究中也表示,DCE-MRI定量參數Ktrans、Kep在NMLE無創性良惡性鑒別中具有重要參考價值,本研究結果與其一致。
綜上所述,多模態MRI對NMLE良惡性甄別具有重要的臨床價值。雖然MRI征象以及TIC分型在NMLE惡性診斷中的價值有限,但Ktrans、Kep對NMLE良惡性較為敏感,多模態MRI在NMLE良惡性的甄別中具有很好的前景,可使患者得到及時、正確治療,改善患者預后。

