肺癌患者胸腔鏡術后胸腔積液發生的列線圖預測模型構建
丁理星 夏 俊 魏文學
作為治療肺癌患者較為常用的手段,電視胸腔鏡手術(video-assisted thoracic surgery,VATS)具有切口小、術后疼痛輕、對肺功能影響小等優勢,且對患者免疫功能影響較小,患者術后康復較快,已在臨床上得到廣泛應用[1]。但研究顯示,VATS術后仍有較高的并發癥發生風險[2-3]。由此可見,探尋VATS術后胸腔積液發生的相關因素對肺癌患者康復尤為重要。目前,已有研究證實機器人輔助肺段切除術后發生胸腔積液與患者原發疾病、肺部感染等因素有關[4]。鑒于此,本研究嘗試構建肺癌患者VATS術后發生胸腔積液風險預測模型,現報告如下。
1 資料與方法
1.1 一般資料
本研究經醫院倫理委員會批準,選取2017年4月至2021年4月收治的532例肺癌患者作為研究對象,全部患者及家屬均知情本項研究,且自愿簽署知情同意書。532例患者中男性403例,女性129例;年齡≥60歲172例,<60歲360例;病理類型:鱗癌184例,腺癌305例,大細胞癌43例;TNM分期[5]:Ⅰ期209例,Ⅱ期323例。
1.2 入選標準
納入標準:①肺癌符合《中華醫學會肺癌臨床診療指南(2018版)》[6]中相關標準;②接受VATS治療;③TNM分期為Ⅰ~Ⅱ期。排除標準:①合并其他惡性腫瘤疾病,如胃癌、肝癌等;②肺癌術后復發并進行二次手術治療者;③胸膜肥厚嚴重粘連,胸腔鏡無法進入者;④嚴重心肺功能障礙,無法耐受手術者;⑤合并凝血功能障礙;⑥嚴重傳染性疾病,如病毒性肝炎;⑦腫瘤直徑>5 cm的T2期肺癌者。
1.3 方法
1.3.1 基線資料收集方法 設計基線資料調查表,詢問并記錄全部患者基線資料,內容包括年齡(≥60歲、<60歲)、性別(男、女)、病理類型(腺癌、鱗癌、大細胞癌)、TNM分期(Ⅰ期、Ⅱ期)、合并癥[高血壓(符合《中國高血壓防治指南(2018年修訂版)》[7]中相關標準)、糖尿病(符合《糖尿病防治指南》[8]中相關標準)]、手術方法(肺葉切除術、病變楔形切除)、吸煙史[吸煙指數(每日吸煙支數×年數)≥0.5]、飲酒史(男性飲酒量≥40 g/日,女性飲酒量≥20 g/日,且持續飲酒時間>5年)、降鈣素原(procalcitonin,PCT)(于入院時取全部患者空腹靜脈血5 mL,以3000 r/min離心10 min,離心半徑為10 cm,處理10 min后,分離血清,分置2管,取1管采用免疫化學發光法檢測血清PCT水平。)、1 s用力呼氣容積(forced expiratory volume in one second,FEV1)占預計值百分比[使用肺功能測試系統(美國森迪斯,Vmax20型)檢測兩組FEV1水平]、低白蛋白血癥(另取1管采用溴甲酚綠法檢測血清白蛋白水平,其中血清白蛋白水平<35 g/L為低白蛋白血癥)。
1.3.2 胸腔積液評估及分組方法 經VATS治療后,患者出現胸悶氣喘、持續低熱癥狀,行胸腔穿刺,可抽出積液;或術后5~7 d,行常規超聲檢查,探查胸腔情況,可見胸腔內液性暗區最大深度>3 cm即可確診為術后并發胸腔積液。將術后發生胸腔積液的患者納入發生組;反之,則納入未發生組。
1.4 統計學方法
應用SPSS 24.0軟件進行數據處理,計數資料用百分比表示,采用χ2檢驗,若期望值<5,采用連續校正卡方檢驗;計量資料均經Shapiro-Wilk正態性檢驗,正態分布計量資料以 表示,組間用獨立樣本t檢驗,用Logistic回歸分析檢驗肺癌患者VATS后胸腔積液發生的影響因素;用R軟件的“rms”程序包繪制列線圖并構建肺癌患者VATS后發生胸腔積液的風險預測模型,并計算一致性指數(C-index)判斷模型區分度;用“caret”程序包,經Bootstrap法重復抽樣1000次驗證,繪制校準曲線檢驗模型預測結果與實際結果一致性,用“pROC”程序包繪制受試者工作曲線(ROC),并計算曲線下面積(AUC)值,檢驗胸腔積液發生風險預測模型的價值,AUC值>0.9表示預測性能較高,0.71~0.90表示有一定預測性能,0.5~0.7表示預測性能較低,<0.5表示無預測性能,P<0.05為差異具有統計學意義。
2 結果
2.1 胸腔積液發生情況
532例肺癌患者VATS后,有60例發生胸腔積液,占11.28%。
2.2 兩組基線資料對比
發生組年齡≥60歲、糖尿病、吸煙史、低白蛋白血癥、FEV1%≤60%占比高于未發生組,PCT水平高于未發生組,差異有統計學意義(P<0.05);組間其他基線資料對比差異無統計學意義(P>0.05)。見表1。
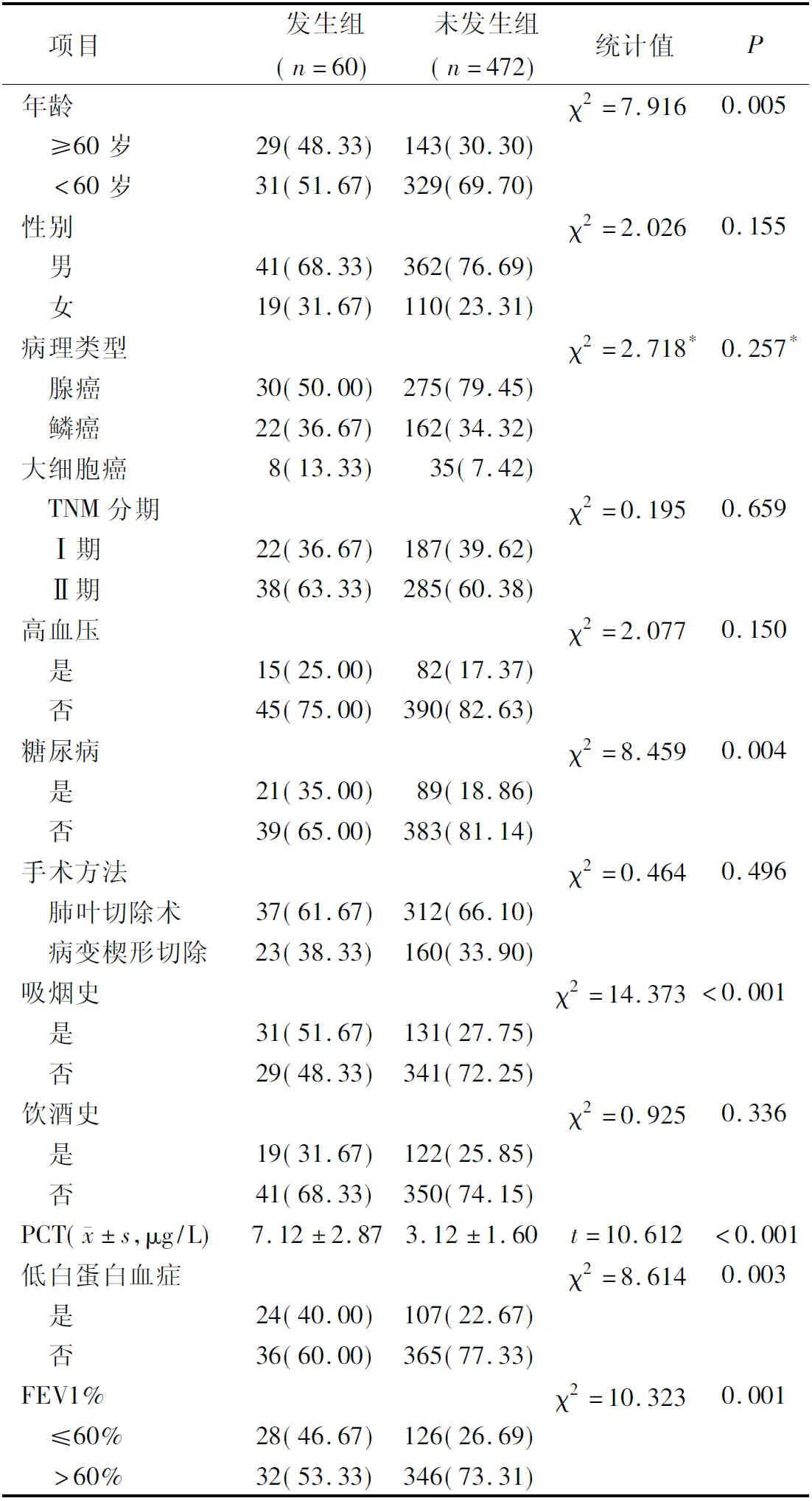
表1 兩組基線資料對比(例,%)
2.3 肺癌患者VATS術后發生胸腔積液風險的影響因素分析
將肺癌患者VATS術后胸腔積液發生情況作為因變量(1=發生,0=未發生),將2.2中對比差異有統計學意義的變量納入自變量,經Logistic回歸分析,P值放寬至<0.1,建立多元回歸模型,結果顯示,高齡、合并糖尿病、吸煙史、低白蛋白血癥、PCT水平高、FEV1%≤60%是肺癌患者VATS術后胸腔積液發生的風險因子(OR>1,P<0.05),見表2。
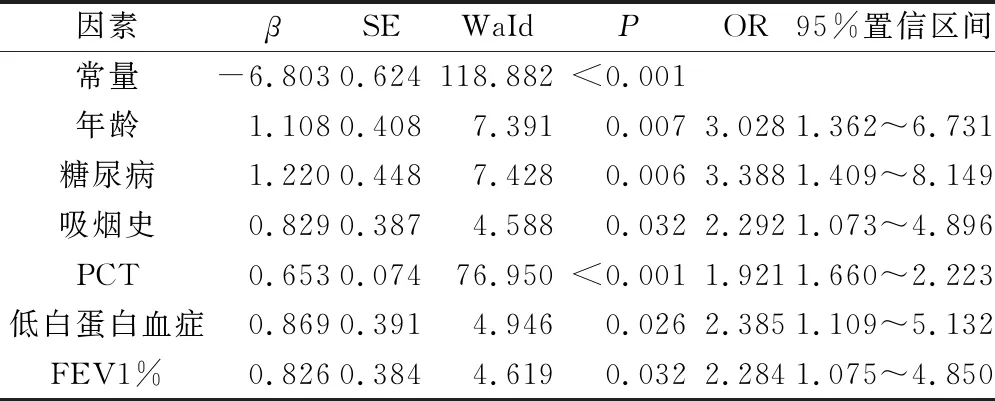
表2 肺癌患者VATS術后發生胸腔積液風險的影響因素分析
2.4 構建肺癌患者VATS術后發生胸腔積液的風險預測模型及模型驗證
繪制列線圖(圖1),將2.3證實為可能的影響因素(年齡、糖尿病、吸煙史、PCT、低白蛋白血癥、FEV1%)列入,構建術后發生胸腔積液風險預測模型,經Bootstrap法重復抽樣1000次驗證模型,結果顯示,C-index值為0.909,模型區分度良好;繪制校準曲線顯示(圖2),校準曲線Y與X直線相近,模型準確度良好。
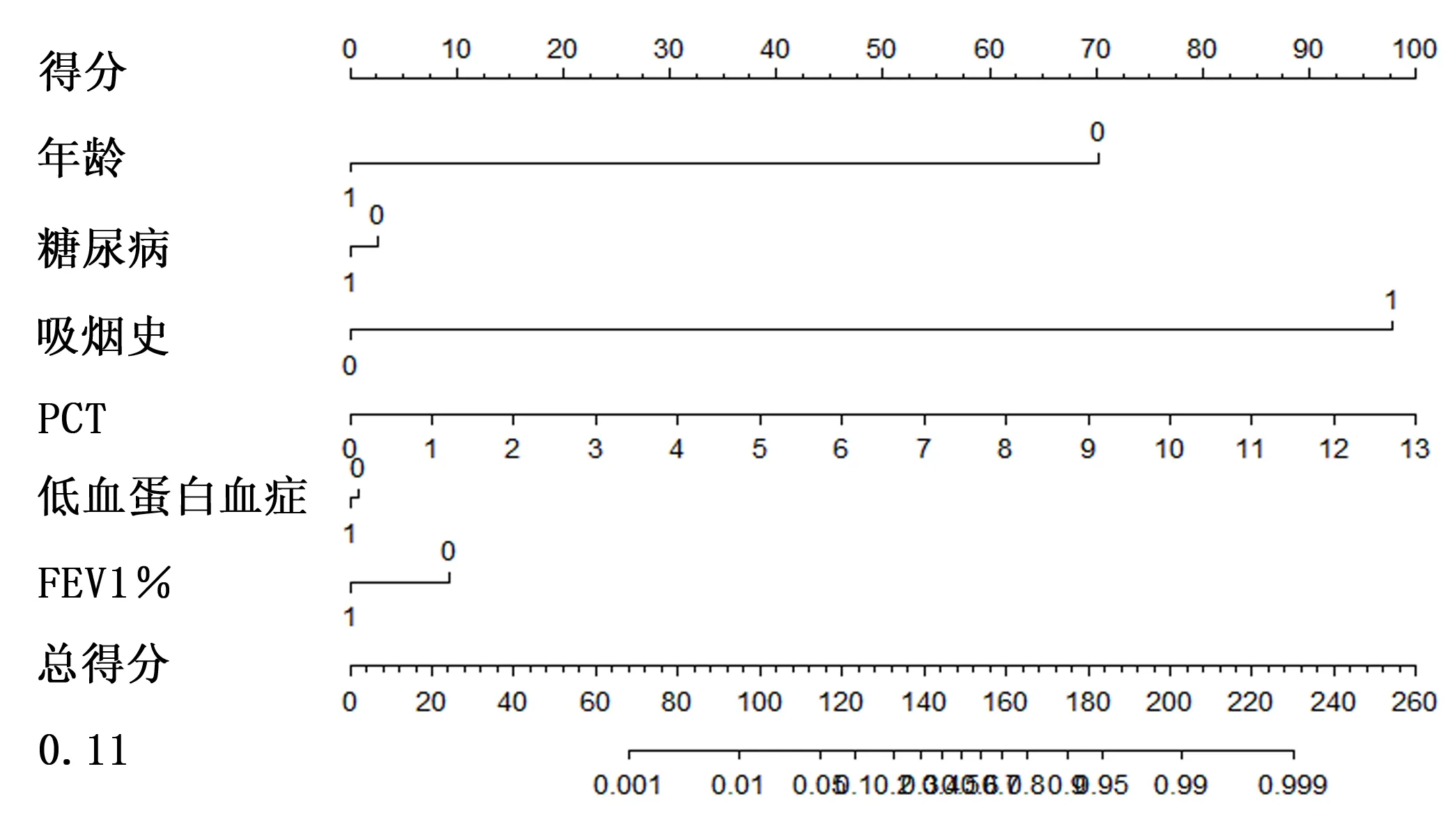
圖1 肺癌患者VATS術后發生胸腔積液的風險預測模型列線圖
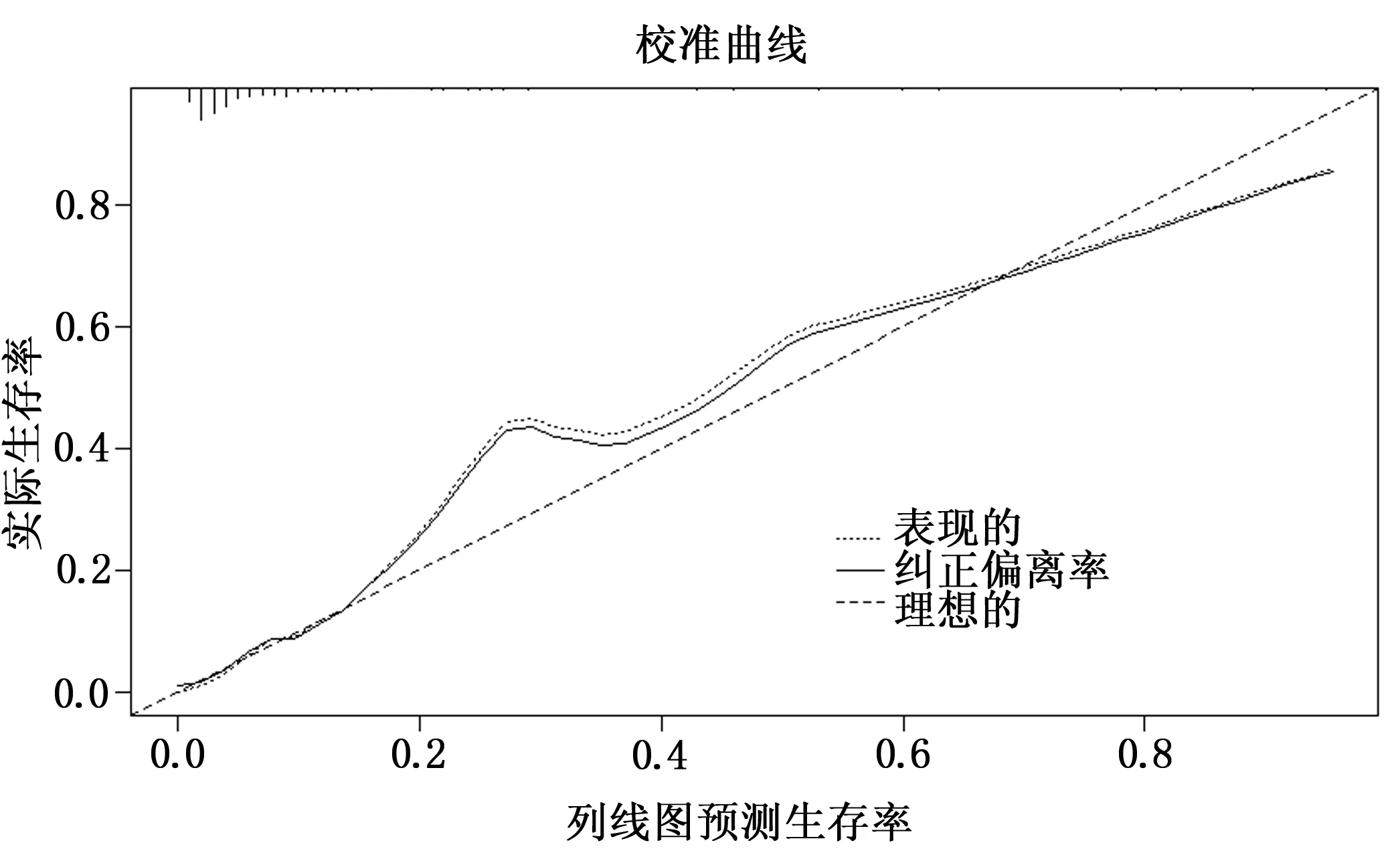
圖2 肺癌患者VATS術后發生胸腔積液的風險預測模型校準曲線
2.5 胸腔積液發生風險預測模型預測效能評價
繪制ROC曲線(圖3)發現,胸腔積液預測模型得到的預測值用于預測肺癌患者VATS術后胸腔積液發生風險的AUC為0.918,>0.90,有較好預測價值,cut-off值取4.742分時可獲得最佳預測效能,對應的AUC的95%置信區間、標準誤、P、特異度、敏感度、約登指數分別為0.881~0.955、0.019、<0.001、0.879、0.800、0.679。
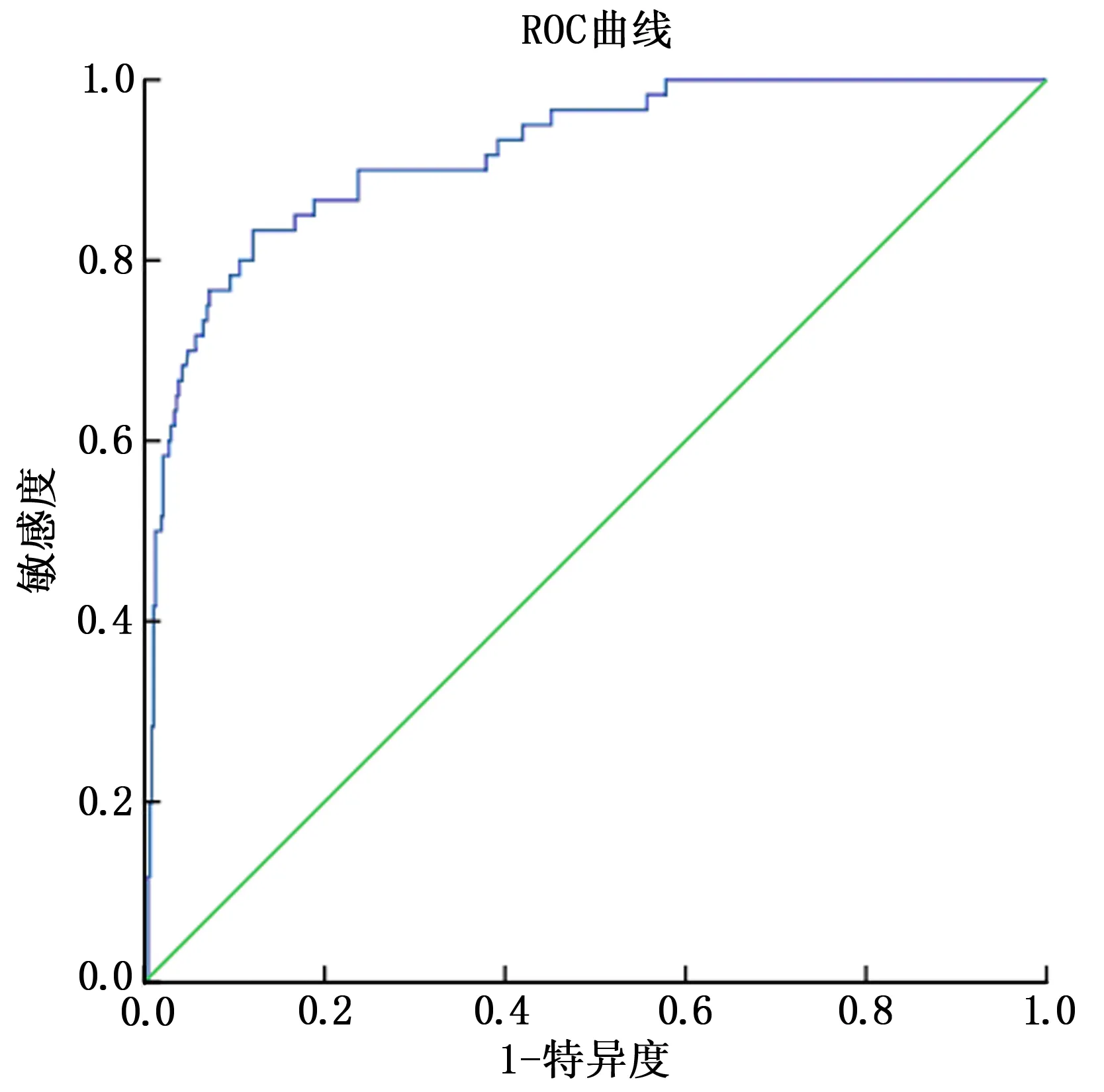
圖3 肺癌患者VATS術后發生胸腔積液的風險預測模型預測效能ROC曲線圖
3 討論
胸腔積液作為肺癌患者VATS術后較為常見的并發癥,可限制患者心肺活動,若不及時處理,可導致胸腔感染,必要時需采用胸腔積液穿刺術引出液體,增加患者痛苦,不利于術后康復[9]。因此,分析VATS術后發生胸腔積液的相關因素,并建立預測風險模型,對預防肺癌患者術后胸腔積液形成具有重要意義。
本研究經初步對比兩組基線資料后,經Logistic回歸分析,結果顯示,高齡、合并糖尿病、吸煙史、低白蛋白血癥、PCT水平高、FEV1%≤60%是肺癌患者VATS術后胸腔積液發生的風險因子。分析原因在于:年齡:隨著年齡增加,人體各系統、器官組織均會發生異常,功能明顯減弱,經手術治療后,患者肺部組織受損,增加感染風險,進而引發胸腔積液[10]。糖尿病:肺部微循環具有儲備功能,肺臟是糖尿病患者微循環疾病的靶器官,而糖尿病患者自我修復能力較差,術后發生肺部感染風險較高,可導致患者胸腔積液[11-12]。針對上述因素,建議臨床工作人員可于術前評估患者血糖水平,控制血糖,降低并發癥發生風險。吸煙:煙草中含有的有害物質可刺激肺部組織,引發肺炎,進而引起胸腔積液[13]。經VATS治療,存在吸煙史的患者肺膨脹不全風險較高,胸膜收到刺激,極易出現胸腔積液[14]。對此建議,針對吸煙患者,應于術前2周戒煙,同時做好呼吸道準備,及時排痰,必要時可輔以氧療。PCT:PCT是一種新型炎癥標志物,對早期急性細菌感染較為敏感,能夠促進中性粒細胞趨化因子、炎性因子的釋放,當PCT水平升高時,患者可能出現細菌感染,術后發生肺部感染風險增加,可能引起胸腔積液[15-16]。對此建議,及時檢測患者PCT水平,進行抗生素治療。低白蛋白血癥:白蛋白作為人體內最豐富的血清蛋白,其水平降低可導致血漿膠體滲透壓降低,增加壁層胸膜毛細血管液體濾出,導致組織生成液增加,當機體吸收無法負擔胸膜中蓄積的液體時,即可發生胸腔積液[17]。同時,合并低白蛋白血癥的患者多伴有營養不良、慢性炎癥反應,極易出現肺部感染,引起胸腔積液[18]。FEV1%:FEV1%≤60%提示患者胸壁順應性降低,加之術后疼痛影響呼吸肌做功,導致肺組織彈性回縮力減弱,甚至喪失,導致肺功能減弱,甚至產生相關肺部并發癥,出現胸腔積液[19]。對此,臨床于術前需充分評估患者肺功能,術前、術后均需進行肺功能鍛煉,以改善患者呼吸功能。
使用Bootstrap內部驗證法對肺癌患者VATS后發生胸腔積液風險預測進行驗證,校準曲線幾乎與Y=X直線重合,模型校準度良好;并對列線圖風險模型進行驗證,繪制ROC發現,胸腔積液發生風險預測模型預測肺癌患者VATS后胸腔積液發生風險的AUC>0.90,有一定預測價值。說明胸腔積液發生風險預測模型具有可行性,臨床可根據胸腔積液發生風險模型檢驗結果,指導肺癌患者VATS后胸腔積液發生的預測和診斷。
綜上所述,肺癌患者VATS術后胸腔積液的發生與高齡、合并糖尿病、吸煙史、低白蛋白血癥、PCT水平高、FEV1%有關,根據上述因素構建胸腔積液風險預測模型具有較好預測價值。

