化工流程題中金屬陽離子的轉化與分離
黃智躍 黃宜美 張賢金
摘要: 化工流程題是當下測評學生化學學科核心素養發展水平的優選題型之一,為克服學生的恐慌心理和認知障礙,
幫助學生快速精準地提高閱題效率,
提出“五線并舉閱流程”“相變視角看分離”“離子極化辨沉淀”的模型建構策略。以典型高考試題為著力點,運用離子極化理論和溶度積常數這一對定性、定量雙引擎分析和解構溶液中金屬陽離子逐一或分批沉淀的化學原理與邏輯思維。
關鍵詞: 化工流程; 離子極化; 模型構建; 核心素養; 工程思維
文章編號: 1005-6629(2022)11-0087-05
中圖分類號: G633.8
文獻標識碼: B
1 問題的提出
化工流程題是圍繞化工生產或實驗室模擬,選擇性地進行簡化處理[1],以化工素材中的流程為問題情境,將化學知識、工藝條件、實驗操作及綠色化學等知識、技能和價值觀有機融合的一類試題。此類試題是當下測評學生化學學科核心素養發展水平的優選題型之一[2]。
一個成熟的化工生產方案是以工程思維進行系統分析和比較權衡的籌劃性結果,是以解決實際問題為最終目標,基于科學原理,運用技術手段,合理利用資源,以最大效益滿足實際需求[3]的整體性、全局性統籌考慮的產物。因此,降低成本、提高效率、獲取更大效益(經濟效益和社會效益)是實際化工生產必然要考慮的問題。
試卷上所呈現出的化工流程題,面對的是高中學生這一受眾,進行選擇性地簡化處理是必要的。試題設計為了契合高中學生的認知水平,在強調適洽性、針對性的同時,也有其局限性,即呈現出的試題是經命題者修訂、加工、整理后的產物,實際的工業生產要更為復雜。
教學實踐中發現,閱題時不能快速有效地抓住要領、對常用操作方法的應用場景存在混淆和不能自如應用等是造成學生恐慌的常見原因。
為了幫助學生快速精準地提高閱題效率,提倡采用“五線并舉”的閱題策略。
2 “五線并舉”閱流程
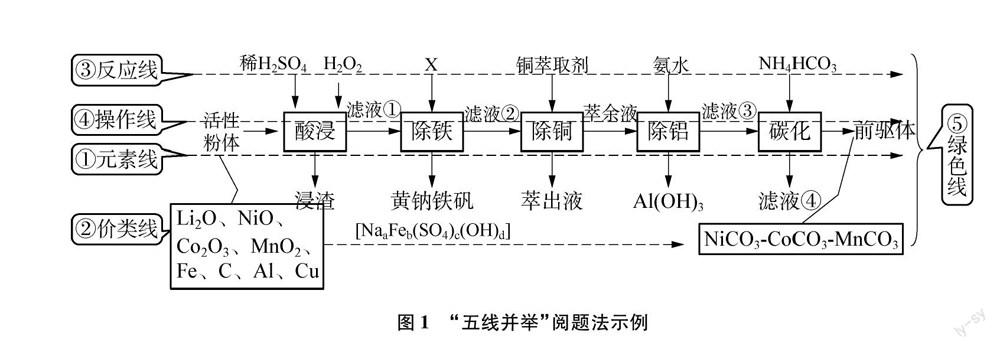
從化學學科視角,要實現物質的轉化、分離和提純,離不開元素的離合,元素的離合又會帶來元素價類的轉變,價類的轉變需要反應來支撐,物質的分離與提純又需相關實驗操作來實現,綠色化學理念貫穿始終。因此,抓住“元素線”“價類線”“反應線”“操作線”“綠色線”這五條線索,有助于在更寬廣的視野俯瞰整個流程,有利于迅速地提綱挈領、條分縷析。“五線并舉”閱題法示例如圖1所示。
例1 福建省2021年高考適應性考試流程見圖1。
“五線并舉”閱題法的思維模型為:主要金屬元素的匯集→金屬元素的去留→金屬元素價類的轉化→反應的選擇→操作的實施→綠色的要求。
其具體內涵為:
(1) 元素線:礦樣中主要含有哪些金屬元素?整個過程需要留下哪種(或哪些)核心金屬元素?分離(去除)哪種(或哪些)金屬元素?
(2) 價類線:這些主要金屬元素以何種價態、類別存在于礦樣中?產品中核心金屬元素的價類是怎樣的?原料中的核心金屬元素通過怎樣的價類轉化而生成產品的?金屬離子雜質又是通過怎樣的價類轉化來分離的?
(3) 反應線:在符合綠色化學、化工實際的前提下應用何種反應有利于金屬雜質離子的轉化分離以及核心金屬元素向產品的順利轉化?
(4) 操作線:在化學原理、物理原理的指引下選擇何種操作更有利于實際化工生產?
(5) 綠色線:宏觀上,如何實現成本節約、環境保護、節能減排、流程簡約、生產自動以實現最大的社會效益和經濟效益?微觀上,如何選擇原料、溫和反應、循環利用、環境友好地確立反應進程、生產設備和工藝路線?
抓住以上五條線索,就可以站穩化學學科視角,消除無效信息的干擾而快速入題。
3 相變視角看分離
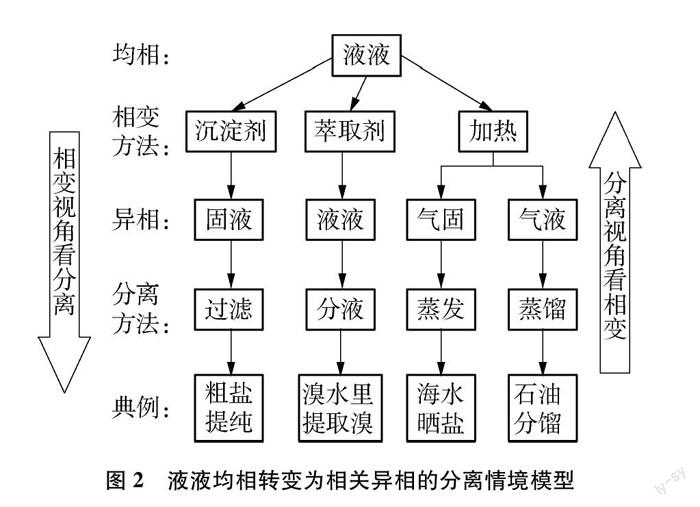
過濾、蒸發、結晶、蒸餾、萃取、分液等操作都是高中化學的必做實驗,遺憾的是,學生對這些分離操作所適用的場景往往來自于對實驗的回憶,知識分散,呈點狀分布,沒有形成系統化、結構化的體系,不利于“促進學生從化學學科知識向學科核心素養的轉化”[4]。如果能上升到“相”這一理論高度,就可以在“相變”的指引下實現對知識的濃縮,構建相應的模型和形成結構化網絡。
以液液均相轉變為異相為例,其分離情境模型建構如圖2所示。
相變視角看分離的思維模型為:均相→異相→分離→目標產物。
在制備無機物為主的化工生產中,往往需要對存在于礦物原材料中的諸多金屬化合物設法從固相轉變為液相,再對液相中的金屬離子進行逐一或分批轉化為固相難溶物而達到分離之目的。對于液液均相轉化為固液異相,過濾是常用的分離方法,該方法具有條件溫和、操作簡單、成本低廉、方便后續處理等優點,為化工生產所青睞,化工流程題中對金屬陽離子的分離也多采用該方法。
化工生產中要考慮的問題復雜而多面,近年來的化工流程題主要以無機化合物的制備為載體,其中金屬陽離子的轉化與分離是主線之一。面對有選擇的簡化處理后的化工流程題,為什么堿金屬一價陽離子(包括NH+4)往往比較難分離,而二價、三價的金屬陽離子經常較容易采用加入沉淀劑使之沉淀的分離方法?其背后的邏輯是什么?有什么理論支撐?
4 離子極化視角辨沉淀
4.1 教師知悉離子極化理論的必要性
回顧高中所學,水溶液中金屬陽離子應該形成何種沉淀的主要理論依據是“難溶電解質的溶解平衡”,Qc和Ksp的大小對比可判斷該沉淀物能否生成,不同化合物的Ksp數值大小對比可判斷其沉淀的先后,該原理從定量角度有力地給予證據支撐。凡事有利也有弊,數據無法展現思維過程,也無法解釋其中的思想,并不具備回答“這是為什么”的特質,缺乏感性的魅力。
為了克服Ksp數據思想性上的不足以及過于“冰冷”的缺點,“離子極化理論”給我們提供了一個便利且適合的定性視角。有了離子極化理論和溶度積這一對定性和定量的翅膀,作為執教者的我們就有了更多的工具和更為廣闊的視野。教師、學生共同思考并解釋溶解度問題的思維模型如圖3虛線所示。
學生視角:該情境下某金屬陽離子應該形成何種沉淀物→回想溶解性表→找出難溶的化合物有哪些→查閱Ksp數據→根據難溶程度和具體情境找出合適的沉淀物→考慮控制何種條件、加入何種試劑→形成何種沉淀并如何分離。
教師視角:根據離子極化理論→該陽離子的極化能力、變形性如何→該陽離子和何種陰離子生成何種沉淀物比較有利→查閱Ksp數據→根據提供的情境,知曉應控制何種條件加入何種試劑→分析逐一或分批沉淀的合理性→理解整個流程的適洽性、合理性和科學性。
4.2 離子極化理論要點
離子極化理論是在離子鍵理論和共價鍵理論的基礎上發展起來的。“極化”是指在外電場作用下,使分子、原子或離子的正、負電荷發生相對位移,產生誘導偶極的過程[5]。離子在外電場中所引起的電子云變形稱作離子的極化。
一個離子所帶電荷雖然很微渺,卻集中在如此微小的實體上,也必將產生強大的電場,它的電場使其他離子變形的作用叫“極化作用”,離子使異號離子極化的能力稱為該離子的“極化力”,離子本身在外電場作用下發生變形的性能叫“變形性”[6],離子的極化力愈大,表現在被極化的異電荷離子的變形性也就愈大。極化能力和變形性是離子本身具有的雙重性質,每個離子作為一個帶電體,在誘導鄰近離子發生變形的同時,本身亦可以發生變形,陰、陽離子相互極化的結果,彼此的變形性增大,這種陰、陽離子相互產生誘導偶極從而加強了離子間極化能力的過程,稱為離子間的附加極化。離子的電子層構型對附加極化的大小有重要的影響。每個離子的總極化作用應是原來的極化作用和附加極化作用之和,離子極化與鍵型的關系見圖4[7]。
離子極化力決定了它對鄰近離子施加靜電場的強度,卡特雷奇(G.H.Carteledge)[8]用“離子勢”即離子電荷與離子半徑之比(φ=Z/r)來表示陽離子的極化能力,該定義是從經驗導出的,不可能符合所有事實。邵俊、溫元凱等提出用離子有效核電荷與半徑來標度極化力:離子極化力=Z*2/r,徐光憲等提出用φ=Z/r2或φ=Z2/r[9]等函數關系式表示離子勢,以符合另一些事實。表示方法雖有不同,但都說明離子的電荷、半徑對離子極化能力有重要的影響,當電荷或半徑相近時,正離子極化能力由離子的電子層構型決定,其大致關系為:18e-或(18+2)e->9e-~17e->8e-或2e-。王稼國等強調要考慮13e-和18e-這類半充滿和全充滿電子構型離子的特殊性,這兩種電子構型離子的有效電荷略低于同周期前后相鄰的離子,其極化能力也較弱[10]。
當然,正離子也存在變形性,一般說來,正離子的φ越大,本身變形性越弱,而含dx電子的正離子變形性一般較強,如Ag+的極化能力和變形性都較大。負離子也存在極化能力和變形性,由于其Z(電荷數)<0,故φ<0,因此,φ越大,變形性一般也越大[11],如體積大的負離子,因其r大,φ大,所以變形性也大。離子極化作用的關聯概念和影響因素見圖5。
離子極化和無機物的顏色、溶解性、熔沸點、熱穩定性等物理化學性質都有密切的關系。應用離子極化理論解釋無機化合物相關性質的思維模型見圖6。
4.3 離子極化作用對無機化合物溶解度的影響
水的介電常數很大(約等于80),正負離子間的吸引力在水中可以減小80倍,很容易受熱運動的作用而互相分離[12],因此,離子晶體一般易溶于水。而介電常數不會使共價鍵的結合力減弱,所以共價化合物一般難溶于水。
徐光憲、王祥云[13]把Z2/r的大小作為極化程度或溶解度大小的度量。
(1) 最外能級組充滿或具有惰性氣體原子結構的正離子和含有fx或錒系及鑭系元素正離子:
① Z2/r<0.02(r以pm為單位),這類金屬離子(Li+、 Na+、 K+、 NH+4、 Rb+、 Cs+、 Fr+)只有很大的陰離子才可使之沉淀,如PtC12-6可使K+, NH+4, Rb+, Cs+, Fr+沉淀。
② 0.07>Z2/r>0.02,這類金屬離子(Mg2+、 Ca2+、 Sr2+、 Ba2+、 Ra2+)的硫化物和氯化物溶于水,氫氧化物微溶于水,碳酸鹽不溶于水。這一組金屬離子可用(NH4)2CO3作為沉淀試劑,把它們沉淀下來。
③ Z2/r>0.07,這類金屬離子(Be2+、 Al3+、 Sc3+、 Y3+、 La3+、 Ti4+、 Ce4+)的硫化物和氫氧化物不溶于水,在系統定性分析的條件下,可作為氫氧化物沉淀下來。
(2) 含有dx或過渡金屬離子的硫化物難溶。
5 例析“離子極化作用”“溶度積”應用于化工流程題中金屬陽離子的沉淀與分離
例2 2019年全國Ⅲ卷第26題流程見圖7。
高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、 Al、 Mg、 Zn、 Ni、 Si等元素)制備。
該流程涉及的金屬元素有:Mn、 Fe、 Al、 Mg、 Zn、 Ni,最終需留下的是Mn元素,其他離子要逐一或分批沉淀進行分離。
5.1 鐵、鋁的沉淀分離分析
根據離子極化理論,Al、 Fe轉變為+3價陽離子時,極化能力大,水溶液中通過調節pH使之成為氫氧化物沉淀比較有利,各相關離子氫氧化物的Ksp數據[14]見表1。表1數據顯示,Fe(OH)3、 Al(OH)3的Ksp數值要比其他四種小很多,通過調節溶液pH使之先沉淀進行分離是合理的。
5.2 鎳、鋅的沉淀分離分析
剩下四種元素Mn、 Mg、 Zn、 Ni,同理,從極化理論出發,Mg2+的0.07>Z2/r>0.02,難以形成硫化物沉淀。另外三種離子的硫化物溶解度小,可以考慮形成硫化物沉淀。
(1) Zn2+、 Ni2+、 Mn2+都是含有dx電子的過渡金屬離子,有著較強的極化能力和較大的變形性,因S2-的變形性也較大,這些金屬陽離子和S2-之間會產生較強的附加極化作用,形成的硫化物都難溶。
(2) Zn2+、 Ni2+、 Mn2+半徑相差不大又互不相鄰,不考慮半充滿或全充滿情況。Zn2+為18e-型,有著更強的極化能力和較大的變形性,故ZnS的溶解度應最小。
(3) 與Ni2+相比,Mn2+的dx電子數少,極化能力相對較弱,MnS的溶解性應大于NiS。
離子極化理論的定性分析得到表2里金屬硫化物Ksp數據的很好印證。流程題中“除雜1”操作便是通過加入Na2S使Ni2+、 Zn2+形成硫化物沉淀而分離的。
5.3 鎂的沉淀分離分析
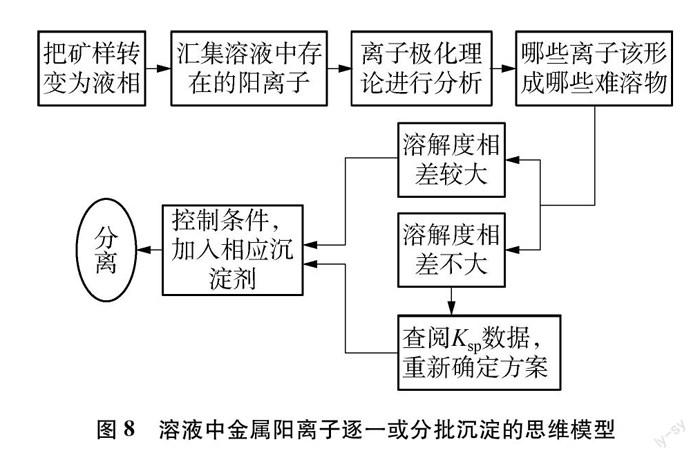
根據離子極化理論,Mg2+形成碳酸鹽比較有利,碳酸錳應該比碳酸鎂更難溶,Ksp數據(見表2)證實了這一點。所以,該情境下不能通過形成MgCO3沉淀的方法實現Mg2+的分離。
那為什么可以通過形成MgF2而實現Mn2+和Mg2+分離呢?Ksp數據[見表2,注:MnF2的Ksp數據是根據其溶解度(20℃,1.06g)數據[15]算出來的]為此提供了有力的證據。
綜上所述,溶液中的金屬陽離子逐一或分批沉淀分離的思維模型如圖8所示。
5.4 “沉錳”時加NH4HCO3的原因分析
Mn(OH)2的Ksp=2.06×10-13, MnCO3的Ksp=2.24×10-11,0.1mol/L NH4HCO3溶液的pH約為7.9,經計算可知,若要生成Mn(OH)2,此時Qc≈6.24×10-14,小于其Ksp,因此該沉淀無法生成。若要生成MnCO3,此時Qc≈4.43×10-5,大于其Ksp,則該沉淀可以生成;假設混合后NH4HCO3的濃度不變仍為0.1mol/L,可算出此時溶液中c(Mn2+)≈5.06×10-8mol/L,因此通過加入NH4HCO3可以讓Mn2+生成MnCO3且可以沉淀完全。
6 結語
為填平學生的知識凹點,克服學生的認知障礙和恐慌心理,在向學生闡釋相對陌生的分離方法的同時,建構相應的模型是很有必要的。教師在努力探求解決方案的同時多一點理論上的提升,將有利于我們站在更高的高度,擁有更廣闊的視野高屋建瓴地明晰事理,為核心素養的順利落地服務。
參考文獻:
[1] 趙雪, 王婷婷, 姜言霞. 化學工業流程題的命題實踐探索[J]. 化學教學. 2021, (8): 90.
[2] 吳俊杰, 姜建文. 素養測評為導向的化工流程題命制實踐與思考——以“海水提溴”為例[J]. 化學教學, 2020, (8): 84.
[3] 李丹妮, 劉金輝, 于亦凡. 《電子技術》課程工程思維培養策略[J]. 中國電力教育, 2019, (12): 75.
[4] 中華人民共和國教育部制定. 普通高中化學課程標準(2017年版2020年修訂)[S]. 北京: 人民教育出版社, 2020: 70.
[5] 那玉林. 包頭市自然區劃研究[J]. 陰山學刊(自然科學版), 1990,(1~2): 7~11.
[6] 黃尚毅, 葛文. 離子極化定量理論在無機化學中的應用[J]. 江西教育學院學報(自然科學版), 2000, 21(6): 32.
[7] 王文海. 離子極化理論在無機化學中的應用[J]. 陰山學刊(自然科學版), 1994, 12(4): 64.
[8] 李銘岫, 李炳煥. 無機化學選論[M]. 北京: 北京理工大學出版社, 2004: 94.
[9] 徐光憲, 王祥云. 物質結構(第二版)[M]. 北京: 科學出版社, 2010: 661.
[10] 王稼國, 荊西平, 肖洪平. 離子的極化和變形[J]. 化學通報, 2021, 84(5): 498.
[11] 王海軍. 離子勢的含義及其對物質性質的影響[J]. 化學教育(中英文), 2018, 39(13): 70.
[12] [13] 徐光憲, 王祥云. 物質結構(第二版)[M]. 北京: 高等教育出版社, 1987: 567, 567~569.
[14] 北京師范大學、華中師范大學、南京師范大學無機化學研究室. 無機化學下冊(第四版)[M]. 北京: 高等教育出版社, 2004: 419~420, 567~570.
[15] 汪永斌, 賀周初, 劉艷, 彭愛國, 莊新娟. 工業硫酸錳中鈣、鎂深度除雜的工藝研究[J]. 精細化工中間體, 2014, 44(3): 55.

