基于核心素養的高三專題復習
——氧化還原反應方程式的書寫
柯增援
(廣東省陽江市第三中學 529500)
氧化還原反應的化學(離子)方程式的書寫一直都是歷年來高考考察的重點、熱點內容.在教學中,筆者發現大多數同學對于書寫新情境下的氧化還原反應方程式感覺很棘手,稍微復雜的方程式都不知道怎么配平,失分嚴重.所以在高三的一輪復習中講解一節氧化還原反應方程式的配平十分重要和必要.
在教學中,筆者通過對比歸納總結出書寫配平氧化還原反應(離子)方程式的方法——四步法,建立一種模型來解析氧化還原反應(離子)方程式的內在規律,在與班級同學的分享交流中,效果良好.
模型的建立如下:
第一步:根據化合價的變化,確定四種物質(氧化劑、還原劑、氧化產物、還原產物);
第二步:根據得失電子守恒,配平四種物質;
第三步:根據原子守恒,配平其它物質(化學方程式);
根據電荷守恒,配平其它離子(離子方程式);
第四步:根據原子守恒、電荷守恒,査方程式是否配平.
一、教學過程設計
模塊一、復習氧化還原反應(離子)方程式的配平
1.正向配平法:適用于反應物中氧化劑和還原劑是不同的物質
第一步:根據化合價的變化,明確四種物質.在化合價有升降的元素下用“↑”“↓”標出升或降的數值.
還原劑 氧化劑 氧化產物 還原產物
第二步:根據得失電子守恒,配平四種物質.取變價元素的最小公倍數,確定四種的系數.
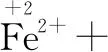
↑1×5 ↓5×1
第三步:根據電荷守恒,配平其它物質.
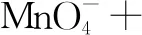
5×(+2) 1×(-1) X×(+1) 5×(+3) 1×(+2)
左邊電荷數:
5×(+2)+1×(-1)+X×(+1)= 9+X
右邊電荷數:
5×(+3)+1×(+2)= +17
根據電荷守恒,左右兩邊電荷相等,X=8,H+前面配8,H2O前面配4.
第四步:根據原子守恒、電荷守恒,査方程式是否配平.
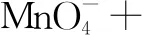
2.逆向配平法:適用范圍:①部分氧化還原 ②自身氧化還原(含歧化反應)
第一步:根據化合價的變化,明確四種物質.在化合價有升降的元素下用“↑”“↓”標出升或降的數值.
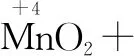
氧化劑 還原劑 還原產物 氧化產物
HCl中有一部分Cl元素生成了Cl2,有一部分還是Cl-,采用逆向配平法.
第二步:根據得失電子守恒,配平四種物質.取變價元素的最小公倍數,確定四種的系數.
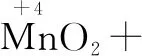
↓2×1 ↑1×2
注意Cl2按照兩個Cl元素的變化計算.
第三步:根據原子守恒,配平其它物質.

HCl中有2HCl元素生成了Cl2,有2HCl生成了MnCl2,故HCl前面的系數4,H2O前面的系數是2.
第四步:根據原子守恒,査化學方程式是否配平.
在氧化還原反應的化學(離子)方程式的配平中,最重要的是找到變價的四種物質,可以正向配平(用氧化劑和還原劑配平),也可以逆向配平(氧化產物和還原產物配平),還可以前后配平,即用氧化劑和氧化產物或者還原劑和還原產物配平,只要是變價的兩種物質就可以配平.
模塊二、新情景下的氧化還原反應的化學(離子)方程式的配平
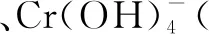
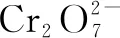
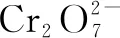
第一步:根據題給信息寫出部分反應物和生成物,根據化合價的變化,明確四種物質.
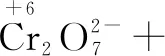
氧化劑 還原劑 還原產物 氧化產物
第二步:根據得失電子守恒,配平四種物質.取變價元素的最小公倍數,確定四種的系數
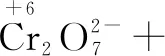
↓3×2×1 ↑2×3
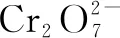
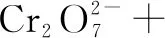
1×(-2) 3×(-1)
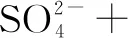
2×(+3) 3×(-2)
左邊電荷數:1×(-2)+ 3×(-1)+X=-5+X;右邊電荷數:2×(+3)+ 3×(-2)=0.根據電荷守恒,左右兩邊電荷相等,X=5,H+前面配5,H2O前面配4.
第四步:根據原子守恒,電荷守恒,査方程式是否配平
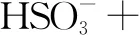
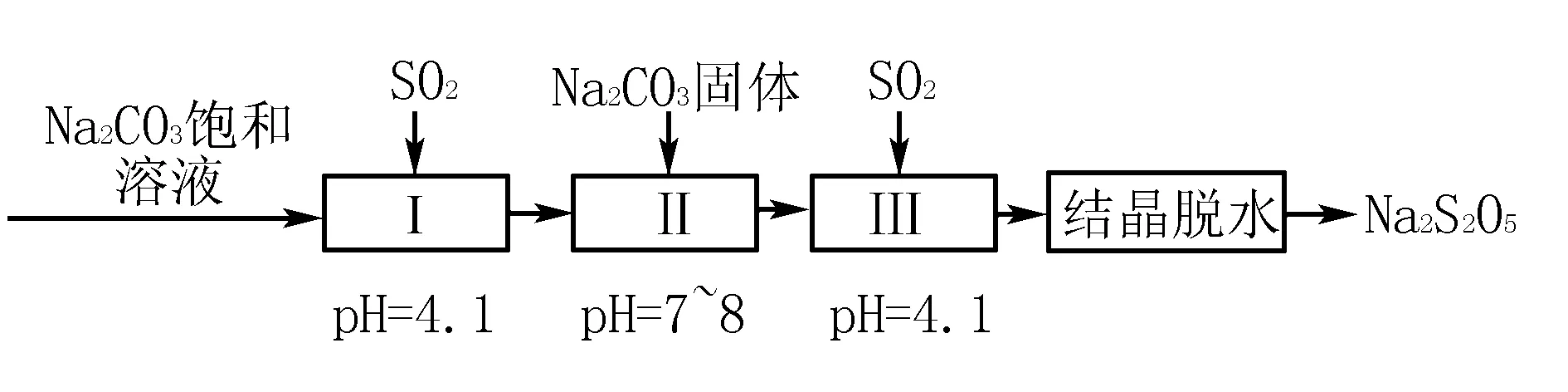
高考題實例剖析2 (2018 年全國卷理綜第27題節選) 焦亞硫酸鈉(Na2S2O5)在醫藥、橡膠、印染、食品等方面應用廣泛.回答下列問題:
(1)利用煙道氣中的SO2生產Na2S2O5的工藝為:
(2)Na2S2O5可用作食品的抗氧化劑.在測定某葡萄酒中Na2S2O5殘留量時,取50.00 mL葡萄酒樣品,用0.01000 mol·L-1的碘標準液滴定至終點,消耗10.00 mL.滴定反應的離子方程式為____.
解析根據題目,Na2S2O5可用作食品的抗氧化劑,說明Na2S2O5具有還原性,作還原劑.實驗用 I2標準溶液滴定葡萄酒樣品,I2作為氧化劑.要書寫滴定反應的離子方程式,可以按照以下步驟進行:
第一步:根據題給信息寫出部分反應物和生成物,根據化合價的變化,明確四種物質.
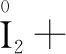
氧化劑 還原劑 氧化產物 還原產物
第二步:根據得失電子守恒,配平四種物質.取變價元素的最小公倍數,確定四種的系數.
2I2+1S2O52-→2SO42-+4I-
↓1×2 ↑2×2
第三步:根據電荷守恒原則,并結合環境的性質判斷缺項.題目中制備Na2S2O5的環境是酸性環境,只能在是在生成物邊加上H+來配平電荷守恒,反應物配H2O.
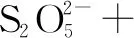
0 1×(-2) 2×(-2) 4×(-1)X×(+1)
左邊電荷數:1×(-2)=-2;右邊電荷數:2×(-2)+4×(-1)+X×(+1)=-8+X;
根據電荷守恒,左右兩邊電荷相等,X=6,H+前面配6,H2O前面配3.
第四步:根據原子守恒和電荷守恒,査方程式是否配平
2I2+1S2O52-+3H2O =2SO42-+4I-+6H+
由此可見,在高三復習中,先幫助學生建立氧化還原反應的化學(離子)方程式配平的模型,培養學生的解題思路,指導學生認真讀懂題意,利用氧化還原反應規律,結合題目中化學反應的環境,就可以正確快速地書寫出新情境下的氧化還原方程式.
二、設計理念
《普通高中新課程方案導讀》中提到“教師在以各種表征的方式呈現重要的內容時,應該盡量以強而有力的觀念為核心,將其組織成為相互關聯的資訊網絡,以便學生能以統整的方式來汲取這些內容;教師在講解與詮釋內容時,應該以這些重要的觀念及其間的關聯為焦點”.以上【模塊一】是【模塊二】的基礎和鋪墊;【模塊二】內容是【模塊一】內容的繼續、延伸和拓展.通過【模塊二】的設計,學生將【模塊一】學到的“四步法”模式深入的理解和應用.高考中新情景下的反應雖然是陌生,但是解題思路是相通的,幫助學生建立解題的模型顯得非常重要,這樣學生才能夠以不變應萬變.

