非淀粉多糖酶對黃羽肉仔雞生長性能、養分利用率及盲腸微生物多樣性的影響
■孫 皓 戴 煒 周響艷 戰曉燕 張 濤 葉 慧 董澤敏 馮定遠*
(1.華南農業大學動物科學學院,廣東廣州510642;2.上海農林職業技術學院,上海201699;3.贏創德固賽(中國)投資有限公司,北京 100600)
近年來,隨著畜禽業的迅猛發展,玉米作為主要的能量飼料,價格持續走高。而我國小麥資源豐富,價格比玉米低,其蛋白質、煙酸、賴氨酸等含量比玉米高,因而開發小麥飼糧具有一定的現實意義和較高的經濟價值。然而小麥中含有大量非淀粉多糖(nonstarch polysaccharides,NSP),單胃動物消化道內缺乏消化這類多糖的內源酶,故這些物質不能被有效消化利用[1-2]。因此促進小麥中非淀粉多糖的降解成為一個研究方向。已有研究表明,在小麥飼糧中添加以木聚糖酶為主的NSP酶制劑,可以消除NSP的抗營養作用,提高小麥營養價值和動物生產性能[3-5],因此飼料用酶制劑的開發和應用已成為現代飼料工業和現代養殖業不可缺少的重要組成部分,而酶制劑正確合理地使用,可以有效緩解飼料資源緊缺的現狀。本試驗在小麥型飼糧中添加不同復合酶制劑(復合酶組成為:木聚糖酶、β-葡聚糖酶),研究其對黃羽肉仔雞生長性能、養分代謝率和盲腸微生物的影響,探討復合酶制劑對肉仔雞的營養效應,以期為肉仔雞養殖過程中合理有效地利用復合酶制劑提供理論依據。
1 材料與方法
1.1 試驗材料
本試驗復合酶由溢多利酶制劑公司技術研發部提供,主要由木聚糖酶、β-葡聚糖酶等組成,其中復合酶A中木聚糖酶和β-葡聚糖酶的酶活力分別為15 000 U/g和2 000 U/g;復合酶B中木聚糖酶和β-葡聚糖酶的酶活力分別為10 000 U/g和1 000 U/g。
1.2 試驗日糧
飼養試驗飼糧參考NRC(1994)肉雞的營養需要,并結合養殖場飼糧組成標準進行配制。日糧組成及營養水平見表1。
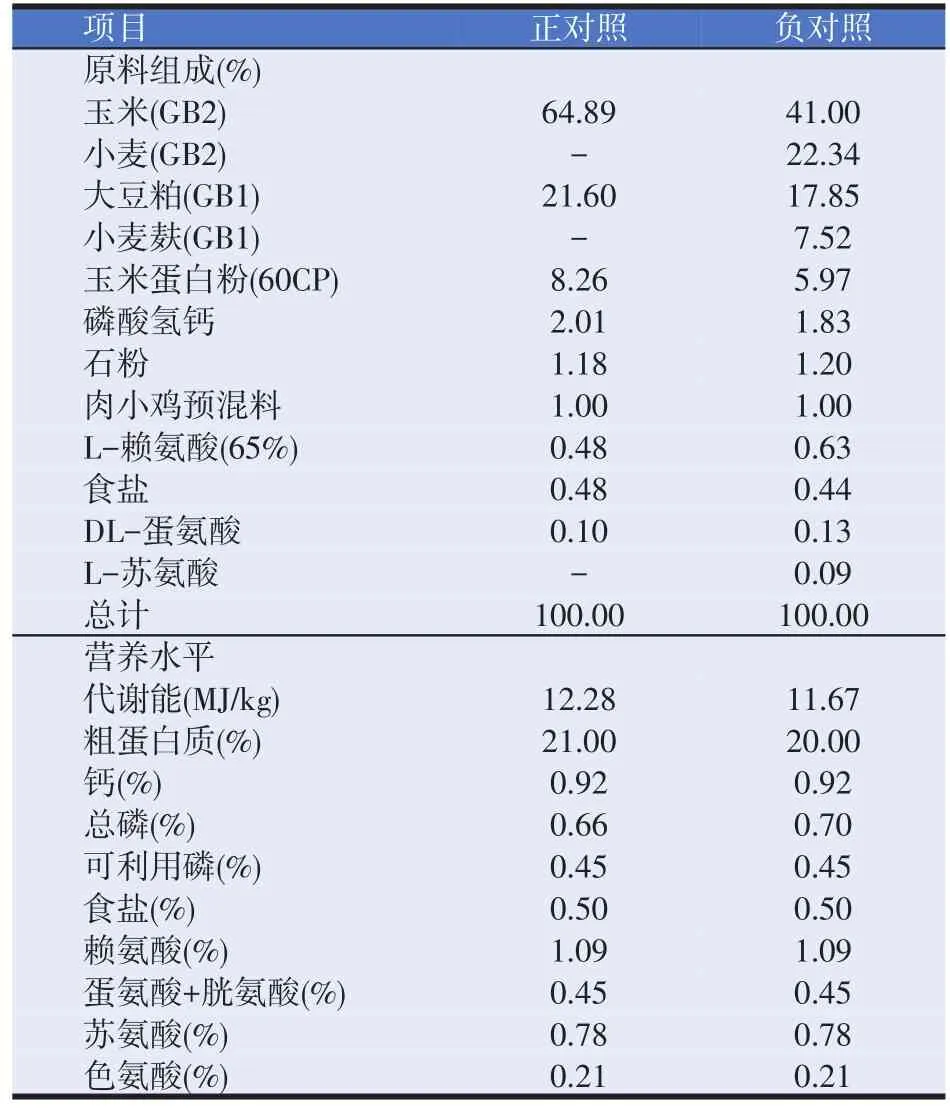
表1 試驗日糧配方和營養水平(風干基礎)
1.3 試驗設計與飼養管理
試驗采用單因子隨機分組試驗設計,選擇1日齡的健康黃羽肉雛雞(雄性)1 440只,隨機分成4個處理組(見表2),每組6個重復,每個重復60只。飼養試驗持續21 d。

表2 試驗分組情況
2 測定指標與方法
2.1 肉雞生長性能
記錄試驗前體重,每天觀察雞的健康狀況,每周稱量雞的活體重和余料重量,統計肉仔雞的平均日采食量、平均日增重和料重比。
2.2 代謝試驗
2.2.1 試驗分組
采用全收糞法。試驗選用60只成年公雞,隨機分成5組,每個處理組6個重復,每個重復2只雞。其中一組為內源組,其他4組分別為正對照組、負對照組、復合酶A組、復合酶B組。用試驗飼糧預飼3 d,然后連續收集4 d糞樣。糞樣收集后按每100 g鮮樣加10%硫酸5 ml、滴加5滴甲苯防腐,混勻并置于-20℃冰柜中保存,用于干物質代謝率、能量代謝率和粗蛋白質代謝率測定。
2.2.2 測定指標及方法
飼料、糞樣和食糜的測定指標有干物質、總能、粗蛋白質和粗纖維;總能、攝入飼料能值、排泄物能值采用燃燒法,用長沙儀器廠生長的WGR-1G微電腦煤質測定處理儀測定;粗蛋白質采用凱氏微量定氮法,用FOSS 2300 KJELTEC ANALYZER UNIT自動定氮儀測定。

2.3 屠宰試驗
飼養試驗結束后(雞已停料12 h),以重復為單位,每個重復取體重接近平均水平的2只試驗雞(共48只)。取腺胃、肌胃(去除內容物)、心臟、肝臟和胰臟迅速稱其鮮重并計算內臟器官指數。體表消毒后取整段盲腸,液氮中保存備用。
內臟器官指數(%)=內臟器官鮮重(g)/體重(g)×100
2.4 盲腸微生物區系
試驗時取盲腸中部約2 cm,截取1 cm用于試驗,采用EZgeneTM Bacterial gDNA Kit(Biomiga,USA)試劑盒提取DNA。利用細菌通用引物(由上海生物工程有限公司合成)擴增16S rDNA的V6~V8區片段。PCR上游引物為帶有GC夾子的U968-GC-f:5’-CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG GAA CGC GAA GAA CCT TAC-3’,下游引物(L1401r):5’-CGGTGTGTACAAGACCC-3’。擴增程序為94 ℃5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 50 s,35循環;72 ℃10 min,PCR產物采用BIO-RAD DCodeTM Universal Mutation Detection System進行DGGE電泳檢測,并用Bio-Rad公司的Quantity one軟件進行分析。
2.5 數據統計處理
試驗結果采用“平均數±標準誤”表示,用SPSS 17.0軟件進行數據分析,各指標差異顯著性分析用One-way ANOVA進行分析,用LSD法進行多重比較。
3 結果與分析
3.1 復合酶對黃羽肉仔雞生長性能的影響(見表3)
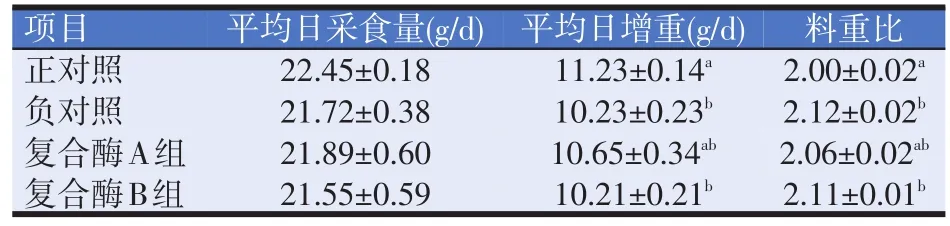
表3 復合酶對1~21日齡黃羽肉仔雞生長性能的影響
由表3可知,1~21日齡時,復合酶B組試驗雞平均日采食量最低,正對照組最高,各組間差異不顯著(P>0.05);負對照組、復合酶B組試驗雞的平均日增重與正對照組差異顯著(P<0.05),復合酶A組比負對照組提高了4.11%,但差異不顯著(P>0.05);正對照組試驗雞的料重比最低,負對照組最高,負對照組、復合酶B組與正對照組差異顯著(P<0.05),復合酶A組比負對照組降低了2.83%,但差異不顯著(P>0.05)。
3.2 復合酶對黃羽肉仔雞內臟器官發育的影響(見表4)
由表4可知,1~21日齡,負對照組試驗雞的心臟重量最低,復合酶B組最高,復合酶B組比正對照組和負對照組分別提高了13.02%、24.03%,差異顯著(P<0.05),復合酶A組比負對照組提高了22.73%,差異顯著(P<0.05);其他各組之間差異不顯著(P>0.05)。各組間的肝臟、脾臟和腺胃重量差異均不顯著(P>0.05)。復合酶B組試驗雞的胰腺重量與正對照組差異顯著(P<0.05);其它各組之間差異不顯著(P>0.05)。復合酶A組試驗雞肌胃重量比正對照組和負對照組分別提高了13.88%、18.52%,差異顯著(P<0.05);其它各組之間差異不顯著(P>0.05)。
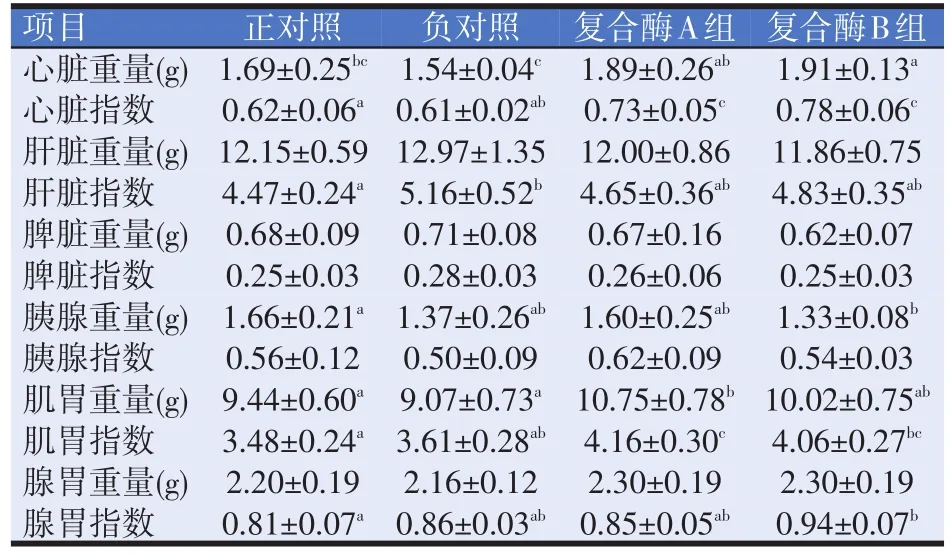
表4 復合酶對黃羽肉仔雞內臟器官重量及指數的影響
復合酶A組、復合酶B組試驗雞心臟指數分別與正對照組和負對照組均差異顯著(P<0.05)。正對照組試驗雞的肝臟指數與負對照組差異顯著(P<0.05),其他各組差異不顯著(P>0.05)。各組之間的脾臟指數和胰腺指數差異均不顯著(P>0.05)。復合酶A組試驗雞的肌胃指數比正對照組和負對照組分別提高了19.54%、15.24%,差異顯著(P<0.05),復合酶B組與正對照組差異顯著(P<0.05)。復合酶B組試驗雞的腺胃指數比正對照組提高了16.05%,差異顯著(P<0.05);其他各組之間差異不顯著(P>0.05)。
3.3 復合酶對營養物質消化代謝率的影響(見表5)
由表5可知,復合酶A組、復合酶B組飼料中干物質表觀消化率比負對照組分別提高了3.93%、2.29%,差異不顯著(P>0.05);復合酶A組的粗蛋白質真代謝率比負對照組提高了47.63%,差異極顯著(P<0.01),復合酶B組比負對照組提高了21.34%,但差異不顯著(P>0.05)。復合酶A組、復合酶B組的能量代謝率比負對照組分別提高了2.75%、1.55%,但差異不顯著(P>0.05)。

表5 復合酶對飼料中營養物質代謝率的影響(%)
3.4 復合酶對盲腸微生物的影響(見圖1、圖2)

圖1 盲腸微生物DGGE電泳圖譜
從圖1、圖2中可以看出,樣品經過變性梯度凝膠電泳之后,都可以分離出數目不等的電泳條帶,各處理組之間至少有3條共同的條帶,即同有菌。另外,加酶組也出現了自己獨有的條帶,即獨有的優勢菌種。同時,同一組內的三條泳道的條帶的位置和數目也不相同,說明不同雞個體間腸道微生物菌群也存在一定差異。對DGGE電泳條帶進行統計見表6,由表6可知,正對照組試驗雞的盲腸微生物DGGE電泳條帶數目最少,復合酶B組最多,兩復合酶組分別比正對照組提高了14.27%和14.59%,均差異極顯著(P<0.01);復合酶B組比負對照組提高了6.72%,差異顯著(P<0.05);復合酶A組比負對照組提高了6.43%,有顯著性趨勢(P=0.06)。
4 討論
4.1 復合酶對肉仔雞生長性能的影響
非淀粉多糖根據水溶性分為不溶性非淀粉多糖(insoluble non-starch polysaccharides,INSP)和水溶性非 淀 粉 多 糖(soluble non-starch polysaccharides,SNSP)。無論INSP還是SNSP對動物生長性能的都有極大的影響,主要體現在阻礙飼料原料細胞內營養物質的釋放,抵制消化酶活性和增加食糜黏度[6]。研究表明,飼糧中添加NSP酶制劑可以有效破壞NSP的結構,從而降低NSP抗營養作用,提高動物的生長性能[7-8]。本試驗中,負對照組比正對照組能量降低了0.61 MJ/kg(降低了5%),在負對照組飼糧中添加復合酶不同程度地提高了黃羽肉仔雞的生長性能,與前人通過添加復合酶提高動物生長性能結果一致[7]。

圖2 盲腸微生物DGGE電泳條帶示意圖

表6 復合酶對盲腸微生物DGGE電泳條帶的影響
4.2 復合酶對內臟器官發育的影響
飼糧的營養狀況會直接影響雞的體型參數和內臟器官的發育,而內臟器官的發育情況會直接影響到雞對營養物質的消化吸收、體重的增加以及屠宰性狀的改善。NSP溶解使腸道食糜黏度和體積增加,刺激消化腺的增生以增加消化酶的分泌量,動物機體作出代償性的生理反應,增加消化器官的負擔導致動物胰臟、肝臟的增大。Ikegami等[9]表明,長期飼喂含NSP的日糧可增加消化液的分泌,使消化器官代償性增大。日糧中添加酶制劑后可以消除NSP所帶來的負面效應,改善內臟器官的發育。王金全[7]報道,與小麥基礎飼糧組相比,添加木聚糖酶后胰臟相對重量降低13%,其它消化器官相對重量有降低趨勢但差異不顯著。本試驗中,加酶組比正常飼糧降低了0.61 MJ/kg的能量,并且添加了小麥22.34%和小麥麩7.52%,從而增加飼糧粗纖維含量,但是從試驗結果我們可以看出,大多數內臟器官重和器官指數與正負對照組差異均不顯著(P>0.05),并且加酶組的數值大部分都在負對照組與正對照組之間,比負對照組效果要好,但比正對照組效果稍微差一點,說明加酶能改善非常規飼料(小麥、小麥麩)的營養,小麥+復合酶能部分替代玉米。其中復合酶A組比復合酶B組的效果要好。
4.3 復合酶對飼糧營養物質代謝率的影響
研究表明,復合酶能提高飼糧營養物質消化代謝率,原因可能在于酶制劑對飼糧中抗營養因子的破壞作用[10-12]。玉米、豆粕、菜籽粕、小麥等常用植物性飼料原料細胞壁中NSP含量均較高,復合酶制劑中所含的NSP酶能破壞細胞壁結構,促進細胞壁崩解,使細胞壁包裹的各種營養物質充分釋放出來,與畜禽腸道內的消化酶充分接觸,從而提高各種養分的消化率。同時,酶制劑能消除SNSP對內源性消化酶的抑制作用。有研究報道SNSP可抑制消化道中淀粉酶、二糖酶和脂肪酶的活性。本次試驗,兩組復合酶制劑對干物質表觀消化率、粗蛋白質真代謝率、能量代謝率都有不同程度的提高,其中復合酶A組的效果要好于復合酶B組,復合酶A組的粗蛋白質真代謝率比負對照組提高了47.63%,差異極顯著(P<0.01),其它的均差異不顯著。這有可能是因酶制劑種類和數量以及做代謝試驗的動物有差異所造成的試驗結果不一致。
4.4 復合酶對盲腸微生物區系的影響
動物腸道微生物復雜多樣,形成一個相對穩定平衡的微生態系統,對其生長和健康起著非常重要的作用。NSP可以通過腸道微生物間接發揮其抗營養作用。NSP抑制了養分的消化和吸收,未能在小腸內消化和吸收的養分進入到后腸道,導致營養物質在后腸道內的蓄積,溫暖濕潤富含養分的食糜是細菌特別是致病菌理想的培養基,利于細菌的大量繁殖;高黏度的食糜通過消化道的速度降低,菌群移動減慢,為細菌生長繁殖提供了一個穩定的環境。此外,高黏度的食糜使消化道內的氧氣減少,利于厭氧微生物的生長,細菌大量繁殖并刺激腸道,增厚腸道黏膜,損害微絨毛,加劇宿主和細菌之間的競爭[13]。傳統培養法一般采用選擇性培養基通過倍比稀釋及菌落計數,將各種菌分離和鑒定。它可在菌株水平測定活菌含量,較直觀,計數簡單,方便實用,但只能研究比較容易培養的微生物。隨著分子生物學技術的發展,基于16S rRNA、18S rRNA分子技術促進了動物體內微生物研究的發展,尤其是被稱為DNA指紋技術的變性梯度凝膠電泳(denaturing gradient gel electrophoresis,DGGE)研究微生物多樣性以來,受到越來越多科學工作者的關注。變性梯度凝膠電泳(DGGE)技術是一種利用不同DNA片段解鏈特性和梯度變性膠(由尿素和甲酰胺組成的變性劑的濃度不同)的特性,在聚丙烯酰胺凝膠電泳時將不同DNA片段分離開來的系統,可檢測只有一個堿基差異的DNA片段。該技術是最早在醫學上用于檢測基因突變的,近年來PCRDGGE也開始用于腸道菌群的微生態研究[14-15]。本試驗利用該技術對小麥型飼糧添加復合酶制劑對盲腸菌群變化進行了研究。從表6可以看出,兩個加酶組顯著提高了電泳條帶數,說明了酶制劑的添加影響了腸道菌群的建立,增加了一些優勢菌群的種類。一方面由于添加酶后,致使食糜黏度降低,腸道運動加速,從而縮短食糜在消化道的停留時間,防止蛋白質、糖類、脂肪在腸道的過度發酵,使大量病原菌的繁殖條件不能建立而減少了后腸道有害微生物的數量,增加了一部分有益菌的種類和數量;另一方面可能是酶降解非淀粉多糖成寡糖所引起的,Catala等[16]研究報道,多數寡糖對宿主的保健作用主要是通過促進有益菌的生長來實現的。還有一些寡糖還能夠有效清除或減少部分黏附到腸腔的病原菌。另外,同一組內的樣本雖然存在共有菌,但組內相似性整體不高,都低于85%,說明組間個體間差異較大,并不能嚴格反映酶對其菌群變化的影響,此外,DGGE技術本身的局限性對實驗也有一定的影響,DGGE只能檢測到細菌總數超過1%的菌群[17],所以樣品中尚有一些細菌未能充分反映。
5 結論
①與負對照組相比,復合酶A和復合酶B均有降低料重比的趨勢,但沒有達到顯著性水平。且復合酶A組的效果要好于復合酶B組,復合酶A組比負對照組平均日增重提高了4.11%,料重比降低了2.83%。
②與正對照組相比,復合酶A、B均有提高黃羽肉仔雞的心臟、肌胃重量以及心臟、肌胃、腺胃指數的趨勢。
③與負對照組相比,復合酶A組極顯著地提高了粗蛋白質真代謝率,而且對干物質表觀消化率和能量代謝率也有不同程度的提高,但不顯著。
④復合酶A、B可增加黃羽肉仔雞盲腸中一些優勢菌群的種類。

