脂溢性角化病皮損組織蛋白酶L2表達及活性對黑素小體降解的影響
蘇夢云 雷鐵池 易文娟 苗芳 江珊 徐世正430060武漢大學人民醫院皮膚科
脂溢性角化病(seborrheic keratosis,SK)的主要病理改變為角化過度、棘層肥厚、乳頭瘤樣增生,同時伴有大量黑素顆粒堆積[1?2]。組織蛋白酶L2(cathepsin L2,CTSL2)是一種內吞體-溶酶體木瓜蛋白酶樣半胱氨酸蛋白內切酶,表達于巨噬細胞、胸腺、睪丸、角膜上皮和表皮[3]。有人提出角質形成細胞(KC)表達CTSL2水平下降,可能減弱了對KC分泌的表皮生長因子(EGF)水解,增強了EGF介導的KC增殖[4]。研究表明,淺膚色高加索人表皮CTSL2 mRNA表達水平是深膚色非洲裔人的7.5倍[5]。超微結構觀察證實,高加索人表皮KC內的黑素小體完全降解消失,而非洲裔人表皮KC內仍殘留有未被降解的黑素小體[6]提示CTSL2 mRNA表達水平可能還影響著表皮內黑素小體的降解速率。本研究觀察了SK皮損CTSL2的表達水平以及黑素小體超微結構變化,探討CTSL2在SK皮損形成中的作用。
材料與方法
一、對象
2016年1-8月武漢大學人民醫院皮膚科門診確診的SK患者20例,其中男11例,女9例,年齡57~78歲。15例(男9例,女6例)的標本石蠟包埋、制備電鏡超薄切片;5例新鮮標本(男2例,女3例)分離表皮組織行PCR與酶活性測定。本研究通過武漢大學人民醫院醫學倫理委員會批準,入選病例均簽署知情同意書。
二、試劑與儀器
Trizol試劑、RT?PCR試劑盒(美國Invitrogen公司);LTSL2熒光底物 Z?Leu?Arg?AMC(瑞士 Enzo Life Sciences公司);兔抗人單克隆Ki67抗體(美國Abcam公司);AEC試劑盒(美國BOSTER公司),BCA試劑盒(美國Peirce公司),中性分散酶(美國Sigma公司),7000FA型100千伏生物型透射電鏡(日本日立公司),BioTek熒光酶標儀(美國Synergy HT公司)。其余化學試劑均為市售分析純。
三、方法
1.標本采集:取15例皮損組織與周圍正常皮膚組織(對照),中性甲醛與戊二醛固定,制備石蠟切片與電鏡超薄切片。取5例SK皮損與周圍正常組織,用0.25%中性分散酶消化過夜,分離表皮,微量電動組織勻漿器研磨,用于總RNA提取。
2.免疫組化:石蠟切片脫蠟脫水,于三羥甲基氨基甲烷-乙二胺四乙酸(Tris?EDTA)緩沖液(0.01 mol/L,pH9.0)中高溫熱修復3 min,室溫自然冷卻,滴加抗Ki67抗體,4℃濕盒過夜,滴加二抗孵育,AEC顯色(陽性著色呈紅色);蘇木素復染細胞核,中性樹膠封片。
3.Fontana?Masson嗜銀染色:石蠟切片脫蠟后,于氨銀溶液中37℃避光水浴浸染2.5 h,蒸餾水洗2 min,0.1%的氯化金溶液處理3 min,蒸餾水洗2次,5%硫代硫酸鈉溶液固定2 min,蒸餾水沖洗3 mim,伊紅復染,無水乙醇脫水,中性樹膠封片。于正置顯微鏡下觀察并攝像,使用Image?J圖像分析軟件(美國NIH免費版)計算相同面積內黑素顆粒的灰度值。
4.透射電鏡觀察皮損中黑素小體外膜結構的完整性:每個標本切10張超薄切片,經鈾-鉛雙染色后觀察。
5.RT?PCR檢測CTSL2 mRNA的表達:Trizol法提取皮膚標本中總RNA,逆轉錄合成第1鏈cDNA。引物序列:人CTSL2,正向引物5′?TTCCGTGAGCCT CTGTTTCT?3′,反向引物 5′?CGAATTTGCTCCTTCA AAGC?3′,擴增片段長度558 bp;內參照物β肌動蛋白,正向引物 5′?AGCGAGCATCCCCCAAAGTT?3′,反向引物 5′?GGGCACGAAGGCTCATCATT?3′,擴增片段長度285 bp。引物由生工生物工程(上海)股份有限公司合成。PCR反應體系為20 μl,反應條件:94℃變性30 s,55℃退火30 s,72℃延伸30 s,共30個循環。重復3次。PCR終產物經2%瓊脂糖凝膠電泳后,用凝膠成像系統進行灰度值掃描,并以Image?J軟件分析,以目的條帶與β肌動蛋白條帶的比值代表目的基因mRNA相對水平。
6.CTSL2酶活性測定:參照文獻[7]的方法。將5例新鮮的表皮片置于液氮20 s快速冷凍、復蘇,連續5次,置于離心管內,電動勻漿器研磨1 min;用醋酸鹽緩沖液(含100 mmol/L醋酸鈉,2.5 mmol/L EDTA和2.5 mmol/L二硫蘇糖醇,pH 6.0)重懸,離心取上清液。BCA試劑盒測定上清液蛋白濃度。將上清液與熒光底物于37℃孵育15 min,BioTek熒光酶標儀測定熒光強度值(激發波長365 nm,散發波長450 nm)。
7.人眼黑素小體分離與體外處理:經知情同意獲取1例35歲男性行眼球摘除術患者的1枚廢棄眼球。參照文獻[8]用蔗糖梯度離心法分離純化視網膜色素上皮黑素小體。將黑素小體用含有SK皮損或正常皮膚組織裂解物上清液的醋酸鹽緩沖液重懸,37℃孵育1 h,離心棄上清液。黑素小體離心團塊用2.5%戊二醛固定液固定,制備超薄切片,透射電鏡觀察。每個樣本攝5張不同視野照片,計數100個黑素小體中膜不完整黑素小體的個數,計算黑素小體損傷百分率。
8.統計學分析:用SPSS 17.0軟件進行統計分析,計量資料以±s表示。兩組間均數比較采用配對t檢驗,P<0.05為差異有統計學意義。
結 果
一、SK皮損組織病理檢查
HE染色示,SK皮損角化過度、棘層肥厚、乳頭瘤樣增生。Fontana?Masson嗜銀染色示,15例SK(棘層肥厚型13例,腺樣型2例)皮損均可見大量嗜銀黑素顆粒沉積,而正常皮膚僅基底層見線形沉積的黑素顆粒。SK皮損中黑素顆粒的含量高于正常皮膚(表1)。免疫組化染色示,大量Ki67陽性細胞主要分布在基底淺層,而正常皮膚僅在基底層,且SK皮損中Ki67表達量明顯高于正常皮膚(P<0.05)(表1、圖1)。透射電鏡結果示,SK皮損表皮細胞內黑素小體損傷率低于周圍正常皮膚(P<0.05)(表1、圖2)。
表1 脂溢性角化病(SK)與周圍正常皮膚組織黑素顆粒含量、黑素小體損傷率、Ki67染色、組織蛋白酶L2 mRNA表達水平及酶活性的比較(±s)

表1 脂溢性角化病(SK)與周圍正常皮膚組織黑素顆粒含量、黑素小體損傷率、Ki67染色、組織蛋白酶L2 mRNA表達水平及酶活性的比較(±s)
注:RFU,相對熒光單位
組別SK皮損正常組織t值P值黑素顆粒灰度值(15例)158.43±11.79 122.43±13.95 7.63<0.05黑素小體損傷率(%)(15例)24.33±3.06 49.00±4.00 8.49<0.05 Ki67染色(×103)(15例)11.74±0.12 2.35±0.17 29.95<0.05組織蛋白酶L2(5例)mRNA 0.35±0.09 0.43±0.08 3.17<0.05酶活性(RFU,×103)17.46±0.45 28.78±0.58 34.29<0.05
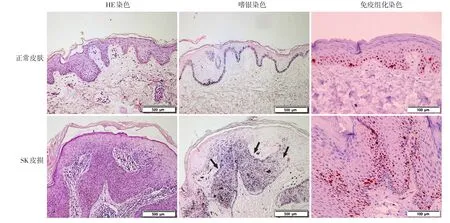
圖1 正常皮膚和脂溢性角化病(SK)皮損組織染色的鏡下表現 SK皮損可見角化過度、棘層肥厚、乳頭瘤樣增生等病理改變(HE×200),并可見大量黑素顆粒堆積(黑色箭頭示,Fontana?Masson嗜銀染色×200);棘層中Ki67陽性細胞數量明顯增加免疫組化染色(AEC顯色 × 400)
二、SK皮損組織中CTSL2的表達水平與酶活性
5例SK皮損CTSL2 mRNA表達水平(圖3)和酶活性(表1)低于周圍正常皮膚(P<0.05)。
三、SK皮損組織裂解物對黑素小體膜結構的影響
SK皮損裂解物處理的黑素小體破損率為32.33%±4.93%,正常皮膚為43.00%±2.65%,兩組比較,n=5,t=3.30,P< 0.05(圖4)。
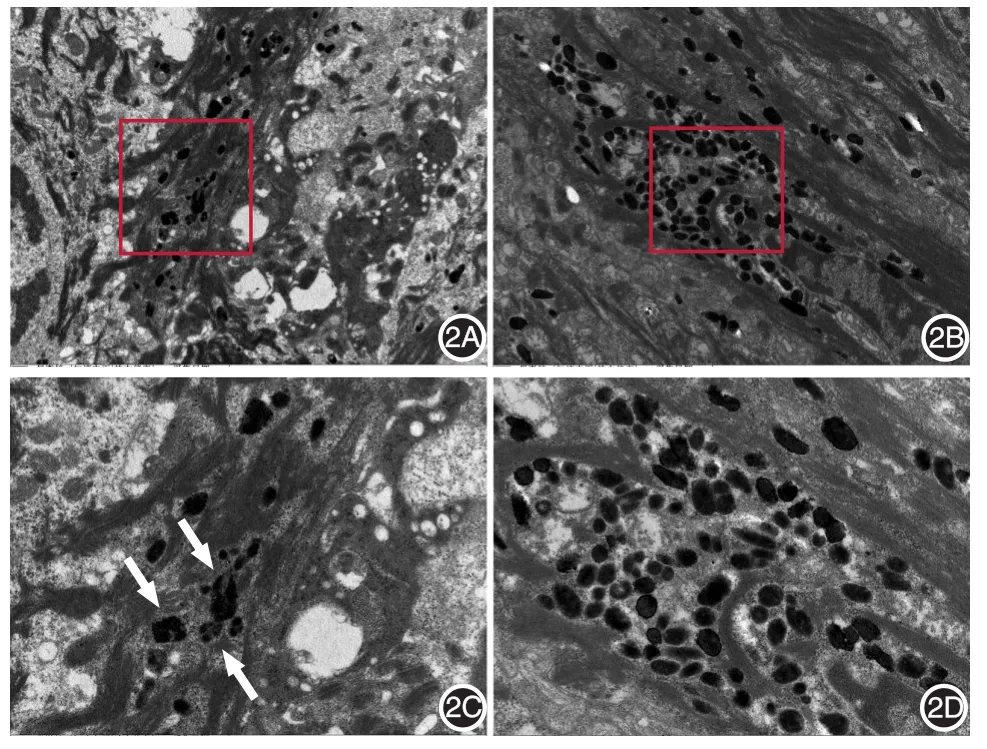
圖2 正常皮膚和脂溢性角化病(SK)皮損組織中黑素小體透射電鏡觀察(×10 000) 2A:正常皮膚組織可見破碎黑素小體(白色箭頭示);2B:SK皮損組織中可見包膜完整的黑素小體;2C、2D:分別是2A和2B圖中紅色方框區域的4.5倍放大圖像
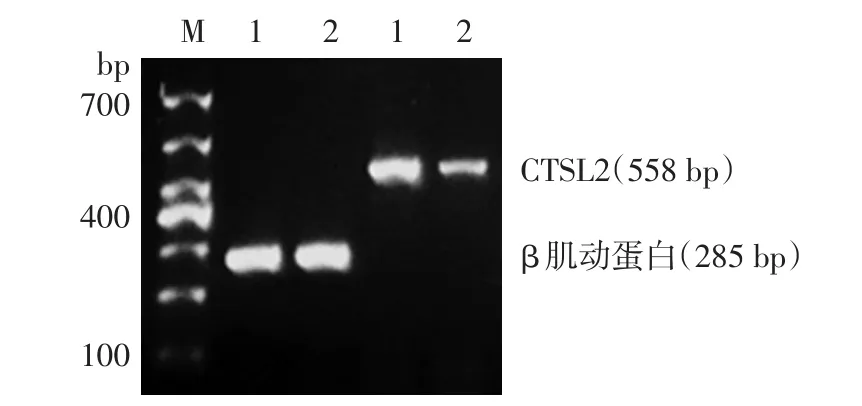
圖3 RT?PCR檢測脂溢性角化病(SK)皮損與周圍正常皮膚組織蛋白酶L2(CTSL2)mRNA表達 M:標準參照物;1:正常皮膚;2:SK皮損

圖4 透射電鏡觀察皮膚組織裂解物對人眼黑素小體影響(×9 600) 4A:單純表皮裂解物;4B:正常皮膚裂解物與黑素小體共培養,紅箭頭處為外膜損傷的黑素小體;4C:脂溢性角化病皮損組織裂解物與黑素小體共培養。Lf:脂褐素(lipofuscin)
討 論
通常攜帶癌基因突變的腫瘤細胞采用啟動細胞衰老機制來抑制惡性轉化[9?10]。而外顯子或全基因組測序技術發現,SK存在多個癌基因突變,細胞衰老啟動障礙和KC終末分化延緩[11]。本研究用免疫組化和透射電鏡技術對比分析了15例SK皮損與周圍正常皮膚組織標本,結果發現,15例SK皮損標本均可見角化過度、棘層肥厚、乳頭瘤樣增生,存在大量黑素顆粒堆積,KC內存在大量外膜結構完整的黑素小體,Ki67陽性細胞分布在SK皮損的基底層與棘層。提示SK皮損KC離開基底層進入基底淺層,不能立即啟動終末分化程序,棘層細胞依然增殖活躍。與周圍正常皮膚相比,SK表皮明顯存在黑素小體降解障礙。
為了證實CTSL2在SK皮損形成中的作用,我們對5例SK皮損CTSL2 mRNA水平以及酶活性進行了檢測,結果顯示,與周圍正常皮膚組織相比,SK皮損組織CTSL2 mRNA表達和酶催化活性均顯著減低。最后,我們將人眼純化的黑素小體樣本與SK皮損組織裂解物共同孵育,透射電鏡觀察發現,SK皮損裂解物處理黑素小體的損傷率低于正常皮膚裂解物處理黑素小體的損傷率,推測SK皮損組織中CTSL2的表達減少,可能導致KC對黑素小體降解能力下降,造成皮損中大量黑素顆粒堆積。CTSL?/?基因敲除小鼠實驗證實,CTSL表達缺陷KC對表皮生長因子(EGF)誘導的增殖反應明顯增強,提示CTSL對EGF?EGF受體結合物降解障礙,EGF通過再循環方式刺激KC發生過度增殖[4]。
綜上,我們的研究結果表明,SK皮損中CTSL2表達水平及酶活性減低影響KC對黑素小體的降解,是否直接參與SK皮損的病理發生有待進一步證實。
[1]Yoshimi N,Imai Y,Kakuno A,et al.Epithelial keratin and filaggrin expression in seborrheic keratosis:evaluation based on histopathological classification[J].Int J Dermatol,2014,53(6):707?713.doi:10.1111/j.1365?4632.2012.05828.x.
[2]Minagawa A.Dermoscopy?pathology relationship in seborrheic keratosis[J].J Dermatol,2017,44(5):518?524.doi:10.1111/1346?8138.13657.
[3]Dennem?rker J,Lohmüller T,Mayerle J,et al.Deficiency for the cysteine protease cathepsin L promotes tumor progression in mouse epidermis[J].Oncogene,2010,29(11):1611 ?1621.doi:10.1038/onc.2009.466.
[4]Reinheckel T,Hagemann S,Dollwet?Mack S,et al.The lysosomal cysteine protease cathepsin L regulates keratinocyte proliferation by control of growth factor recycling[J].J Cell Sci,2005,118(Pt 15):3387?3395.doi:10.1242/jcs.02469.
[5]Chen N,Seiberg M,Lin CB.Cathepsin L2 levels inversely correlate with skin color[J].J Invest Dermatol,2006,126(10):2345?2347.doi:10.1038/sj.jid.5700409.
[6]EbanksJP,Koshoffer A,WickettRR,et al.Epidermalkeratinocytes from lightvs.dark skin[J].J Invest Dermatol,2011,131:1226 ?1233.doi:10.1038/jid.2011.22.
[7]Ebanks JP,Koshoffer A,Wickett RR,et al.Hydrolytic enzymes of the interfollicular epidermis differ in expression and correlate with the phenotypic difference observed between light and dark skin[J].J Dermatol,2013,40(1):27 ?33.doi:10.1111/j.1346 ?8138.2012.01634.x.
[8]Rózanowski B,Cuenco J,Davies S,et al.The phototoxicity of aged human retinal melanosomes[J].Photochem Photobiol,2008,84(3):650?657.doi:10.1111/j.1751?1097.2007.00259.x.
[9]Kato S,Lippman SM,Flaherty KT,et al.The Conundrum of genetic"drivers"in benign conditions[J].J Natl Cancer Inst,2016,108(8):djw036.doi:10.1093/jnci/djw036.
[10]Heidenreich B,Denisova E,Rachakonda S,et al.Genetic alterations in seborrheic keratoses[J].Oncotarget,2017,8(22):36639?36649.doi:10.18632/oncotarget.16698.
[11]Hafner C,Toll A,Fernández?Casado A,et al.Multiple oncogenic mutations and clonal relationship in spatially distinct benign human epidermal tumors[J].Proc Natl Acad Sci U S A,2010,107(48):20780?20785.doi:10.1073/pnas.1008365107.

