乳腺癌患者CYP1B1*3基因多態性對多西他賽血液學毒性的影響
楊曉琳
山東省新泰市人民醫院藥學部,山東新泰 271200
多西他賽屬于半合成紫杉醇類抗腫瘤藥物,目前廣泛應用于一線和二線局部晚期以及復發、轉移乳腺癌的臨床治療中[1-2]。其治療指數窄,毒副作用大,無論是療效還是毒性反應,都存在較大的個體差異[3-4]。目前限制其臨床應用的主要原因為其血液學毒性,據統計臨床應用時出現Ⅳ度骨髓抑制可達到55%[5]。造成個體差異的原因是多因素的,其中很大部分是由于機體遺傳多樣性所致,目前發現 Cytochrome P4501B1(CYP1B1)的存在可使細胞對紫杉醇類藥物細胞毒性的敏感性顯著降低,增加腫瘤細胞的抗藥性,可能引起其不良反應[6]。本研究為探討乳腺癌患者CYP1B1*3基因多態性與多西他賽血液學毒性作用相關性,現報道如下。
1 資料與方法
1.1 一般資料
選取我院自2015年11月~2017年6月的77例乳腺癌患者。根據不同化療方案分為兩組:其中應用多西他賽聯合環磷酰胺的為實驗一組,多西他賽聯合表柔比星的為實驗二組。其中實驗一組36例,年齡36~75歲,平均(51.0±13.0)歲;實驗二組41例,年齡39~71歲,平均(54.0±12.0)歲。所有患者均為女性、漢族。兩組患者在一般資料上比較,差異無統計學意義(P>0.05),具有可比性。納入標準:(1)通過原位雜交熒光染色的方法檢測CYP1B1*3(C>G)基因型的患者;(2)新發乳腺癌患者,未應用過化療藥物;(3)行六周期化療;(4)患者知情且同意。排除標準:(1)乳腺癌復發入院患者;(2)用藥前血常規(白細胞、中性粒細胞)異常;(3)血液學基礎疾病史。見表1。
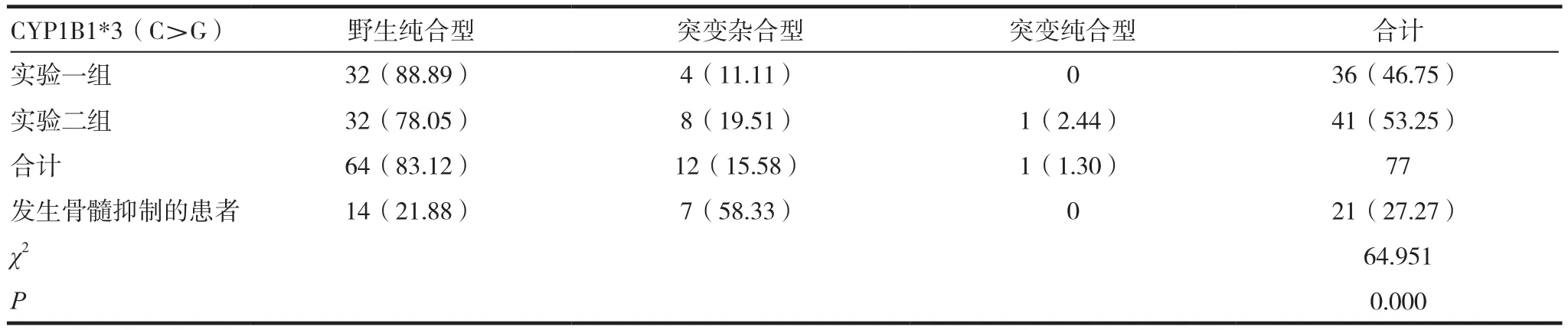
表2 77例患者基因型分布情況[n(%)]
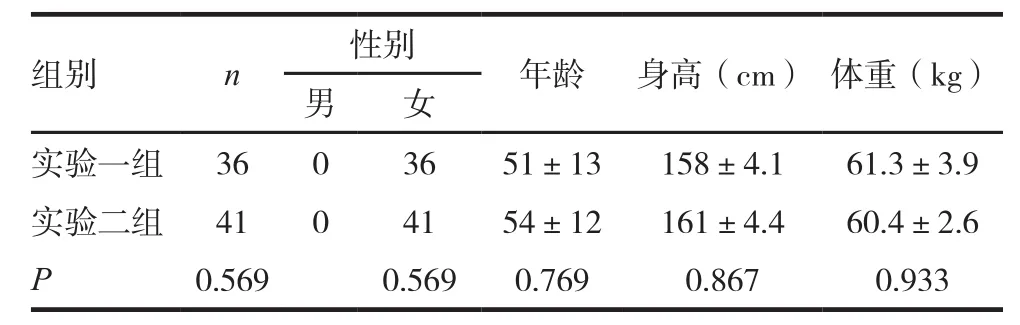
表1 兩組患者一般資料比較
1.2 方法
采用回顧性研究方法,通過醫院HIS病例瀏覽系統查閱患者病例資料,收集以下信息:(1)患者基本信息:姓名、年齡、性別、民族、身高、體重、聯系方式等;(2)多西他賽用藥信息:用藥劑量、給藥時間、溶媒等;(3)實驗室檢查:血常規、生化。然后再統計分析CYP1B1*3(C>G)野生純合、突變雜合、突變純合型對應的患者出現骨髓抑制(白細胞計數<4.0×109/L或中性粒細胞計數<2.0×109/L)的比率情況,從而探究CYP1B1*3(C>G)基因多態性與多西他賽血液學毒性作用相關性。
1.2.1 實驗一組化療方案 多西他賽注射液(艾 素,規 格:0.5mL:20mg,江 蘇 恒 瑞 制 藥,H20020543)75mg/m2dL+注射用環磷酰胺(規格:0.2g,江蘇盛迪醫藥有限公司,H32020857)0.8g,d2,q21;實驗二組化療方案為:多西他賽注射液(艾素,規格:0.5mL:20mg,江蘇恒瑞制藥,H20020543)75mg/m2dL+注射用鹽酸表柔吡星(規格:10mg,山東新時代藥業,H20123260)60mg/m2,d2,q21。用藥期間每周期至少檢測兩次血常規。
1.2.2 基因測序方法 用EDTA抗凝管取患者靜脈血2 ~ 3mL提取DNA,將提取的DNA加入相應的測序反應通用試劑盒(耀金分,北京華夏時代基因科技公司)中,然后入熒光檢測儀—分子診斷儀(L998A,西安天隆科技有限公司),檢測出患者CYP1B1*3(C>G)的基因型。
1.3 統計學處理
采用SPSS17.0統計軟件對本研究中的數據進行數據處理和統計分析。計量資料用(±s)表示,計數資料采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 患者基因頻率結果
患者CYP1B1*3基因型分布情況為:64例(83.12%)為CC野生純合型患者中發生骨髓抑制的有14例,骨髓抑制發生率為21.88%;13例(16.88%)為G等位基因攜帶者(即突變雜合型與突變純合型),發生骨髓抑制的患者有7例,骨髓抑制發生率為53.85%。不同基因型患者發生骨髓抑制的差異有統計學意義(P<0.05),見表2。
2.2 實驗結果
因考慮突變純合型患者例數較少,將突變純合型與突變雜合型歸為G等位基因攜帶者進行分析。實驗一組:CYP1B1*3:CC型32例中出現骨髓抑制8例(25.00%);GC型(G等位基因攜帶者)4例中出現骨髓抑制3例(75.00%)。
實驗二組:CYP1B1*3:CC型32例中出現骨髓抑制6例(18.75%);G等位基因攜帶者共有9例中出現骨髓抑制的有4例(44.44%)。
實驗一組CYP1B1*3 G等位基因攜帶者出現骨髓抑制的比率為75.00%高于野生純合型(CC)的25.00%,野生純合型與G等位基因攜帶者出現骨髓抑制的差異有統計學意義(P<0.05);實驗二組CYP1B1*3 G等位基因攜帶者出現骨髓抑制的比率為44.40%高于野生純合型(CC)的18.75%,野生純合型與G等位基因攜帶者出現骨髓抑制的差異也有統計學意義(P<0.05)。

表3 不同基因型發生血液毒性反應分析[n(%)]
本研究結果提示,CYP1B1*3的基因多態性與多西他賽毒性反應差異有統計學意義(P<0.05)。乳腺癌患者應用多西他賽與環磷酰胺聯合或多西他賽聯合表柔吡星的化療方案時,CYP1B1*3 G等位基因攜帶者發生血液學毒性的風險高于其他基因型。
3 討論
細 胞 色 素 P450 1B1(cytochrome P450 1B1,CYP1B1)是細胞色素P450酶之一,其催化包括多環芳香烴化合物和芳香胺等前誘變劑與前致癌物質的代謝并與多種癌癥的發生相關聯[7-8]。目前研究較多的為CYP1B1-4326C>G SNP(即CYP1B1*3),發生突變會導致其編碼CYP1B1酶蛋白功能發生改變,可能會影響某些癌癥的預后和一些抗腫瘤藥物的代謝[9-10],如多西他賽。如課題中發現CYP1B1*3 G等位基因攜帶者發生血液學毒性的風險高于其他基因型,可能與CYP1B1*3突變后表現出很強催化底物的活性,直接與多西他賽結合,影響多西他賽代謝從而增加其毒性代謝產物有關。
多西他賽是重要的抗癌藥物,其臨床藥代動力學和藥效學存在明顯的個體差異,而多西他賽的藥物基因組學研究有助于人們了解多西他賽療效個體差異的分子機制[11]。然而,過去的研究主要集中于對多西他賽臨床療效和耐藥性方面的研究,而對于安全性方面的研究相對較少[12]。隨著藥物的毒副作用近幾年來越來越成為社會、醫院、患者的關注焦點,2005年成立的國際遺傳藥理學研究網絡(PGRN)和遺傳藥理學與藥物基因組學知識庫(PharmGKB)[13-14],為藥物基因檢測的臨床應用提供了實驗室依據。通過藥物基因檢測在臨床的應用[15],可以實現遺傳藥理學和藥物基因組學的實驗研究成果轉化為實際應用的個體化治療[16],在一定程度上可以實現多西他賽的個體化治療[17],減少多西他賽的毒副作用的發生,保證患者安全用藥,值得臨床推廣。
[參考文獻]
[1] Nabholtz JM,Reese DM,Lindsay MA,et al.Docetaxel in the treatment of breast cancer:an update on recent studies[J].Semin Oncol,2002,29(3 Suppl 12):28-34.
[2] 李穎,尹良偉,劉基巍,等.多西他賽對乳腺癌細胞中Cav-1表達及細胞增殖的影響[J].大連醫科大學學報,2017,39(4):318-322.
[3] 吳萍,鄒素蘭,倪雪峰.多西他賽藥物基因組學研究進展 [J].中國臨床藥理學雜志,2015,31(24):2486-2491.
[4] ISomura M,Miki Y.Genomic based approach to individualized cancer therapy[J].Nippon Rinsho,2010,68(6):1117.
[5] 傅宏義.新編藥物大全[M].北京:中國醫藥科技出版社,2010:851-852.
[6] 朱壯彥,糜若然.卵巢癌細胞系A780紫杉醇體外化療后CYP1B1基因表達差異研究[J].中國實用婦科與產科雜志,2008,24(2):143-145.
[7] 國玉芝,荊洪英,李貴和,等.CYP1B1 SNP rs 1056836基因多態性與紫杉醇血藥濃度關系研究[J].中國醫院藥學雜志,2014,34(12):977-980.
[8] Ilaria P,Elisa G,Aldo C,et al.Cytochrome 450 1B1(CYP1B1) polymorphisms associated with response to docetaxel in Castration-Resistant Prostate Cancer (CRPC)patients[J].BMC Cancer,2010,10:511.
[9] Joanna T,Ewa G,Janina S,et al.Variant alleles of the CYP1B1 gene are associated with colorectal cancer susceptibility[J].BMC Cancer,2010,10:420.
[10] Sissung TM,Danesi R,Price DK,et al.Association of the CYP1B1*3 allele with survival in patients with prostate cancer receiving docetaxel[J].Mol Cancer Ther,2008,7(1):19-26.
[11] Zhou Quan,Yu LS,Zeng Su.Personalized dosing from perspective of pharmacogenomics of drug metabolizing enzymes and transporters[J].Acta Pharmaceutica Sinica,2017,52(1):1-7.
[12] 吳萍,鄒素蘭,倪雪峰.多西他賽藥物基因組學研究進展 [J].中國臨床藥理學雜志,2015,31(24):2486-2491.
[13] Giacomini KM,Brett CM,Altman RB,et al.The pharmacogenetics research network:from SNP discovery to clinical drug response[J].Clin Pharmacol Ther,2007,81:328-345.
[14] Thorn CF,Klein TE,Altman RB.PharmGKB:the pharmacogenetics and pharmacogenomics knowledge base[J].Methods Mol Biol,2005,311:179-191.
[15] 周宏灝,劉潔.抗腫瘤藥物的基因導向性個體化治療 [J].腫瘤藥學,2011,1(1):6-11.
[16] 張偉,周宏灝.藥物基因組學和個體化醫學的轉化研究進展 [J].藥學學報,2011,46(1):1-5.
[17] 陳泉金,謝小云,宋洪濤.多西他賽個體化用藥研究進展 [J].解放軍藥學學報,2015,31(5):439-442.

