增生型糖尿病視網膜病變患眼玻璃體、增生膜組織miR-195表達及意義
張小露,高永峰
(1平頂山市第二人民醫院,河南平頂山467002;2河南省眼科研究所 河南省立眼科醫院)
增生型糖尿病視網膜病變患眼玻璃體、增生膜組織miR-195表達及意義
張小露1,高永峰2
(1平頂山市第二人民醫院,河南平頂山467002;2河南省眼科研究所 河南省立眼科醫院)
目的 探討miR-195在增生型糖尿病視網膜病變(PDR)發生、發展中的作用及機制。方法 選取PDR患者56例(觀察組)、特發性黃斑裂孔患者30例(對照組),均為單側發病。兩組均接受常規玻璃體切割術,觀察組術中采集玻璃體及視網膜前增生膜組織,對照組采集玻璃體及內界膜組織。采用實時熒光定量PCR法檢測兩組玻璃體和膜組織miR-195和高遷移率族蛋白B1(HMGB1)mRNA相對表達量,Western blotting法檢測兩組膜組織HMGB1蛋白相對表達量,并分析觀察組玻璃體、膜組織中miR-195與HMGB1 mRNA相對表達量的關系。結果 觀察組玻璃體及膜組織miR-195相對表達量均低于對照組,HMGB1 mRNA相對表達量均高于對照組(P均<0.01)。觀察組膜組織HMGB1蛋白相對表達量為0.94±0.11,對照組為0.58±0.09,兩組比較P<0.05。觀察組玻璃體及膜組織中miR-195與HMGB1 mRNA相對表達量均呈負相關(r分別為-0.369、-0.508,P均<0.05)。結論 PDR患眼玻璃體及增生膜組織中miR-195表達均降低,其可能通過負性調控HMGB1表達而參與PDR的發生、發展。
增生型糖尿病視網膜病變;玻璃體;增生膜組織;微小RNA-195;高遷移率族蛋白B1
增生型糖尿病視網膜病變(PDR)是2型糖尿病患者常見的一種微血管并發癥,是導致患者視力喪失甚至失明的重要原因[1],目前其發病機制尚不完全清楚。微小RNA(microRNA,以下稱miRNA)為廣泛存在于生物體內的高度保守短小RNA,在細胞增殖、 分化、 凋亡、 免疫反應、腫瘤發生等多種生理、病理過程中發揮重要作用[2]。研究發現,某些miRNAs參與了糖尿病視網膜病變的發生與發展[3],其中miR-195可通過抑制血管內皮生長因子(VEGF)表達而減少腫瘤組織中微血管的生成[4,5]。本研究觀察了PDR患眼玻璃體及視網膜前增生膜組織中miR-195的表達變化,并探討其在PDR發生、發展中的作用機制。
1 資料與方法
1.1 臨床資料 選取2015年5月~2016年5月于平頂山市第二人民醫院眼科擇期行玻璃體切割術的PDR患者56例(均為單側發病,觀察組),男35例、女21例,年齡42~71(54.6±9.5)歲,糖尿病病程5~20(11.8±4.1)年;合并其他疾病情況:糖尿病腎病15例,大血管病變7例;根據中華醫學會眼科學分會制定的分期標準[6]:Ⅴ期34眼、Ⅵ期22眼。納入標準:①2型糖尿病所致PDR;②反復出現玻璃體積血,未經藥物治療或經藥物治療效果不佳,B超檢查示視網膜前機化膜形成和(或)出現牽拉性視網膜脫離;③未出現明顯玻璃體積血,但B超、檢眼鏡或光相干斷層掃描檢查示眼底出現增生膜和(或)出現牽拉性視網膜脫離。排除標準:①空腹血糖>8 mmol/L或合并嚴重高血壓者;②有玻璃體視網膜或其他眼部手術史者;③接受抗新生血管藥物治療者;④其他因素所致視網膜增生、視網膜血管性疾病者;⑤合并惡性腫瘤、免疫系統疾病及急慢性感染者。同期選擇擇期行玻璃體切割術的特發性黃斑裂孔患者30例(均為單側發病,對照組),男16例、女14例,年齡40~72(55.6±9.8)歲,排除合并其他眼部疾病、惡性腫瘤、免疫系統疾病及急慢性感染者。兩組性別、年齡具有可比性。本研究通過醫院倫理委員會審核,患者均簽署知情同意書。
1.2 玻璃體和膜組織miR-195、高遷移率族蛋白B1(HMGB1)mRNA表達檢測 采用實時熒光定量PCR法。患者均接受常規玻璃體切割術,于灌注前使用玻璃體切割頭,抽取玻璃體0.6 mL,置于微量離心管中;同時術中留取觀察組視網膜前增生膜和對照組內界膜組織,-80 ℃保存備用。取兩組玻璃體或膜組織,加入細胞裂解液進行裂解,TRIzol總RNA提取試劑盒提取細胞總RNA,紫外分光光度計檢測純度,以A260/A280≥1.80視為合格樣品。采用逆轉錄試劑盒(德國Qiagen公司)將總RNA逆轉錄為cDNA,以cDNA為模板,采用PCR試劑盒(美國Invitmgen公司)進行PCR反應。miR-195、HMGB1及內參引物均由上海生工生物工程股份有限公司設計合成。miR-195引物:上游引物:5′-GCACGGTAGCAGCACAGAAA-3′,下游引物:5′-CACTTCCTCAGCACTTGTTGGTAT-3′,引物長度126 bp。 內參U6引物:上游引物:5′-ATTGGAACGATACAGAGAAGATT-3′,下游引物:5′-GGAACGCTTCACGAATTTA-3′, 引物長度318 bp。HMGB1引物:上游引物:5′-GAGCATAAGAAGAAGCACCCAGAT-3′,下游引物:5′-GGGCGATACTCAGAGCAGAAG-3′,引物長度399 bp。內參β-actin引物:上游引物:5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物:5′-GACTCATCGTACTCCTGCTTGCTG-3′,引物長度317 bp。PCR反應條件:94 ℃、1 min;92 ℃、30 s,58 ℃、30 s,75 ℃、30 s,共40個循環。每個樣本設置3個平行反應復孔,采用2-ΔΔCt法計算兩組玻璃體和膜組織miR-195、HMGB1 mRNA相對表達量。
1.3 膜組織HMGB1蛋白表達檢測 采用Western blotting法。取兩組患眼膜組織,研磨后加入細胞裂解液進行裂解,蛋白提取試劑盒提取總蛋白,采用BCA法對蛋白純度進行檢測。取20 μg蛋白樣品,沸水中煮5 min使蛋白變性,進行SDS-PAGE凝膠電泳,電轉移至PVDF膜。封閉液封閉過夜,加入一抗兔抗鼠HMGB1多克隆抗體(1∶2 000),室溫孵育120 min,TBST清洗3次;加入二抗室溫孵育60 min,TBST清洗3次。采用ECL發光試劑盒發光顯影,凝膠圖像處理系統LabWork 4.0軟件對條帶灰度值進行分析。以目的蛋白條帶灰度值與內參蛋白β-actin條帶灰度值的比值計算HMGB1蛋白相對表達量。

2 結果
2.1 兩組玻璃體miR-195、HMGB1 mRNA表達比較 觀察組玻璃體miR-195相對表達量低于對照組,HMGB1 mRNA相對表達量高于對照組(P均<0.01)。見表1。
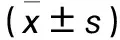
表1 兩組玻璃體miR-195、HMGB1 mRNA相對表達量比較
注:與對照組比較,*P<0.01。
2.2 兩組膜組織miR-195、HMGB1 mRNA表達比較 觀察組膜組織miR-195相對表達量低于對照組,HMGB1 mRNA相對表達量高于對照組(P均<0.01)。見表2。
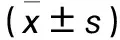
表2 兩組膜組織miR-195、HMGB1 mRNA相對表達量比較
注:與對照組比較,*P<0.01。
2.3 兩組膜組織HMGB1蛋白表達比較 觀察組膜組織HMGB1蛋白相對表達量為0.94±0.11,對照組為0.58±0.09,兩組比較P<0.05。
2.4 miR-195與HMGB1 mRNA表達的關系 觀察組玻璃體和膜組織中miR-195與HMGB1 mRNA相對表達量均呈負相關(r分別為-0.369、-0.508,P均<0.05)。 3 討論
PDR發生機制較為復雜,可能與體內炎癥反應、自由基生成、糖基化終末產物堆積、二酰甘油-蛋白激酶C系統活化等多種病理過程有關[7,8]。糖尿病視網膜病變患者血清VEGF水平顯著升高,且與病變嚴重程度有關[9]。而miR-195與腫瘤組織中微血管生成有關[10],且可抑制VEGF表達[11]。因此,推測miR-195表達變化可能與糖尿病視網膜病變有關。本研究顯示,觀察組玻璃體及視網膜前膜組織miR-195相對表達量均明顯低于對照組,說明PDR患眼玻璃體和視網膜前增生膜組織中miR-195表達降低,可能與PDR的發生有關。
HMGB1作為維持核小體結構及調節基因轉錄的非染色體核蛋白,是一種新型的促炎細胞因子,在多種炎癥性疾病及自身免疫性疾病的發生中發揮重要作用[12]。研究發現,炎癥反應在糖尿病視網膜病變微血管損傷中發揮重要作用,且參與糖尿病視網膜病變的發生及發展過程[13];釋放到細胞外的HMGB1可觸發炎癥反應,并誘導血管新生[14];HMGB1可通過升高VEGF表達而促進缺血組織中的血管新生[15]。因此推測,HMGB1可能參與了PDR的炎癥反應及血管生成。本研究觀察組玻璃體及膜組織HMGB1 mRNA相對表達量均高于對照組,膜組織HMGB1蛋白相對表達量亦高于對照組,說明HMGB1表達降低與PDR的發生有關。有研究指出,HMGB1是miR-195潛在的靶基因[16]。本研究觀察組玻璃體和膜組織中miR-195與HMGB1 mRNA相對表達量均呈負相關。由此推測,miR-195可能通過負性調控HMGB1的表達而促進炎癥反應及血管生成,從而參與PDR的發生與發展。
綜上所述,PDR患眼玻璃體和增生膜組織中miR-195表達降低,其可能通過負性調控HMGB1表達而參與PDR的發生、發展,但具體作用機制尚需進一步研究明確。
[1] Guan G, Zang J. Meta-analysis of the effect of perioperative injection of Lucentis on intraoperative bleeding in patients with proliferative diabetic retinopathy[J]. Eye Sci, 2015,30(4):171-175.
[2] Gurol T, Zhou W, Deng Q. MicroRNAs in neutrophils: potential next generation therapeutics for inflammatory ailments[J]. Immunol Rev, 2016,273(1):29-47.
[3] 吳心池,唐偉.微小RNA與糖尿病視網膜病變相關性的研究進展[J].中國糖尿病雜志,2016,24(7):662-664.
[4] 褚陽,張玉瑤,王旭,等.microRNA-195的研究進展[J].國際遺傳學雜志,2015,38(4):209-213.
[5] Wang R, Zhao N, Li S, et al. MicroRNA-195 suppresses angiogenesis and metastasis of hepatocellular carcinoma by inhibiting the expression of VEGF, VAV2, and CDC42[J]. Hepatology, 2013,58(2):642-653.[6] 中華醫學會眼科學分會眼底病學組.糖尿病視網膜病變分期標準[J].眼底病,1985,1(1):42.
[7] Luo D, Zheng Z, Xu X, et al. Systematic review of various laser intervention strategies for proliferative diabetic retinopathy[J]. Expert Rev Med Devices, 2015,12(1):83-91.
[8] Sharma N, Ooi JL, Ong J, et al. The use of fenofibrate in the management of patients with diabetic retinopathy: an evidence-based review[J]. Aust Fam Physician, 2015,44(6):367-370.
[9] Amato R, Biagioni M, Cammalleri M, et al. VEGF as a survival factor in Ex Vivo models of early diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2016,57(7):3066-3076.
[10] Li Z, Wang H, Wang Z, et al. MiR-195 inhibits the proliferation of human cervical cancer cells by directly targeting cyclin D1[J]. Tumour Biol, 2016,37(5):6457-6463.
[11] Wang R, Zhao N, Li S, et al. MicroRNA-195 suppresses angiogenesis and metastasis of hepatocellular carcinoma by inhibiting the expression of VEGF, VAV2, and CDC42[J]. Hepatology, 2013,58(2):642-653.
[12] 李留成,高建,李俊.HMGB1在呼吸系統疾病中的作用及其機制[J].中國藥理學通報,2015,31(1):15-18.
[13] 邢立臣,張雷鳴,豐亞麗,等.血清中內皮細胞生長因子、白細胞介素-1及腫瘤壞死因子-α水平與老年糖尿病視網膜病變的關系[J].中國老年學雜志,2016,36(12):2991-2992.
[14] 李世朋,何金丹,于瑤,等.缺血再灌注誘導小鼠肝細胞釋放高遷移率族蛋白B1對P38 MAPK信號通路的影響[J].中華肝膽外科雜志,2016,22(4):273-276.
[15] Zhou LY, Shi LY, Xiao Y. Changes of HMGB1 expression on angiogenesis of ovarian cancer and its mechanism[J]. J Biol Regul Homeost Agents, 2016,30(1):233-238.
[16] 秦時月,殷麗,姚勇,等.糖尿病視網膜病變患者血清中微小RNA-195表達結果檢測[J].中華眼底病雜志,2015,31(2):134-138.
河南省科技發展計劃項目(142102310429)。
10.3969/j.issn.1002-266X.2017.16.025
R774.1
B
1002-266X(2017)16-0074-03
2016-10-17)

