補腎活血舒筋方含藥血清對大鼠骨髓間充質干細胞增殖、遷移的影響及其機制
王彥超,鄧蓉蓉,葉亞東,席志鵬,康然,謝林
(1南京中醫藥大學,南京210023;2南京中醫藥大學附屬中西醫結合醫院;3泰州市中醫院)
補腎活血舒筋方含藥血清對大鼠骨髓間充質干細胞增殖、遷移的影響及其機制
王彥超1,2,鄧蓉蓉2,葉亞東3,席志鵬2,康然2,謝林2
(1南京中醫藥大學,南京210023;2南京中醫藥大學附屬中西醫結合醫院;3泰州市中醫院)
目的 探討補腎活血舒筋方含藥血清對大鼠骨髓間充質干細胞(BMSCs)增殖、遷移的影響及其可能的作用機制。方法 采用全骨髓貼壁法分離提取大鼠BMSCs并進行驗證。制備補腎活血舒筋方低、中、高濃度含藥血清(1.1、2.2、4.4 g/mL)及空白血清,將大鼠BMSCs隨機分為含藥血清低、中、高濃度組和空白對照組,分別加入上述血清。采用CCK-8法檢測各組增殖能力(以細胞生存率表示),Transwell小室試驗檢測細胞遷移能力(以細胞遷移數量表示),Western blotting法檢測趨化因子受體4(CXCR4)和NF-κB信號通路p65蛋白表達。結果 各組間細胞生存率比較差異無統計學意義(P>0.05)。含藥血清高、中濃度組細胞遷移數量均高于含藥血清低濃度組、空白對照組,且含藥血清高濃度組高于含藥血清中濃度組(P均<0.05)。含藥血清高、中、低濃度組與空白對照組p65、CXCR4蛋白表達依次降低,組間兩兩比較P均<0.05。結論 2.2、4.4 g/mL補腎活血舒筋方含藥血清可促進BMSCs遷移,但對BMSCs增殖無影響;激活NF-κB信號通路可能是其作用機制。
骨髓間充質干細胞;補腎活血舒筋方;細胞遷移;核轉錄因子κB;趨化因子受體4;大鼠
間充質干細胞(MSC)來源于發育早期的中胚層和外胚層,具有多向分化潛能、自我復制、靶向歸巢和損傷修復等特點。研究證實,基質細胞衍生因子1(SDF-1)等趨化因子具有調控MSC歸巢的作用,其與趨化因子受體4(CXCR4)結合形成的SDF-1/CXCR4軸是促進MSC向損傷組織歸巢的重要生物軸[1],同時該軸調控細胞歸巢的作用受NF-κB信號通路的調節[2]。補腎活血舒筋方對于脊柱退行性變有一定療效[3,4],且能夠調節CXCR4表達[5],促進骨髓間充質干細胞(BMSCs)遷移[6]。前期研究顯示,補腎活血舒筋方可通過調節NF-κB信號通路抑制炎癥反應及椎間盤退變[7]。本研究觀察了補腎活血舒筋方含藥血清對大鼠BMSCs增殖、遷移的影響,現分析結果并探討其相關機制。
1 材料與方法
1.1 材料 實驗動物: 4周齡SD大鼠24只,SPF級,均為雌性,平均體質量80 g,由南京中醫藥大學附屬中西醫結合醫院動物中心提供。主要試劑:MEM培養基、胎牛血清購于美國Gibco公司,兔抗大鼠NF-κB(p65)、CXCR4抗體/羊抗兔遠紅外二抗購于美國Abcam公司。主要儀器:流式細胞儀購于美國Millipore公司,多功能酶標儀購于瑞士Tecan公司,ODYSSEY雙色紅外熒光掃描成像系統購于美國LICOR公司。
1.2 大鼠BMSCs提取與鑒定 取4周齡SD大鼠4只,分離雙側股骨和脛骨,采用全骨髓貼壁法[8]提取BMSCs:將細胞放置于完全培養基(含有10%胎牛血清、1%青霉素-鏈霉素溶液的MEM培養基)中,于5% CO2、37 ℃培養箱中進行培養,每3天換液1次。待細胞在T25培養瓶中生長融合至80%~90%時,以1∶3進行傳代,傳至第3代時倒置顯微鏡觀察細胞形態及生長情況。結果顯示,第3~5代細胞純化程度高,細胞增殖能力強;傳代后的細胞呈紡錘形或梭形,細胞數目多、排列緊密時可呈漩渦狀。取第3代細胞,采用流式細胞儀檢測其表面抗體CD29、CD34、CD45、CD90表達,結果顯示其陽性率分別為91.77%、85.40%、0.22%、2.20%,證實該細胞為BMSCs。
1.3 補腎活血舒筋方含藥血清制備 補腎活血舒筋方中藥組成參照謝林等[3]的研究,取其方藥以純凈水煎煮,將藥液過濾、濃縮,調配至1.1、2.2、4.4 g/mL(以生藥量計算),分別記為低、中、高濃度。將20只SD大鼠隨機分為四組,每組5只,分別以1.1、2.2、4.4 g/mL藥液及純凈水灌胃,劑量為2 mL。連續灌胃14天后采血,血樣靜置2 h后3 000 r/min離心20 min,取上清。
1.4 含藥血清對大鼠BMSCs增殖、遷移能力影響的觀察
1.4.1 細胞培養及干預 取生長狀態良好的第3代BMSCs,用含10%胎牛血清的MEM培養基制成細胞懸液,以5×103個/孔接種于96孔板。將細胞分為含藥血清低、中、高濃度組及空白對照組,每組設3個復孔。培養24 h后更換為MEM培養基繼續培養24 h。含藥血清低、中、高濃度組每孔分別加入低、中、高濃度含藥血清10 μL,空白對照組加入等量空白血清。
1.4.2 細胞增殖能力 采用CCK-8法。取各組干預后細胞,5% CO2、37 ℃培養箱中培養24 h,每孔加入CCK-8溶液10 μL后繼續孵育4 h。采用酶標儀在460 nm波長處測定光密度(OD)值,用不含細胞的完全培養基做空白對照,計算細胞生存率。細胞生存率=(實驗孔OD值-空白孔OD值)/(對照孔OD值-空白孔OD值)×100%。實驗重復3次。
1.4.3 細胞遷移能力 采用Transwell小室試驗。取處理48 h的各組細胞,消化后進行計數,調整細胞密度為1×106個/mL,懸于含2%胎牛血清的MEM培養基中。將Transwell裝置置于培養箱中平衡30 min,上室接種1×105個細胞(體積為100 μL),下室為含100 ng/mL SDF-1α、2%胎牛血清的MEM培養基(體積為500 μL),置于CO2培養箱中12 h。棄去培養液,PBS清洗后4%中性甲醛固定15 min;結晶紫染色15 min,棄染色液, PBS清洗2次。用棉簽小心擦掉上室上側細胞,再用小刀取下小室的聚碳酯膜,于倒置相差顯微鏡下對Transwell上室下側細胞進行計數,即細胞遷移數量。
1.5 NF-κB信號通路p65蛋白、CXCR4蛋白表達檢測 采用Western blotting法。取生長良好的第3代BMSCs,消化處理后以1×105個/孔接種于6孔板,予MEM培養基饑餓處理8 h,使其生長同步化。參照1.4.1的方法進行分組處理48 h后收集細胞。加入含蛋白酶抑制劑的RIPA裂解液,收集并提取細胞總蛋白。采用BCA法測定各組蛋白質濃度,使用含蛋白酶抑制劑的RIPA裂解液調整至統一的蛋白質濃度,以每道10 μL蛋白上樣。80 V電壓電泳10 min,觀察到溴酚蘭進入分離膠后,電壓改為120 V,繼續電泳80 min。使用甲醇化的硝酸纖維素(PVDF)膜在350 mA電流下轉膜120 min,5%脫脂牛奶封閉。分別加入兔抗大鼠p65、CXCR4蛋白抗體,置于水平搖床4 ℃孵育過夜。用TBST對PVDF膜漂洗3次,每次10 min,加入二抗IgG(羊抗兔紅外二抗),室溫避光孵育1 h;再用TBST對PVDF膜漂洗3次,每次10 min。使用ODYSSEY雙色紅外熒光掃描成像系統對目的條帶進行掃描,并采用Image-Pro Plus6.0軟件分析灰度值,以GAPDH作為內參。目的蛋白相對表達量=目的蛋白條帶灰度值/GAPDH條帶灰度值。

2 結果
2.1 各組細胞生存率比較 含藥血清高、中、低濃度組與空白對照組細胞生存率分別為(99.80±1.23)%、(102.92±1.49)%、(102.65±1.43)%、(101.71±0.91)%,多組間比較P>0.05。
2.2 各組細胞遷移數量比較 含藥血清高、中、低濃度組與空白對照組細胞遷移數量分別為(95.00±1.78)、(69.75±1.89)、(17.25±0.95)、(16.50±0.65)個,含藥血清高、中濃度組均高于含藥血清低濃度組、空白對照組,且含藥血清高濃度組高于含藥血清中濃度組(P均<0.05);空白對照組與含藥血清低濃度組比較差異無統計學意義(P>0.05)。
2.3 各組p65、CXCR4蛋白表達比較 各組p65、CXCR4蛋白相對表達量比較P<0.05,組間兩兩比較P均<0.05。見表1。
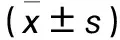
表1 各組p65、CXCR4蛋白相對表達量
3 討論
2009年Krap等[9]建議將MSC歸巢定義為:MSC在目標組織的脈管系統里被捕獲,隨后跨越血管內皮細胞遷移至目標組織的過程。對于歸巢機制,尤其是干細胞的動員,目前仍無法準確闡述,大部分研究文獻基于白細胞遷移、人類干細胞以及轉移腫瘤細胞研究干細胞的遷移行為,針對各種細胞表面受體及細胞因子進行探索。SDF-1又稱CXCL12,是趨化因子家族中的CXC亞族。CXCR4是目前研究最多的SDF-1受體,可同時在多種細胞表面表達,包括血液細胞、造血干細胞(HSCs)、胚胎干細胞(ES)[10]。研究表明,趨化因子家族及其受體不但能介導白細胞遷移,同時在MSC歸巢中也發揮著重要作用,其中SDF-1/CXCR4軸的主要功能之一就是調節前體細胞的趨化及歸巢至受傷部位[11]。
當組織受到損傷時,局部SDF-1表達上調,營造出一個SDF-1高濃度環境,隨著距離的增加,SDF-1濃度梯度遞減,而趨化表達CXCR4的MSC沿著這個濃度梯度到達組織損傷部位,參與組織的修復與重建。亦有學者認為,SDF-1α/CXCR4趨化信號軸是進化上高度保守的介導干細胞遷移、分布的關鍵信號[12],在MSCs募集和定向遷移中發揮關鍵性作用。Pereira等[13]將SDF-1注射入髓核中,發現MSCs能夠穿越軟骨終板,向髓核遷移。CXCR4是決定MSCs歸巢能力的主要效應分子,其表達水平將直接影響MSCs的遷移能力。Wei等[14]研究發現,過表達CXCR4的BMSCs向SDF-1的遷移能力增強,其在椎間盤組織存活時間更久,對椎間盤組織的再生和修復能力更強。SDF-1/CXCR4信號軸可激活多重信號通道,包括MAPK p42/44、Jak/STAT和PI3K-AKT-NF-κB信號通道[15]。NF-κB是細胞內最重要的核轉錄因子,在許多細胞刺激介導細胞信息的轉錄調控中起核心作用,參與調節炎癥反應,是細胞激活的標志,參與正常細胞和腫瘤細胞的生長和增殖[16]。NF-κB可通過調節SDF-1/CXCR4信號軸參與細胞的遷移、侵襲等過程,CXCR4表達是NF-κB和CXCR4基因啟動子通過調節p50/p65結合位點來實現的[15]。
研究發現,部分中藥對干細胞歸巢具有一定的調節作用[17,18],尤其是補腎活血類中藥,不但能夠調節CXCR4表達[5],還能促進BMSCs的遷移[6]。前期研究顯示,補腎活血舒筋方可以通過調節NF-κB信號通路,抑制椎間盤的退變[7]。本研究各組間細胞生存率比較差異無統計學意義,而含藥血清高、中濃度組細胞遷移數量均高于含藥血清低濃度組、空白對照組,說明補腎活血舒筋方對BMSCs增殖無明顯影響,但中、高濃度時可促進其遷移。考慮補腎活血舒筋方影響細胞遷移時存在一定的藥物濃度閾值,需要達到一定的藥物濃度,細胞才可能被動員,發生遷移。本研究結果顯示,補腎活血舒筋方含藥血清可促進p65、CXCR4蛋白表達,并呈濃度依賴性;說明補腎活血舒筋方可能通過NF-κB信號通路調節CXCR4蛋白表達,進而促進BMSCs遷移。
綜上所述,2.2、4.4 g/mL補腎活血舒筋方含藥血清可促進BMSCs遷移,但對BMSCs增殖無影響;激活NF-κB信號通路可能是其作用機制。
[1] Kitaori T, Ito H, Schwarz EM, et al. Stromal cell-derived factor 1/CXCR4 signaling is critical for the recruitment of mesenchymal stem cells to the fracture site during skeletal repair in a mouse model[J]. Arthritis Rheum, 2009,60(3):813-823.
[2] Penzo M, Habiel DM, Ramadass M, et al. Cell migration to CXCL12 requires simultaneous IKKα and IKKβ-dependent NF-κB signaling[J]. Biochim Biophys Acta, 2014,1843(9):1796-1804.
[3] 謝林,王昆,康然,等.補腎活血舒筋方治療頸椎病62例療效觀察[J].云南中醫中藥雜志,2008,29(8):10.
[4] 陳艦艦,周臨東,謝林,等.補腎活血舒筋方治療椎間盤源性頸痛臨床療效觀察[J].黑龍江中醫藥,2012,41(5):9-10.
[5] 臧文華,李冰冰,唐德才,等.補氣活血藥對急性心肌梗死模型大鼠梗死心肌邊緣區域SDF-1, CXCR4蛋白及mRNA表達的影響[J].世界科學技術:中醫藥現代化,2014,16(6):1377-1383.
[6] 張金生,張寶霞.三論活血化瘀治法理論—“干細胞循環理論”與“活血化瘀治法理論”研究相關性[J].中國實驗方劑學雜志,2012,18(2):248-251.
[7] 謝林,王明緒,施杞.基于“肝主筋”組方治療頸型頸椎病臨床療效觀察[J].甘肅中醫,2011,24(6):54-55.
[8] Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Haematol, 1976,4(5):267-274.
[9] Karp JM, Leng Teo GS. Mesenchymal stem cell homing:the devil is in the detaiIs[J]. Cell Stem Cell, 2009,4(3):206-216.
[10] Moll NM, Ransohoff RM. CXCL12 and CXCR4 in bone marrow physiology[J]. Expert Rev Hematol, 2010,3(3):315-322.
[11] Ghadge SK, Mühlstedt S, ?zcelik C, et al. SDF-1αas a therapeutic stem cell homing factor in myocardial infarction[J]. Pharmacol Ther, 2011,129(1):97-108.
[12] 孟晨,吳小濤.SDF-1/CXCR4信號軸在調節干細胞遷移及發育中的作用[J].東南大學學報(醫學版),2011,30(4):625-629.
[13] Pereira CL, Gon?alves RM, Peroglio M, et al. The effect of hyaluronan-based delivery of stromal cell-derived factor-1 on the recruitment of MSCs in degenerating intervertebral discs[J]. Biomaterials, 2014,35(28):8144-8153.
[14] Wei JN, Cai F, Wang F, et al. Transplantation of CXCR4 overexpressed mesenchymal stem cells augments regeneration in degenerated intervertebral discs[J]. DNA Cell Biol, 2016,35(5):241-248.
[15] Helbig G, Christopherson KW, Bhat-Nakshatri P, et al. NF-kappa B promotes breast cancer cell migration and metastasis by inducing the expression of the chemokine receptorCXCR4[J]. J Biol Chem, 2003,278(24):21631-21638.
[16] Hayden MS, Ghosh S. Shared principles in NF-kappa B signaling[J]. Cell, 2008,132(3):344-362.
[17] 歐陽長生,王云開,蘇海,等.丹參及血府逐瘀湯含藥血清與兔骨髓間充質干細胞的體外遷移:促進還是抑制[J].中國組織工程研究與臨床康復,2009,13(40):7847-7851.
[18] 戴儒麗,閆福曼,周樂全,等.川芎嗪對大鼠骨髓間充質干細胞SDF-1表達的影響[J].中藥藥理與臨床,2012,27(5):29-31.
江蘇省自然科學基金資助項目(BK20151064)。
謝林(E-mail: xielin117@126.com)
10.3969/j.issn.1002-266X.2017.16.011
R329
A
1002-266X(2017)16-0038-03
2016-10-15)

