神經肽Y對海馬神經元“癲癇樣”動作電位的影響
董長征董秀芳孔艷莉陳堯趙磊李哲趙文清李文玲
神經肽Y對海馬神經元“癲癇樣”動作電位的影響
董長征*董秀芳△孔艷莉*陳堯*趙磊*李哲*趙文清*李文玲*
【摘要】目的 探討神經肽Y(neuropeptide Y,NPY)對海馬神經元“癲癇樣”動作電位的影響。方法 用無鎂細胞外液處理原代培養12 d的海馬神經元3 h,誘導海馬神經元癲癇樣放電,建立海馬神經元癲癇樣放電模型;用全細胞膜片鉗電流鉗模式檢測神經元動作電位,分別給予0.1 μmol/L和1 μmol/L NPY各1 μL,給藥時間 10 s,觀察其對神經元動作電位頻率及波幅的影響。結果 無鎂細胞外液處理神經元3 h,可以形成穩定的海馬神經元癲癇樣放電模型,頻率16~23 Hz,波幅75~96 mV。模型組神經元動作電位頻率為(18.00±2.32)Hz,而0.1 μmol/L和1 μmol/L NPY組分別為(4.75±1.04)Hz和(1.50±0.75)Hz。與模型組相比較,兩種濃度NPY組均降低了動作電位發放的頻率 (P<0.05)。模型組神經元動作電位波幅為 (82.25±5.17)mV, 而0.1 μmol/L和1μmol/L NPY組分別為(49.75±2.49)mV和(40.00±2.20)mV。與模型組相比較,兩種濃度NPY組均降低了動作電位發放的波幅(P<0.05)。兩種濃度NPY之間相比較,也有統計學差異(P<0.05)。1 μmol/L NPY明顯抑制了動作電位發放的頻率和波幅。結論 NPY能夠抑制無鎂細胞外液誘發的神經元癲癇樣電活動,為應用NPY抑制癲癇發作提供了細胞電生理學證據。
【關鍵詞】神經肽Y 癲癇 神經元 動作電位 全細胞膜片鉗記錄
神經肽Y(neuropeptide,NPY),全名神經肽酪氨酸,由36個氨基酸組成的多肽。Tatemoto等[1]于1982年首先在豬腦中提取。作為廣泛分布于中樞神經系統的神經遞質,NPY被認為具有抗癲癇發作的作用。前期動物實驗已證實利用腺相關病毒載體將NPY基因轉移至腦內,通過基因轉染的方法可以減輕紅藻氨酸致癇大鼠的發作程度[2]。神經元動作電位是指神經元受到外界刺激時在靜息電位的基礎上產生的可擴布的電位變化過程,反映了機體神經元的興奮性,與癲癇發病的生理機制密切相關。目前為止,NPY抑制癲癇發作的細胞分子學機制仍不十分清楚。本研究以原代培養的大鼠海馬神經元癲癇樣放電模型為基礎,研究NPY對海馬神經元癲癇動作電位的影響,探討NPY抑制癲癇發作的細胞分子學機制。
1 材料與方法
1.1 研究對象 新生24 h Wistar大鼠15只,由英國利茲大學生物系實驗動物中心提供。主要試劑和儀器:Neurobasal TM,胎牛血清(FBS),胰蛋白酶(Trypsin),L-多聚賴氨酸,N-2-羥乙基哌嗪-N′-2-乙磺酸均購自GIBCO公司,氯化鎂(MgC12·6H2O)分析純 (Fisher Scientific,UK),膜片鉗放大器(Axon patch 200B,USA),模/數轉換器 (Digidata 1320A 16-bit Aequisition System, USA),灌流控制系統BPS-8(Axon, USA), 倒置顯微鏡Olympus CK2(Olympus,Japan)。
1.2 海馬神經元原代培養 在解剖顯微鏡輔助下,分離新生24 h Wistar大鼠雙側海馬組織,根據參考文獻[3]的方法,進行原代神經元培養,細胞數調整為2×105cells/mL,然后將細胞接種于細胞培養皿,在CO2培養箱中進行培養。自第6 d起,用加入10 μmol/L阿糖胞苷(Ara-C)抑制膠質細胞生長。培養12 d的細胞用于后續膜片鉗試驗。
1.3 神經元癲癇樣放電模型的建立 將培養12 d的海馬神經元,用無鎂(Mg2+free)細胞外液處理3 h,用于后續膜片鉗試驗。采用EPC-10膜片鉗系統進行全細胞模式的電流鉗記錄神經元的動作電位,若出現自發的穩定的癲癇樣異常放電形式,說明造模成功。正常細胞外液組成成分:NaCl 147 mmol/L,HEPES 10 mmol/L,Glucose 13 mmol/L,KCl 2 mmol/L,CaCl22 mmol/L,MgCl22 mmol/L;用5 mmol/L NaOH調節 pH至 7.3,調整滲透壓為280~320 mOsm/L。無鎂細胞外液組成成分:NaCl 147 mmol/L,HEPES 10 mmol/L,Glucose 13 mmol/L,KC1 2 mmol/L,CaCl22 mmol/L;用5 mmol/L NaOH調節pH至7.3,調整滲透壓為280~320 mOsm/L。培養的神經元被分為3組:模型組(Mg2+free組),NPY(0.1 μmol/L)干預組,NPY(1 μmol/L)干預組。模型組只用無鎂細胞外液處理3 h;NPY(0.1 μmol/L)干預組, 在神經元癲癇樣放電模型建立成功后,給予0.1 μmol/L NPY;NPY(1 μmol/L)干預組,在神經元癲癇樣放電模型建立成功后,給予1 μmol/L NPY。
1.4 全細胞膜片鉗模式記錄海馬神經元動作電位
1.4.1 記錄動作電位的電極內液 記錄動作電位的電極內液組成成分:KCl 147 mmol/L,MgC122 mmol/L,HEPES 10 mmol/L,EGTA 1 mmol/L;用3 mmmol/L KOH調節pH至7.3,調整滲透壓為280~320 mOsm/L。實驗前用孔徑0.22 μm的一次性針頭濾器過濾滅菌。
1.4.2 全細胞膜片鉗記錄模式 選擇美國WPI公司生產的電導率高且噪聲低的有芯膜片鉗玻璃管,用PP-830型電極拉制儀(Electrode Puller)分兩步法拉制而成,入液的電阻值為6~8 MΩ。在微操縱器輔助下,將微電極吸附在神經元細胞膜上,形成高阻封接后,負壓破膜,形成細胞內液與電極內液相通的全細胞記錄模式。實驗在室溫(23℃~25℃)條件下進行。
1.4.3 電流鉗模式下記錄海馬神經元的動作電位
設定參數:記錄模式為C-Clamp,Gain 2 mv/PA,C-fast 7.86 pF, C-Slow 50.00 pF, Amplitude 5.0 mV,length 5.0 ms,Imembrane 0 pA。先檢測無鎂細胞外液處理后神經元的動作電位,通過灌流給藥系統分別給予0.1 μmol/L和1 μmol/L NPY干預10 s, 然后再次記錄神經元動作電位的頻率和波幅,實驗數據由pClamp 9.0軟件采樣系統獲得,直接進入Clamfit 9.0軟件數據處理系統進行測量、分析、作圖。
1.5 統計學分析 采用SAS 8.0進行分析。實驗數據采用均數±標準差±s)表示,采用方差分析及q檢驗,α=0.05。
2 結果
2.1 原代培養大鼠海馬神經元的形態學 體外培養神經元第12 d的海馬神經元在倒置顯微鏡下觀察可見:細胞周圍有光暈,胞體略突出飽滿、折光性良好,細胞突起長而相互連接,彼此間廣泛突觸聯系形成(圖1)。選取形態一致的多角形,胞體飽滿,周圍帶光暈發育良好神經元用于后續膜片鉗試驗。
2.2 海馬神經元無鎂細胞外液處理前后動作電位的變化 在全細胞電流鉗記錄模式下操作,體外培養正常海馬神經元可見自發性興奮性突觸后電位,偶有動作電位發放,見圖2;無鎂細胞外液處理神經元3 h后,可檢測到頻發的動作電位發放,頻率16~23Hz,波幅75~96m V,見圖3。
2.3 NPY對海馬癲癇樣神經元動作電位的影響全細胞電流鉗記錄結果顯示:模型組神經元動作電位頻率為(18.00±2.32)Hz,而0.1μmol/L和1μmol/L NPY組分別為(4.75±1.04)Hz和(1.50± 0.75)Hz,與模型組相比較,兩種濃度NPY組均降低了動作電位發放的頻率(q分別為 3.98、4.25,P<0.05)。模型組神經元動作電位波幅為(82.25 ±5.17)mV,而0.1 μmol/L和1 μmol/L NPY組分別為(49.75±2.49)mV和(40.00±2.20)mV,與模型組相比較,兩種濃度NPY組均降低了動作電位發放的波幅 (q分別為3.45、3.86,P<0.05)。0.1 μmol/L NPY給藥后動作電位的頻率和幅度降低的程度小于1 μmol/L NPY組神經元,統計學分析有統計學差異(q分別為3.52、3.41,P<0.05)。結果見圖4、5,表1。
表1 各組海馬神經元動作電位頻率和波幅(±s)

表1 各組海馬神經元動作電位頻率和波幅(±s)
1)與模型組相比,經q檢驗,P<0.052)與NPY 0.1 μmol/L組相比,經q檢驗,P<0.05
組別模型組NPY 0.1 μmol/L組NPY 1 μmol/L組n888頻率(Hz)18.00±2.32 4.75±1.041)1.50±0.751),2)波幅(mV)82.25±5.17 49.75±2.491)40.00±2.201),2)
3 討論
文獻報道去除細胞外的 Mg2+[4]或通過用印防己苦毒素(picrotoxin)封閉GABA受體[5]從而誘發出神經元急性發作間期放電 (Interictal bursting)。Mg2+在維持中樞神經系統正常電生理活動和神經元的興奮性具有重要作用,它能夠阻滯鈣離子細胞內流,減少細胞損傷;還能拮抗如谷氨酸、天冬氨酸等興奮性氨基酸的作用,抑制細胞去極化;Mg2+還參與Na+-K+-ATP酶的形成,維護細胞膜的穩定性而阻止癲癇的發作。因此,移除細胞生存環境的Mg2+,可以誘發神經元的高興奮性狀態,模擬神經元異常放電。Sombati等研究提示無鎂誘發的神經元出現自發性反復性發放的動作電位與臨床癲癇發作時的電生理活動極為類似,抗癲癇藥物如苯妥英鈉能抑制這類動作電位的發生[6]。本研究根據上述鎂離子的生理特性,移除細胞外液鎂離子來模擬“癲癇微環境”,誘導原代培養海馬神經元癲癇樣放電。結果顯示經無鎂細胞外液處理3 h后,神經元都出現頻發的高波幅動作電位發放,證實了此癲癇神經元放電模型的可靠性,適合用于膜片鉗電生理檢測。
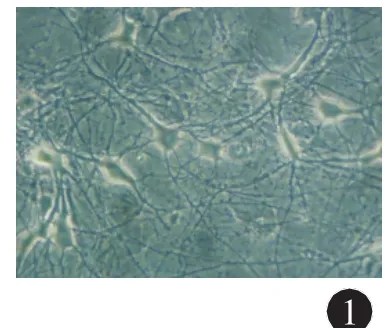
圖1 培養12 d海馬神經元(×400),bar=30 μm
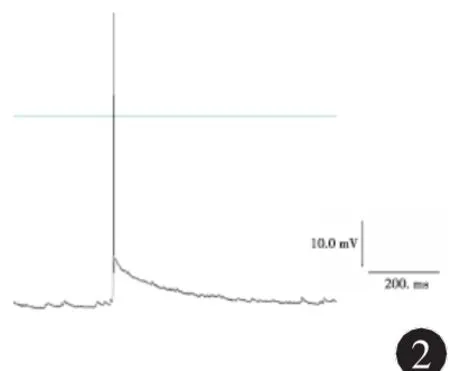
圖2 正常海馬神經元動作電位
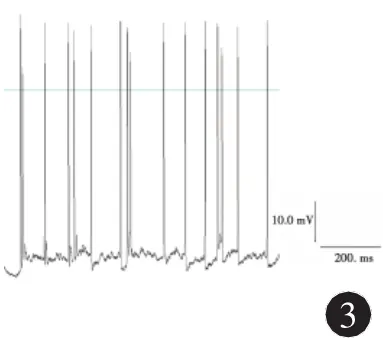
圖3 無鎂細胞外液處理3 h后海馬神經元的動作電位
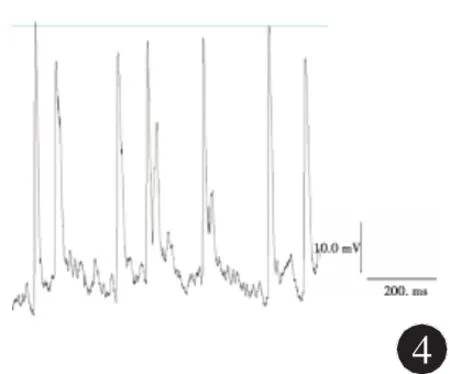
圖4 0.1 μmol/L NPY給藥后海馬神經元動作電位
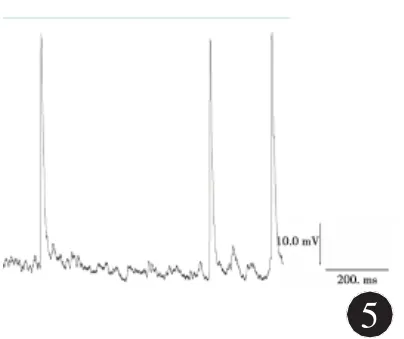
圖5 1 μmol/L NPY給藥后海馬神經元動作電位
良好的神經元活性是神經電生理實驗的前提基礎。我們采用原代培養12d的海馬神經元進行電生理研究,因為此時培養的海馬神經元貼壁后形成許多突起,彼此之間形成復雜的神經網絡,表明培養的海馬神經元在體外仍能形成廣泛的突觸聯系,具備突觸間生物信息傳遞的形態學基礎,能很好模擬在體神經元的生理狀態,為神經元細胞分子水平的研究提高良好基礎。
在體癲癇模型證實NPY具有較確切的抗驚厥作用。大鼠海馬組織中GABA受體被印防己苦毒素(picrotoxin)阻斷后,將NPY注射入被印防己苦毒素誘發的大鼠模型腦海馬CA1區可以抑制動物癲癇發作[7]。在紅藻氨酸(KA)誘發癲癇模型中將NPY注入到側腦室能有效抑制運動性癲癇的發作,并能夠大幅度縮短在海馬齒狀回和CA3區記錄到的由紅藻酸誘發的發作期癲癇異常腦電[8]。癲癇的本質是大腦神經元的異常超同步化放電,那么,NPY能否對對海馬神經元癲癇樣放電產生抑制作用,是本研究的關鍵所在。2011年Stjepana Kovac報道:1滋mol/L NPY可以降低大鼠海馬腦片雙脈沖刺激引起神經元癲癇樣放電的波幅和頻率,而對鼠腦額葉皮層放電無影響[9]。上述研究應用腦片作為觀察對象,而對培養海馬神經元的影響并未涉及。本實驗以培養的海馬神經元作為研究對象,同樣選擇1滋mol/LNPY進行研究,為了進一步了解不同濃度NPY對實驗的影響,選擇0.1滋mol/L NPY進行對照。試驗結果顯示:兩種濃度的NPY均能夠抑制癲癇樣海馬神經元的動作電位發放,與給藥前相比能夠降低其動作電位的頻率和幅度,發揮抑制神經元異常放電的作用。并且,NPY抑制作用還具有濃度依賴性,在一定范圍內,濃度越高抑制作用越強。本實驗1滋mol/L NPY對無鎂誘發的高波幅動作電位的抑制率要比0.1滋mol/L NPY要高,頻率降低也更多,但是在目前濃度下并沒有徹底抑制住動作電位的發放。可能與給藥的濃度和持續時間均有關系。實驗不足之處在于僅僅觀察了兩種濃度NPY對神經元放電的影響,NPY的有效作用范圍有待進一步確定細化。總之,本研究初步結果從細胞電生理水平證實了NPY具有抑制海馬神經元癲癇樣放電的特性,為臨床應用NPY進行抗癲癇治療提供了更多的實驗證據。
致謝:衷心感謝英國利茲大學江林華教授對本課題在膜片鉗記錄方面給予的技術指導。
參考文獻
[1]Tatemoto K.Neuropeptide Y:complete amino acid sequence of the brain peptide[J].Proc Natl Acad Sci USA,1982,79(18):5485-5489.
[2] 董長征,趙文清,李文玲,等.重組腺相關病毒介導人源性神經肽Y基因轉染對紅藻氨酸致癇大鼠行為及腦電圖的影響[J].第三軍醫大學學報,2010,32(19):2140-2142.
[3]Deshpande LS,Nagarkatti N,Ziobro JM,et al.Carisbamate prevents the development and expression of spontaneous recurrent epileptiform discharges and is neuroprotective in cultured hippocampal neurons[J].Epilepsia,2008,49(10):1795-1802.
[4]Bijak M.Inhibitory effect of neuropeptide y on epileptiform activity in the frontal cortex and hippocampus in vitro[J].Pol J Pharmacol,1995,47(5):461-463.
[5]Klapstein GJ,Colmers WF.Neuropeptide Y suppresses epileptiform activity in rat hippocampus in vitro[J].J Neurophysiol,1997,78(3):1651-1661.
[6]Carter DS,Deshpande LS,Rafiq A,et al.Characterization of spontaneous recurrent epileptiform discharges in hippocampalentorhinal cortical slices prepared from chronic epileptic animals[J].Seizure,2011,20(3):218-224.
[7]S?rensen AT,Kanter-Schlifke I,Lin EJ,et al.Activity-dependent volume transmission by transgene NPY attenuates glutamate release and LTP in the subiculum [J].Mol Cell Neurosci,2008,39(2):229-237.
[8]Kuruba R,Hattiangady B,Parihar VK,et al.Differential susceptibility of interneurons expressing neuropeptide Y or parvalbumin in the aged hippocampus to acute seizure activity[J].PLoS One,2011,6(9):e24493.
[9]Kovac S,Megalogeni M,Walker M.In vitro effects of neuropeptide Y in rat neocortical and hippocampal tissue [J].Neurosci Lett,2011,492(1):43-46.
(責任編輯:甘章平)
* 河北省人民醫院功能神經外科(石家莊 050051)
△ 邢臺市第一醫院神經內科
【中圖分類號】R742.1
【文獻標識碼】A
收稿日期:(2012-05-26)
doi:10.3969/j.issn.1002-0152.2012.08.006
通訊作者(E-mail:liwelling@163.com)
The expression of neuropeptide Y on action potential in hippocampal epileptic neurons.
DONGChangzheng,DONG Xiufang,KONG Yanli,CHEN Yao,ZHAO Lei,LI Zhe,ZHAO Wenqing,LIN Wenling.Department of Functional Neurosurgery,Hebei General Hospital,No.348 Heping West Road,Shijiazhuang 050051,China.Tel:0311-85989935.
【Abstract】Objective To investigate the effects of NPY on action potential of the hippocampal epileptic neurons in rats.Methods E12 rat primary hippocampal neurons were exposed to magnesium-free solution for 3 h to establish the model of"epileptic neuron.Whole cell current clamp was used to detect action potentials of the hippocampal epileptic neurons.The frequency and amplitude of neuronal action potential were recorded following treatment with 0.1 μM and 1 μM NPY for 10 s.Results A stable model of epileptiform discharges at frequency 16~23 Hz and amplitude 75~96 mV was successfully created by exposure of the hippocampal neurons to magnesium-free extracellular fluid for 3 h.The frequency of action potential was 18.00±2.32 Hz in the model group,4.75±1.04 Hz in the 0.1μmol/L NPY group and 1.50±0.75 Hz in the 1μmol/L NPY group, respectively.Compared with the model group,the frequency of action potential was significantly decreased in both NPY groups(P<0.05).The amplitude of action potential in the model group was 82.25±5.17 mV in the model group, 49.75±2.49 mV in the 0.1 μmol/L NPY group and 40.00±2.20 mV in the 1 μmol/L NPY group,respectively.Compared with the model group,the amplitude of action potential was significantly decreased in both NPY groups(P<0.05).The inhibitory effects on the frequency and amplitude of action potential were more pronounced in 1 μmol/L NPY group than in 0.1 μmol/L NPY group(P<0.05).Conclusion NPY can inhibit neuronal epileptiform activity induced by magnesium-free extracellular solution,which provides evidence of cell electrophysiology for NPY application in treatment of seizures.
【Key words】Neuropeptide Y Epilepsy Neuron Action Potential Whole cell patch clamp recording
- 中國神經精神疾病雜志的其它文章
- 偏頭痛患者伴發焦慮/抑郁及功能殘疾的臨床研究☆
- [20]右下肢麻木、無力20余年,左下肢麻木、無力8年,排尿困難2年(上)Numb and weakness in the right lower extremity for twenty years,numb and weakness in the left lower extremity for eight years,dysuria for two years
- 多巴胺D3受體基因Ser9Gly多態性與阿立哌唑及利培酮治療效應的關聯研究☆
- 急性應激大鼠中樞色氨酸羥化酶-2表達變化☆
- 腦結核瘤的診斷及治療(附17例報告)☆
- 抑郁癥血清神經元特異性烯醇化酶和髓鞘堿性蛋白水平的研究☆

