雌激素對實驗性自身免疫性腦脊髓炎小鼠的抗炎機制☆
胡曉 朱加應黃偉琨萬興王建怡
實驗性自身免疫性腦脊髓炎(experimental autoimmune encephalomyelitis,EAE)是一種以特異性致敏的CD4+T細胞介導為主的,中樞神經系統(central nervous system,CNS)內小血管周圍出現單個核細胞浸潤及髓鞘脫失為特征的自身免疫性疾病,是國際公認的人類多發性硬化(multiple sclerosis,MS)的動物模型。與其他多種自身免疫性疾病一樣,MS存在著性別差異,表現為女性發病率較高與于男性相比,女性發病率較高,且初發時間也較早。在女性MS患者妊娠末期,疾病的嚴重程度明顯減輕,復發時間延長,復發次數明顯減少;但是在產后,伴隨著雌激素水平的下降,疾病的復發次數增多、癥狀又逐漸加劇,提示體內高水平雌激素對女性MS患者具有保護作用[1]。雌激素是由芳香化酶催化雄激素轉化而來,臨床研究表明口服雌激素具有免疫調節效果,可以減少復發-緩解型MS患者釓增強病灶的數量和大小,進一步提示雌激素有可能作為治療MS的藥物靶點[2-3]。研究發現雌激素及雌激素受體α配體能夠影響細胞因子腫瘤壞死因子α(tumor necrosis factor α,TNF-α)、干擾素 γ(interferon γ,IFN-γ)、基質金屬蛋白酶-9和白細胞介素(interleukin,IL)-6 等的分泌減輕 MS 或EAE 的發病[4-5]。本實驗構建了C57BL/6小鼠EAE模型,予雌二醇治療,觀察其是否通過糾正Th1/Th2型細胞因子的失衡,抑制IL-23/IL-17軸等作用治療EAE。
1 對象與方法
1.1 研究對象 雌性C57BL/6小鼠60只,4~8周齡,體質量15~20 g,購自重慶醫科大學實驗動物中心,合格證號:SCXK(渝)2007-000341。
1.2 方法
1.2.1 去卵巢手術及EAE動物模型的制備 將雌性C57BL/6小鼠60只行輸卵管結扎及卵巢摘除,術后2周制備EAE模型。用0.01 mol/L的PBS將MOG35-55(西安美聯多肽合成有限公司)稀釋成300 μg/mL,與等量的完全弗氏佐劑(美國Sigma公司)(卡介苗(中國藥品生物制品檢定所饋贈)的終濃度為10 mg/mL)混合,用玻璃注射器抽打至油包水狀態的抗原乳劑。按0.2 mL/只分別于背部、頸部、腋窩、蹊部四點皮下注射[6],制作EAE模型。將去卵巢的EAE小鼠分為治療組和對照組各30只。自免疫第10 d起至免疫后30 d,治療組予1.2 mg/(kg·d)戊酸雌二醇(補佳樂)(中國先靈公司)生理鹽水懸濁液灌胃給藥,對照組予同等量的生理鹽水灌胃處理。
1.2.2 臨床癥狀評分標準 免疫當日及免疫后所有動物每日稱重并進行神經功能評分,EAE模型評分采用較為通用的5分評分法,1分:動物尾部無力;2分:后肢無力;3分:后肢癱瘓;4分:前肢癱瘓;5分:瀕死狀態或死亡[7]。
1.2.3 標本采集 兩組EAE小鼠于免疫后16 d(急性期)、23 d(緩解期)和30 d(慢性期)分3批取腦組織和脊髓,每批10只,除一部分用于H-E染色,余脊髓組織即刻用于抽提RNA,腦組織用無菌生理鹽水沖洗后置液氮中速凍,轉移至-80℃冰箱備用。
1.2.4 H-E染色 取急性期、緩解期、慢性期EAE小鼠各5只的脊髓和腦組織用4%多聚甲醛固定24 h,石蠟包埋,制成厚度5 μm的切片,用常規方法行H-E染色。根據文獻報道對炎癥反應程度進行評分:0分,無炎癥細胞浸潤;1分,炎癥細胞僅浸潤在腦表面,即蛛網膜下腔內;2分,輕度炎癥細胞腦實質浸潤;3分,中度炎癥細胞腦實質浸潤;4分,重度和彌漫性腦實質見炎癥細胞浸潤[8]。
1.2.5 實時熒光定量 PCR 檢測 IL-17、IL-23、TNF-α、IFN-γ、IL-4 mRNA的表達水平 取兩組EAE小鼠急性期、緩解期、慢性期脊髓組織,即刻用Trizol(美國Invitrogen公司)提取每個樣本的總RNA,BioRT逆轉錄擴增試劑盒(美國BioFlux公司)逆轉錄合成cDNA,根據SYBR Master Mixture試劑盒(大連TaKaRa公司)的產品說明書進行實時定量PCR檢測。β-actin作為內參,引物由上海生物工程服務有限公司設計并合成。引物序列分別為:IL-23上游5'-ACATGCACCAGCGGGA CATA-3',下游 5'-CTTTGAAGATGTCAGAGTCAAGCAG-3';IL-17上游5'-ACGCG CAAACATGAGTCCAG-3',下游 5'-AGGCTCAGCAGCAGCAACA G-3';TNF-α 上游 5'-GCCACAAGCAGGAATGAGAAG-3',下游 5'-GCCACAAGCAGGAATGAGAAG-3';IFN-γ 上游 5'-TTTGCAGCTCTTCCTCAT-3',下 游 5'-TGCCAGTTCCTCCAGATA-3';IL-4上游5'-TCTCGAATGTACCAGGAGCCATATC-3',下游 5'-AGCACCTTGG AAGCCCTACAGA-3';β-actin 上游 5'-GTGGACATCCGCAAAGA C-3',下游5'-AAAGGGTGTAACGCAACTA-3'。擴增條件為:95℃預變性30 s;95℃變性10 s,58℃退火15 s,72℃延伸10 s,45個循環;72℃延伸10 min。同時設RT質控和PCR擴增兩個空白對照。根據目的基因與內參基因的Ct差值,得到兩組標本的 IL-17、IL-23、TNF-α、IFN-γ、IL-4相對表達量。
1.2.6 ELISA 方法檢測腦組織中 IL-17、IL-23、TNF-α、IFN-γ、IL-4的濃度 兩組EAE小鼠于免疫后急性期、緩解期、慢性期分3批取腦組織,取部分腦組織,冰上PBS沖洗,濾紙吸干,以生理鹽水配成10%腦組織勻漿,勻漿液5 000 r/min,離心半徑r=10 cm,低溫離心10 min,取上清液,用小鼠 IL-17、IL-23、TNF-α、IFN-γ、IL-4 ELISA試劑盒(美國 R&D公司),雙抗體夾心ELISA 方法檢測 IL-17、IL-23、TNF-α、IFN-γ、IL-4 濃度,具體方法按ELISA試劑盒說明書操作。
2 結果
2.1 臨床癥狀評分比較 30只對照組EAE小鼠免疫12 d后開始逐漸發病,表現為活動減少、食欲減退、體重減輕、尾部及四肢無力。發病高峰為14~18 d,高峰過后,EAE小鼠的體重逐漸恢復,癥狀有所緩解。按照評分標準,大于1分為發病,對照組共28只發病,發病率達93.33%以上,平均喪失最大體質量為(2.966±1.082)g。30只治療組EAE小鼠免疫14 d后開始逐漸發病,共8只發病,發病率為26.7%,平均喪失最大體重為(0.943±0.488)g。兩組臨床癥狀評分(圖1A)、發病率、體質量變化(圖1B)差異有統計學意義(P <0.05)。
2.2 H-E染色 H-E染色見對照組EAE小鼠急性期腦和脊髓有明顯的炎性細胞浸潤,以淋巴細胞為主(圖2 A)。在緩解期時,炎癥細胞的浸潤也比較明顯,但比急性期有所減輕(圖2 B)。慢性期炎癥細胞浸潤進一步減輕(圖2 C)。治療組各期EAE小鼠CNS內炎癥細胞的浸潤明顯減少(圖2 D~F),與對照組比較差異有統計學意義(P<0.05)(圖2 G)。
2.3 EAE 小鼠脊髓中 IL-17、IL-23、TNF-α、IFN-γ、IL-4 mRNA表達量 對照組EAE小鼠發病高峰過后,體重逐漸恢復,隨著癥狀的緩解,脊髓中IL-17、IL-23、TNF-α、IFN-γ mRNA表達量逐漸減低,IL-4逐漸增加。如表1所示,治療組EAE小鼠發病急性期和緩解期脊髓中 IL-17、IL-23、TNF-α、IFN-γ mRNA 表達量及其在腦組織中濃度與對照組相比降低(P<0.05),IL-4增加(P<0.05),治療組各指標在慢性期與對照組相比無統計學差異(P>0.05)。
2.4 EAE 小鼠腦組織中 IL-17、IL-23、TNF-α、IFN-γ、IL-4濃度測定 對照組EAE小鼠發病高峰過后,體重逐漸恢復,隨著癥狀的緩解,腦組織中 IL-17、IL-23、TNF-α、IFN-γ濃度逐漸減低,IL-4逐漸增加。表2所示,治療組 EAE 小鼠腦組織中 IL-17、IL-23、TNF-α、IFN-γ濃度與對照組相比降低(P<0.05),IL-4增加(P<0.05)。

圖1 各組EAE小鼠臨床癥狀評分及體重變化曲線。與對照組相比,**P<0.001,n=10
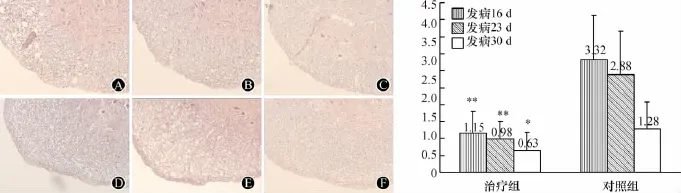
圖2 H-E染色觀察炎癥細胞浸潤情況。A:急性期對照組EAE小鼠;B:緩解期對照組EAE小鼠;C:慢性期對照組EAE小鼠;D:急性期治療組EAE小鼠;E:緩解期治療組EAE小鼠;F:慢性期治療組EAE小鼠;G:各組EAE小鼠炎細胞浸潤的統計學分析,與對照組相比 *P<0.05,**P <0.001,n=5,放大倍數:200×
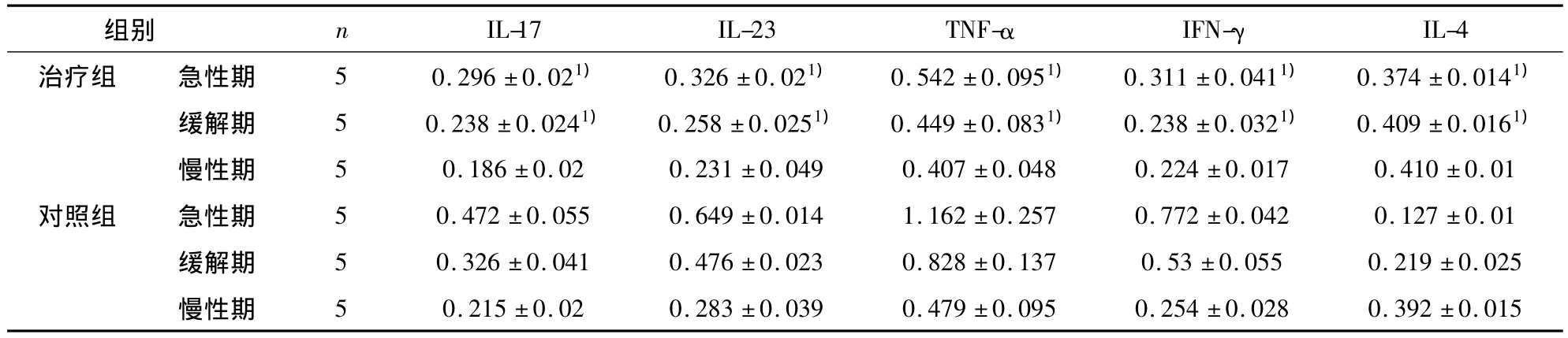
表1 實時定量PCR
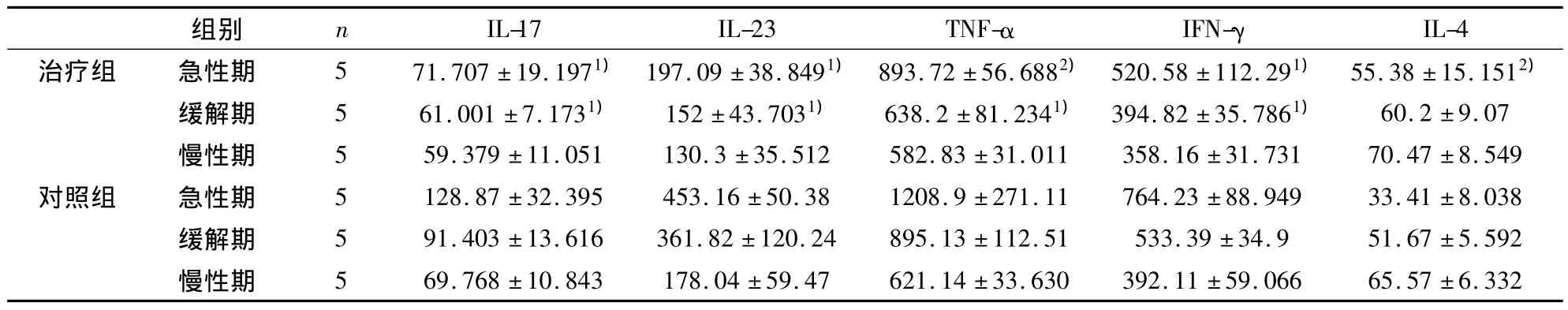
表2 ELISA結果
3 討論
MS是一種CNS炎性脫髓鞘性自身免疫疾病,細胞因子在其發病機制中起重要作用。研究發現EAE主要是由CD+4 Th1細胞介導的。CD+4細胞分為Th1和Th2兩個亞型。Th1型細胞因子如IL-2、IL-12、IFN-γ、TNF-α等,能促進炎癥的發生,激活巨噬細胞,對脫髓鞘的產生起著極為重要的作用[9-10];Th2型細胞因子如IL-4、IL-5和IL-10等可以通過下調內皮細胞和巨噬細胞的應急狀態參與炎癥修復,抑制Th1型細胞因子。因此,Th1/Th2平衡是機體行使防御、自身穩定和免疫監視的重要機制。大量研究表明MS患者中存在Th1/Th2 型細胞因子的失衡[11-12],糾正這一失衡已成為治療MS的新策略之一[13]。近年來對于EAE發病機制的研究還提示IL-23/IL-17軸是導致MS和EAE的另外一個重要機制。IL-23能夠誘導Th0細胞向高度致炎性的Th17細胞分化,產生IL-17、IL-17F、IL-6及TNF-α[14]。IL-17是 Th17 細胞的主要效應因子,是一種高度致炎性細胞因子,能啟動和刺激炎性細胞產生多種炎性細胞因子如 IL-1、IL-6、TNF-α、一氧化氮合酶、金屬蛋白酶等[15]。進一步的證據還表明EAE嚴重程度與血清中IL-17的水平相關[16]。本文的實驗結果顯示EAE小鼠在慢性期與急性期和緩解期相比,其CNS 中的致炎性因子 TNF-α,IFN-γ,IL-23,IL-17 含量降低、抗炎性細胞因子IL-4的含量增加,表明細胞因子的表達水平與EAE的發病進程密切相關,同時也暗示著糾正Th1/Th2型細胞因子的失衡以及IL-23/IL-17軸異常或許可以影響EAE病情的發生和發展。
雌激素對CNS發揮著重要的調節和保護作用,可影響學習記憶和認知功能,降低老年性癡呆的發病率[17],減輕腦損傷后腦細胞死亡的程度,提高腦損傷后的恢復能力。EAE鼠的發病情況、癥狀嚴重程度與雌激素水平也有一定關系[18]。本實驗用雌二醇治療EAE小鼠,發現經治療后的EAE小鼠的發病率、癥狀評分、體重變化、發病日期4項臨床指標與對照組相比明顯減輕或延遲,表明雌二醇可以顯著改善EAE小鼠的病情,提示雌激素能夠抑制EAE的炎癥反應。我們進一步實時定量PCR和ELISA等實驗方法對比兩組EAE 小鼠的 CNS 中所含有的 TNF-α、IFN-γ、IL-23、IL-17和IL-4的水平,發現雌二醇可以降低Th1型細胞因子TNF-α、IFN-γ,并增加Th2型細胞因子IL-4的表達。這一結果暗示雌激素可能是通過糾正Th1/Th2型細胞因子的失衡,并影響Th0細胞向Th1細胞及Th2細胞的分化來緩解EAE小鼠的炎癥反應。除此以外,我們的實驗還顯示雌二醇的治療可以降低炎性細胞因子IL-23和IL-17的表達,提示對于IL-23/IL-17軸的抑制是雌激素發揮抗炎作用的又一重要機制。
綜上,雌激素可抑制EAE的發病,其免疫抑制機制并不是單一的,而是多因素多途徑共同導致的。本實驗應用雌二醇治療EAE,發現其能改善EAE小鼠的臨床表現,進一步的機制性研究則暗示這一保護作用可能是通過糾正Th1/Th2細胞因子的失衡、抑制IL-23/IL-17軸實現的。
[1]Niino M,Hirotani M,Fukazawa T,et al.Estrogens as potential therapeutic agents in multiple sclerosis[J].Cent Nerv Syst A-gents Med Chem,2009,9(2):87-94.
[2]Sicotte NL,Liva SM,Klutch R,et al.Treatment of multiple sclerosis with the pregnancy hormone estriol[J].Ann Neurol,2002,52(4):421-428.
[3]Soldan SS,Alvarez Retuerto AI,Sicotte NL,et al.Immune modulation in multiple sclerosis patients treated with the pregnancy hormone estriol[J].J Immunol,2003,171(11):6267 -6274.
[4]Morales LB,Loo KK,Liu HB,et al.Treatment with an estrogen receptor alpha ligand is neuroprotective in experimental autoimmune encephalomyelitis[J].J Neurosci,2006,26(25):6823-6833.
[5]Gold SM,Sasidhar MV,Morales LB,et al.Estrogen treatment decreases matrix metalloproteinase(MMP)-9 in autoimmune demyelinating disease through estrogen receptor alpha(Erα)[J].Lab Invest,2009,89(10):1076 -1083.
[6]胡曉,袁軍,萬興,等.實驗性自身免疫性腦脊髓炎小鼠模型的建立及其病理學和影像學表現[J].貴陽醫學院學報,2009,34:78-83.
[7]Legge KL,Min B,Bell JJ,et al.Coupling of Peripheral Tolerance to Endogenous Interleukin 10 Promotes Effective Modulation of Myelin-Activated T Cells and Ameliorates Experimental Allergic Encephalomyelitis[J].Experimental Medicine,2000,191(12):2039-2052.
[8]王順和.脫髓鞘病變中軸突損傷的實驗研究[J].第三軍醫大學學報,2008(30):386-389.
[9]Murphy AC,Lalor SJ,Lynch MA,et al.Infiltration of Th1 and Th17 cells and activation of microglia in the CNS during the course of experimental autoimmune encephalomyelitis[J].Brain Behav Immun,2010,24(4):641-651.
[10]Lees JR,Iwakura Y,Russell JH.Host T cells are the main producers of IL-17 within the central nervous system during initiation of experimental autoimmune encephalomyelitis induced by adoptive transfer of Th1 cell lines[J].J Immunol,2008,180:8066 -8072.
[11]Suryani S,Sutton I.An interferon-gamma-producing Th1 subset is the major source of IL-17 in experimental autoimmune encephalitis[J].J Neuroimmunol,2007,183(1 -2):96 -103.
[12]McGeachy MJ,Anderton SM.cytokines in the induction and resolution of experimental autoimmune encephalomyelitis[J].Cytokine,2005,32(2):81-84.
[13]Butti E,Bergami A,Recchia A.IL4 gene delivery to the CNS recruits regulatory T cells and induces clinical recovery in mouse models of multiple sclerosis[J].Gene Ther,2008,15(7):504-515.
[14]Harrington LE,Hatton RD,Mangan PR.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type I and 2 lineages[J].Nat Immunol,2005,6(11):1123-1132.
[15]Kawanokuchi J,Shimizu K,Nitta A,et al.Suzumura A.Production and functions of IL-17 in microglia [J].J Neuroimmunol,2008,194(1-2):54-61.
[16]Tian AY,Zhang RW,Shi XG,et al.Alteration of T helper cell subsets in the optic nerve of experimental autoimmune encephalomyelitis[J].Int J Mol Med,2010:25(6):869 -974.
[17]Sarkaki A,Amani R,Badavi M,et al.Pre-treatment effect of different doses of soy isoflavones on spatial learning and memory in an ovariectomized animal model of Alzheimer's disease[J].Pak J Biol Sci,2008,11(8):1114 -1119.
[18]Garay L,Gonzalez Deniselle MC,Gierman L,et al.Steroid protection in the experimental autoimmune encephalomyelitis model of multiple sclerosis[J].Neuroimmunomodulation.2008,15(1):76-83.

