RNA結(jié)合蛋白在心血管疾病中作用機(jī)制的研究進(jìn)展
劉嘉欣,楊五小
摘要綜述RNA結(jié)合蛋白的生物學(xué)意義,重點(diǎn)介紹其在心房顫動、急性冠脈綜合征及特殊類型心臟病方面的作用機(jī)制及研究進(jìn)展,展望RNA結(jié)合蛋白轉(zhuǎn)導(dǎo)蛋白β樣蛋白2在心肌梗死疾病中的作用。
關(guān)鍵詞心血管疾病;RNA結(jié)合蛋白;轉(zhuǎn)導(dǎo)蛋白β樣蛋白2;心肌梗死;綜述
doi:10.12102/j.issn.1672-1349.2024.08.015
隨著我國社會經(jīng)濟(jì)不斷發(fā)展及城鎮(zhèn)化進(jìn)程不斷加速,人民的生活方式發(fā)生了很大的變化,心血管疾病危險因素也日漸增加,因此,心血管疾病的發(fā)病率呈逐漸升高的態(tài)勢。據(jù)《中國心血管健康與疾病報告2021》報道,我國因心血管疾病死亡人數(shù)分別占農(nóng)村和城市死亡人數(shù)的46.7%和44.3%[1]。盡管心血管疾病的診療方法和技術(shù)已有很大進(jìn)展,但目前仍未見到心血管疾病發(fā)病率的拐點(diǎn),這已經(jīng)成為我國重大的公共衛(wèi)生問題[1]。因此,提高心血管疾病的預(yù)防、治療以及改善其預(yù)后是當(dāng)務(wù)之急。在心血管疾病分子機(jī)制的研究中,RNA結(jié)合蛋白(RNA-binding proteins,RBPs)的作用越來越被關(guān)注。RBPs能夠調(diào)節(jié)基因表達(dá)[2],與心血管系統(tǒng)的發(fā)育及心血管疾病的發(fā)生發(fā)展密切相關(guān),如RBPs中的RBM20(RNA結(jié)合基序蛋白20)和RBM24(RNA基序結(jié)合蛋白24),就已被證明在心臟發(fā)育中發(fā)揮著重要作用[3-4]。因此,找尋RBPs在心血管疾病發(fā)生發(fā)展過程中的作用靶點(diǎn),對心血管疾病靶向治療方案的研發(fā)至關(guān)重要。
1RBPs概述
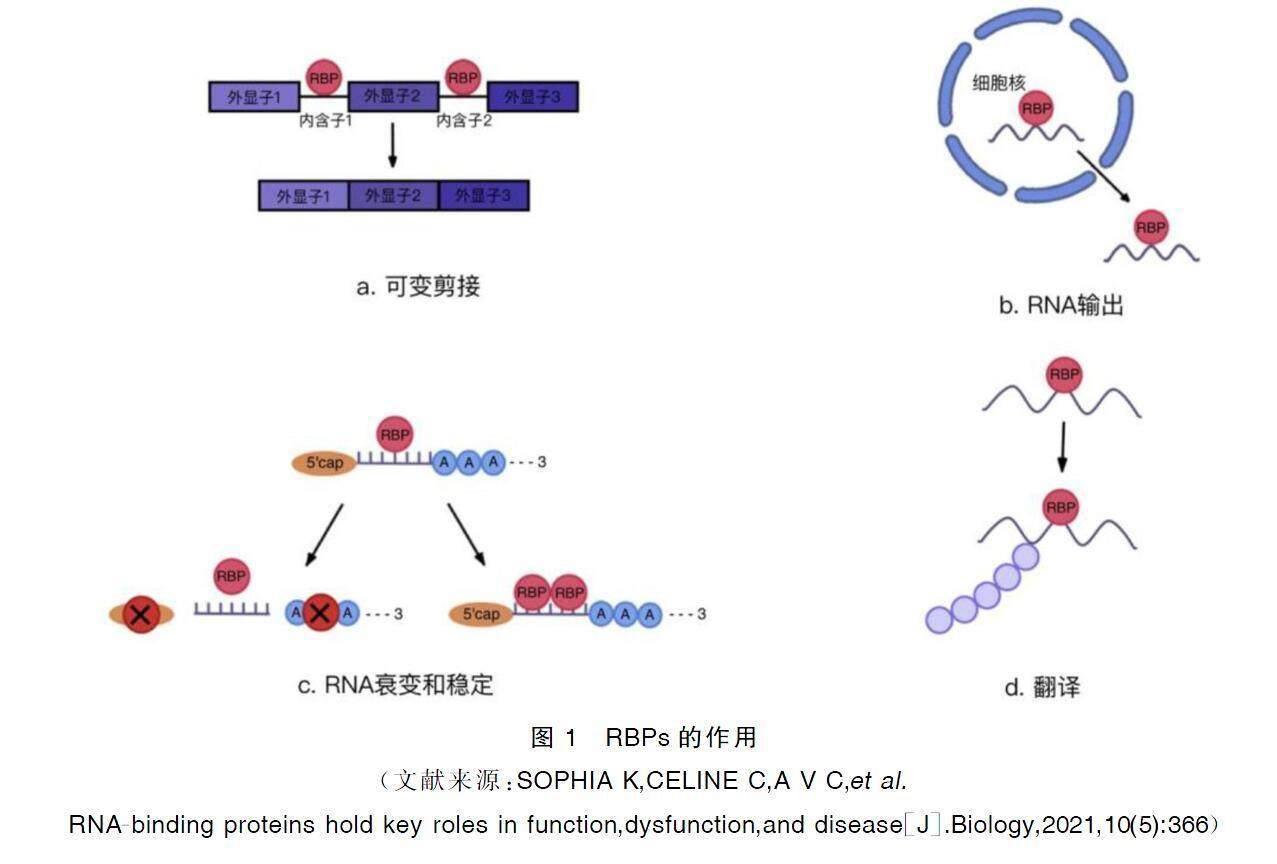
RBPs是一類能夠特異性識別和結(jié)合RNA分子的蛋白質(zhì)的總稱[5],其通常通過一個或多個RNA結(jié)構(gòu)域,包括RNA的編碼區(qū)(內(nèi)含子和外顯子)、5′非翻譯區(qū)(5′UTR)和3′非翻譯區(qū)(3′UTR)與RNA結(jié)合[6-7],參與RNA的可變剪接、RNA輸出、RNA穩(wěn)定與衰變以及翻譯后修飾等過程[8-9](見圖1)。RBPs可以與編碼區(qū)內(nèi)的可變剪接位點(diǎn)相結(jié)合來促進(jìn)可變剪接。RBPs也可以與3′UTR結(jié)構(gòu)域相互作用誘導(dǎo)或抑制RNA衰變,并且可以介導(dǎo)RNA穩(wěn)定;而缺乏結(jié)合3′UTR結(jié)構(gòu)域靶點(diǎn)的RBPs會破壞RNA的穩(wěn)定性[10]。此外,mRNA成熟的關(guān)鍵是在5′端加“帽”結(jié)構(gòu)和在3′端加多腺苷酸(poly-A)尾;而RBPs可以通過去帽酶去除5′-帽結(jié)構(gòu),并通過去氨基化酶去除3′poly-A尾部,進(jìn)而啟動RNA降解和RNA衰變[11]。
在人類基因組中,至少有1 200個經(jīng)過驗(yàn)證的RBPs以及一些新發(fā)現(xiàn)的RBPs[12],這些RBPs可參與多種重要的生理和病理過程。例如,RNA結(jié)合基序單鏈相互作用蛋白1(Rbms1)在大腦皮層發(fā)育過程中促進(jìn)神經(jīng)元的分化和放射狀遷移[13];DEAD box RNA解旋酶-5(DDX5)通過干預(yù)腸道tuft細(xì)胞的功能來調(diào)節(jié)腸道的微生物菌群和疾病易感性[14]。HuD蛋白通過抑制哺乳動物雷帕霉素靶蛋白1(mTORC1)的活性和提高ADP核糖基化因子樣6相互作用蛋白1(ARL6IP1)的水平來促進(jìn)細(xì)胞自噬和腫瘤應(yīng)激生存[15]。此外,有文獻(xiàn)報道,異常生成或缺失的RBPs與心血管疾病的發(fā)生發(fā)展也密切相關(guān)。
2RNAs與心血管疾病
2.1心房顫動
心房顫動是臨床上最常見的快速性心律失常,其發(fā)生增加了心腦血管疾病的發(fā)病率和死亡率[16]。目前,人們對心房顫動的發(fā)生機(jī)制尚不完全清楚。研究表明,RBPs對心肌細(xì)胞離子通道有調(diào)節(jié)作用[17],因此推測RBPs可能參與心房顫動的發(fā)生發(fā)展。冷誘導(dǎo)RNA結(jié)合蛋白(cold-inducible RNA-binding protein,CIRP)是一種可以在低溫環(huán)境中被誘導(dǎo)表達(dá)的RBPs[18],其能夠靶向作用于心房肌細(xì)胞的離子通道從而誘導(dǎo)心房顫動發(fā)生。Xie等[19]構(gòu)建了CIRP敲除的大鼠模型,經(jīng)刺激后可誘發(fā)心房顫動,通過外部程控心房內(nèi)起搏評估心房有效不應(yīng)期(AERP)和心房顫動敏感性,發(fā)現(xiàn)CIRP缺失可以使AERP縮短,并使心房顫動敏感性增強(qiáng),這與Brundel等[20]研究所得AERP縮短可誘發(fā)心房顫動的結(jié)論一致。為了深入了解CIRP對心房顫動的作用機(jī)制,Xie等[19]通過蛋白質(zhì)免疫印跡法(Western Blot)檢測發(fā)現(xiàn)CIRP敲除的大鼠模型中,超快速延遲整流電流(IKur)和瞬時外向電流(Ito)增加,并且IKur和Ito相對應(yīng)的電壓依賴型鉀通道1.5(Kv1.5)和電壓依賴型鉀通道4.2/4.3(Kv4.2/4.3)的通道蛋白表達(dá)顯著增加。這一研究表明,CIRP缺失可上調(diào)Kv1.5和Kv4.2/4.3通道蛋白的表達(dá)來調(diào)節(jié)心房電活動,從而誘發(fā)心房顫動。因此,CIRP有望成為心房顫動治療的新靶點(diǎn)。
QKI(quaking protein)是一種RBPs,屬于進(jìn)化上保守的信號轉(zhuǎn)導(dǎo)與 RNA活化蛋白(STAR)家族[21],其有望成為心房顫動治療的新靶點(diǎn)。目前的研究認(rèn)為,炎癥與心房顫動的關(guān)系密切[22],多種炎性細(xì)胞如中性粒細(xì)胞、巨噬細(xì)胞等在心房顫動病人心房組織中的浸潤增加[23-24]。孫澤瑋等[25]研究發(fā)現(xiàn)心房顫動病人心房組織中的巨噬細(xì)胞為促炎型,心房肌細(xì)胞快速起搏可以誘導(dǎo)促炎型巨噬細(xì)胞極化。隨后將HL-1細(xì)胞與脂多糖(LPS)刺激的巨噬細(xì)胞共同培養(yǎng),發(fā)現(xiàn)心房肌細(xì)胞L型離子通道α1C亞基基因(CACNA1C)表達(dá)受到抑制,而白細(xì)胞介素-1β(IL-1β)敲除的巨噬細(xì)胞組抑制了這一過程,這表明IL-1β可以使CACNA1C表達(dá)下調(diào),從而減少心房肌細(xì)胞L型離子通道的表達(dá)。Tili等[26]發(fā)現(xiàn)LPS刺激抑制QKI的表達(dá),而敲低QKI可以增加IL-1β的表達(dá),孫澤瑋[25]在上述實(shí)驗(yàn)過程中也觀察到了這一現(xiàn)象;同時還發(fā)現(xiàn)了敲除QKI能下調(diào)CACNA1C表達(dá),因此推測促炎型巨噬細(xì)胞能夠分泌IL-1β來抑制心房肌細(xì)胞中QKI的表達(dá),從而下調(diào)CACNA1C表達(dá),使心房肌細(xì)胞L型離子通道減少;而L型離子電流減少會下調(diào)動作電位時程,縮短有效不應(yīng)期,誘發(fā)心房顫動。
2.2急性冠脈綜合征(ACS)
急性冠脈綜合征是一種嚴(yán)重危及生命的心血管疾病[27],通常由冠狀動脈粥樣斑塊破裂或糜爛引起,而動脈粥樣斑塊形成是由于平滑肌細(xì)胞異常增殖并向血管內(nèi)膜遷移導(dǎo)致的[28]。因此,血管平滑肌細(xì)胞增殖和遷移是急性冠脈綜合征的病理基礎(chǔ)。Lin28是存在于真核生物中的一種保守的RBPs,萬樹威等[29]構(gòu)建了大鼠靜脈移植模型,發(fā)現(xiàn)涂抹Lin28-shRNA凝膠慢病毒組的移植靜脈內(nèi)膜厚度相較于其他對照組明顯降低,這表明降低Lin28的表達(dá)可以抑制血管內(nèi)膜平滑肌細(xì)胞的增殖和遷移。Brennan等[30]發(fā)現(xiàn)糖尿病動脈粥樣硬化小鼠的主動脈中Lin28表達(dá)增加,而let-7表達(dá)降低。進(jìn)一步細(xì)胞實(shí)驗(yàn)表明,促細(xì)胞分裂素血小板衍生生長因子(platelet derived growth factor,PDGF)處理后的平滑肌細(xì)胞中l(wèi)et-7表達(dá)減少;而沉默Lin28后,平滑肌細(xì)胞中PDGF受體表達(dá)減少。由此推斷Lin28能夠上調(diào)PDGF受體表達(dá)水平,抑制let-7的生成,進(jìn)而促進(jìn)平滑肌細(xì)胞的增殖和遷移,導(dǎo)致冠狀動脈粥樣硬化發(fā)生。此外,Lin28在心肌梗死中也發(fā)揮著作用。Hao等[31]發(fā)現(xiàn)在小鼠心肌梗死模型中,高表達(dá)的Lin28可以抑制心肌梗死后的心室重構(gòu)、心功能障礙以及心肌肌鈣蛋白I(cTnI)和肌酸激酶同工酶(CK-MB)的釋放,并且抑制白細(xì)胞介素-6(IL-6)和腫瘤壞死因子-α(TNF-α)的表達(dá)水平。進(jìn)一步研究發(fā)現(xiàn),敲除沉默信息調(diào)節(jié)因子1(Sirt1)基因后,高表達(dá)的Lin28則不能抑制心肌梗死后心室重構(gòu)、心功能障礙及cTnI和CK-MB的釋放。因此,推測Lin28能夠調(diào)控Sirt1的表達(dá),減少心肌梗死后心肌損傷標(biāo)志物的釋放,改善心肌梗死后的心功能,從而起到保護(hù)心肌梗死后心臟的作用。
CIRP與冠狀動脈狹窄程度密切相關(guān),對急性冠脈綜合征有較好的預(yù)測與診斷價值[32]。有研究表明,炎癥與急性冠脈綜合征發(fā)生有關(guān),如IL-6可誘導(dǎo)白細(xì)胞黏附,使斑塊處纖維帽變薄,斑塊的穩(wěn)定性下降并出現(xiàn)裂隙,最終導(dǎo)致斑塊破裂和血栓形成[33-34];而CIRP可以直接上調(diào)炎性因子IL-6的表達(dá)[35]。有研究者測定了急性冠脈綜合征病人血清中CIRP、IL-6的濃度,發(fā)現(xiàn)二者的表達(dá)呈正相關(guān),因此,推測在心肌急性缺血、缺氧時,心肌細(xì)胞會大量產(chǎn)生CIRP進(jìn)而上調(diào)IL-6的表達(dá),然后二者分泌到細(xì)胞外并釋放入血,由此可在一定程度上反映急性冠脈綜合征病人冠狀動脈狹窄的程度[32-34]。
2.3特殊類型心臟病
心肌致密化不全(noncompaction of the ventricular myocardium)是胚胎發(fā)育過程中心肌致密化失敗所致的一種特殊類型心肌病。研究表明,胚胎鼠心肌細(xì)胞表現(xiàn)為單核和二倍體,具有高度增殖性,而出生后不久的小鼠心肌細(xì)胞就退出細(xì)胞周期,變成雙核和多倍體,失去增殖能力,這與心臟沒有再生能力相吻合[36-37]。Gan等[38]研究發(fā)現(xiàn)RBPs RBPMS缺失可導(dǎo)致心臟發(fā)育過程中心肌細(xì)胞胞質(zhì)分裂失敗,心肌細(xì)胞過早出現(xiàn)細(xì)胞周期停滯,形成雙核和多倍體,從而使心肌細(xì)胞數(shù)量減少,導(dǎo)致心肌致密化不全。Soonpaa等[39]發(fā)現(xiàn)長型Pdlim5在心臟發(fā)育過程中高度表達(dá),在出生后逐漸減少,而短型Pdlim5開始顯著增加,二者轉(zhuǎn)換的時間與心肌細(xì)胞雙核化開始的時間一致。Gan等[38]通過RNA測序發(fā)現(xiàn),RBPMS通過剪接出Pdlim5的外顯子8來抑制短型Pdlim5,以維持長型Pdlim5在胚胎心肌細(xì)胞中的表達(dá);而RBPMS的缺失導(dǎo)致短型Pdlim5的異常積累,其直接抑制心肌細(xì)胞胞質(zhì)分裂,從而減少心肌細(xì)胞數(shù)量,導(dǎo)致心肌致密化不全。這一研究表明心肌致密化不全的發(fā)生與RBPMS缺失密切相關(guān)。
左心發(fā)育不全綜合征(hypoplastic left heart syndrome,HLHS)是心血管系統(tǒng)發(fā)育不良所致的先天性心血管畸形,其發(fā)生與RBFOX2的基因功能缺失密切相關(guān)[40]。RBFOX2是一種RBPs,Verma等[41]構(gòu)建了RBFOX2敲除小鼠模型,發(fā)現(xiàn)在這些小鼠胚胎中卵黃囊脈管系統(tǒng)出現(xiàn)異常,并且觀察到這些小鼠的心臟未能顯示4個心腔;之后進(jìn)行RNA測序發(fā)現(xiàn),RBFOX2敲除可以影響Rho GTP酶的表達(dá),使細(xì)胞周期停滯,內(nèi)皮細(xì)胞向肌成纖維細(xì)胞、平滑肌細(xì)胞等細(xì)胞轉(zhuǎn)化受到影響。而在HLHS中也同樣存在這些發(fā)育缺陷,這表明RBFOX2與HLHS之間存在一定的聯(lián)系。
3展望
目前一系列研究結(jié)果表明RBPs參與了多種心血管疾病的發(fā)生發(fā)展,但仍未完全闡明心血管疾病復(fù)雜的發(fā)病機(jī)制,更多的RBPs在心血管系統(tǒng)中的作用機(jī)制亟需進(jìn)一步研究。例如,RBPs中的TBL2是一種內(nèi)質(zhì)網(wǎng)定位蛋白,由N端跨膜區(qū)和C端WD40結(jié)構(gòu)域組成,其可以與移行上皮反應(yīng)基因1(TERE1)相互作用,調(diào)控跨膜電位、活性氧/活性氮(ROS/RNS)和SXR基因[42],也可以通過WD40結(jié)構(gòu)域與60S核糖體亞基相關(guān)聯(lián)[43]。此外,TBL2也是一種內(nèi)質(zhì)網(wǎng)應(yīng)激蛋白激酶R樣內(nèi)質(zhì)網(wǎng)激酶(PERK)結(jié)合蛋白,而PERK對于細(xì)胞在內(nèi)質(zhì)網(wǎng)應(yīng)激條件下的生存非常重要,TBL2通過與PERK結(jié)合,在內(nèi)質(zhì)網(wǎng)應(yīng)激過程中調(diào)控細(xì)胞生存[44];并且在缺氧條件下,TBL2可以調(diào)控激活轉(zhuǎn)錄因子4(ATF4)的翻譯影響細(xì)胞生長[45-46];其次,TBL2基因的甲基化可以通過激活PERK-TBL2-eIF2α-ATF4通路來影響脂代謝[47-48]。而在心肌梗死后內(nèi)質(zhì)網(wǎng)持續(xù)或過強(qiáng)的應(yīng)激會引起心肌損傷,最終發(fā)生心力衰竭[46];此外,脂代謝異常是動脈粥樣硬化的關(guān)鍵,而動脈粥樣硬化是心肌梗死的基礎(chǔ)。因此,TBL2是否可能通過調(diào)控下游基因在心肌梗死中發(fā)揮作用將是下一步研究的方向。
參考文獻(xiàn):
[1]《中國心血管健康與疾病報告》編寫組.《中國心血管健康與疾病報告2021》要點(diǎn)解讀[J].中國心血管雜志,2022,27(4):305-318.
[2]STEFANIE G,MARKUS H,THOMAS T.A census of human RNA-binding proteins[J].Nature Reviews Genetics,2014,15(12):829-845.
[3]LENNERMANN D,BACKS J,VAN DEN HOOGENHOF M M G.New Insights in RBM20 cardiomyopathy[J].Current Heart Failure Reports,2020,17(5):234-246.
[4]ZHANG M,ZHANG Y H,XU E S,et al.Rbm24,a target of p53,is necessary for proper expression of p53 and heart development[J].Cell Death and Differentiation,2018,25(6):1118-1130.
[5]HENTZE M W,CASTELLO A,SCHWARZL T,et al.A brave new world of RNA-binding proteins[J].Nature Reviews Molecular Cell Biology,2018,19(5):327-341.
[6]MARTIN K C,EPHRUSSI A.mRNA localization:gene expression in the spatial dimension[J].Cell,2009,136(4):719-730.
[7]RICHTER J D,KLANN E.Making synaptic plasticity and memory last:mechanisms of translational regulation[J].Genes & Development,2009,23(1):1-11.
[8]LIU-YESUCEVITZ L,BASSELL G J,GITLER A D,et al.Local RNA translation at the synapse and in disease[J].Journal of Neuroscience,2011,31(45):16086-16093.
[9]SOPHIA K,CELINE C,A V C,et al.RNA-binding proteins hold key roles in function,dysfunction,and disease[J].Biology,2021,10(5):366.
[10]MOORE K S,VON LINDERN M.RNA binding proteins and regulation of mRNA translation in erythropoiesis[J].Frontiers in Physiology,2018,9:910.
[11]DHATARIYA K.Diabetes:the place of new therapies[J].Therapeutic Advances in Endocrinology and Metabolism,2019,10:204201881880759.
[12]QUATTRONE A,DASSI E.The Architecture of the human RNA-Binding protein regulatory network[J].Science,2019,21(C):706-719.
[13]HABIB K,BISHAYEE K,KANG J,et al.RNA binding protein Rbms1 enables neuronal differentiation and radial migration during neocortical development by binding and stabilizing the RNA message for Fr3a[J].Molecules and Cells,2022,45(8):588-602.
[14]LONG T Y,ABBASI N,HERNANDEZ J E,et al.RNA binding protein DDX5 directs tuft cell specification and function to regulate microbial repertoire and disease susceptibility in the intestine[J].Gut,2022,71(9):1790-1802.
[15]BISHAYEE K,HABIB K,NAZIM U M D,et al.RNA binding protein HuD promotes autophagy and tumor stress survival by suppressing mTORC1 activity and augmenting ARL6IP1 levels[J].Journal of Experimental & Clinical Cancer Research,2022,41(1):18.
[16]BURSTEIN B,NATTEL S.Atrial fibrosis:mechanisms and clinical relevance in atrial fibrillation[J].Journal of the American College of Cardiology,2008,51(8):802-809.
[17]LI J,XIE D Y,HUANG J,et al.Cold-inducible RNA-binding protein regulates cardiac repolarization by targeting transient outward potassium channels[J].Circulation Research,2015,116(10):1655-1659.
[18]LIAO Y,TONG L,TANG L,et al.The role of cold-inducible RNA binding protein in cell stress response[J].International Journal of Cancer,2017,141(11):2164-2173.
[19]XIE D Y,GENG L,WANG S,et al.Cold-inducible RNA-binding protein modulates atrial fibrillation onset by targeting multiple ion channels[J].Heart Rhythm,2020,17(6):998-1008.
[20]BRUNDEL B J,VAN GELDER I C,HENNING R H,et al.Ion channel remodeling is related to intraoperative atrial effective refractory periods in patients with paroxysmal and persistent atrial fibrillation[J].Circulation,2001,103(5):684-690.
[21]陳鍇,宋峣,張幼怡.STAR 蛋白及其成員QKI的結(jié)構(gòu)及功能[J].生理科學(xué)進(jìn)展,2003,34(4):347-349.
[22]GLCK T,ALTER P.Omega-3 highly unsaturated fatty acids and arrhythmia risk[J].Journal of the American College of Cardiology,2015,65(12):1267-1268.
[23]FRIEDRICHS K,ADAM M,REMANE L,et al.Induction of atrial fibrillation by neutrophils critically depends on CD11b/CD18 integrins[J].PLoS One,2014,9(2):e89307.
[24]YAMASHITA T,SEKIGUCHI A,IWASAKI Y K,et al.Recruitment of immune cells across atrial endocardium in human atrial fibrillation[J].Circulation Journal,2010,74(2):262-270.
[25]孫澤瑋.巨噬細(xì)胞與心房肌細(xì)胞交互作用在房顫發(fā)生和發(fā)展中的作用及機(jī)制研究[D].杭州:浙江大學(xué),2017.
[26]TILI E,CHIABAI M,PALMIERI D,et al.Quaking and miR-155 interactions in inflammation and leukemogenesis[J].Oncotarget,2015,6(28):24599-24610.
[27]WANG L,JIN Y.Noncoding RNAs as biomarkers for acute coronary syndrome[J].BioMed Research International,2020,2020:1-11.
[28]劉峰濤,于紫英.血管平滑肌細(xì)胞與動脈粥樣硬化斑塊穩(wěn)定性的研究進(jìn)展[J].中國心血管雜志,2021,26(3):299-302.
[29]萬樹威,曹輝,李楠,等.Lin28a對大鼠移植靜脈內(nèi)膜增生影響的實(shí)驗(yàn)研究[J].中華血管外科雜志,2020,5(3):202-205.
[30]BRENNAN E,WANG B,MCCLELLAND A,et al.Protective effect of let-7 miRNA family in regulating inflammation in diabetes-associated atherosclerosis[J].Diabetes,2017,66(8):2266-2277.
[31]HAO Y,LU Q,YANG G,et al.Lin28a protects against postinfarction myocardial remodeling and dysfunction through Sirt1 activation and autophagy enhancement[J].Biochemical and Biophysical Research Communications,2016,479(4):833-840.
[32]潘穎,戴力.冷誘導(dǎo)RNA結(jié)合蛋白與冠心病病人冠狀動脈狹窄程度的相關(guān)性[J].安徽醫(yī)藥,2021,25(2):308-312.
[33]GAGER G M,BIESINGER B,HOFER F,et al.Interleukin-6 level is a powerful predictor of long-term cardiovascular mortality in patients with acute coronary syndrome[J].Vascular Pharmacology,2020,135:106806.
[34]左廣鋒,謝浩,任曉敏,等.急性冠狀動脈綜合征患者血清冷誘導(dǎo)RNA結(jié)合蛋白的表達(dá)及其臨床意義[J].江蘇醫(yī)藥,2021,47(10):1051-1053.
[35]AZIZ M,BRENNER M,WANG P.Extracellular CIRP(eCIRP) and inflammation[J].Journal of Leukocyte Biology,2019,106(1):133-146.
[36]GAN P H,PATTERSON M,SUCOV H M.Cardiomyocyte polyploidy and implications for heart regeneration[J].Annual Review of Physiology,2020,82:45-61.
[37]PORRELLO E R,MAHMOUD A I,SIMPSON E,et al.Transient regenerative potential of the neonatal mouse heart[J].Science,2011,331(6020):1078-1080.
[38]GAN P H,WANG Z N,MORALES M G,et al.RBPMS is an RNA-binding protein that mediates cardiomyocyte binucleation and cardiovascular development[J].Developmental Cell,2022,57(8):959-973.
[39]SOONPAA M H,KIM K K,PAJAK L,et al.Cardiomyocyte DNA synthesis and binucleation during murine development[J].The American Journal of Physiology,1996,271(5 Pt 2):H2183-2189.
[40]MCKEAN D M,HOMSY J,WAKIMOTO H,et al.Loss of RNA expression and allele-specific expression associated with congenital heart disease[J].Nature Communications,2016,7(1):12824.
[41]VERMA S K,DESHMUKH V,THATCHER K,et al.RBFOX2 is required for establishing RNA regulatory networks essential for heart development[J].Nucleic Acids Research,2022,50(4):2270-2286.
[42]FREDERICKS W J,MCGARVEY T,WANG H Y,et al.The TERE1 protein interacts with mitochondrial TBL2:regulation of trans-membrane potential,ROS/RNS and SXR target genes[J].Journal of Cellular Biochemistry,2013,114(9):2170-2187.
[43]TSUKUMO Y,TSUKAHARA S,F(xiàn)URUNO A,et al.The endoplasmic reticulum-localized protein TBL2 interacts with the 60S ribosomal subunit[J].Biochemical and Biophysical Research Communications,2015,462(4):383-388.
[44]TSUKUMO Y,TSUKAHARA S,F(xiàn)URUNO A,et al.TBL2 is a novel PERK-binding protein that modulates stress-signaling and cell survival during endoplasmic reticulum stress[J].PLoS One,2014,9(11):e112761.
[45]TSUKUMO Y,TSUKAHARA S,F(xiàn)URUNO A,et al.TBL2 associates with ATF4 mRNA via its WD40 domain and regulates its translation during ER stress[J].Journal of Cellular Biochemistry,2016,117(2):500-509.
[46]HU J,HUANG C X,RAO P P,et al.microRNA-155 inhibition attenuates endoplasmic reticulum stress-induced cardiomyocyte apoptosis following myocardial infarction via reducing macrophage inflammation[J].European Journal of Pharmacology,2019,857:172449.
[47]劉帥.脂代謝相關(guān)基因DNA甲基化與血脂異常及冠心病相關(guān)性研究[D].烏魯木齊:新疆醫(yī)科大學(xué),2020.
[48]VAN NOSTRAND E L,F(xiàn)REESE P,PRATT G A,et al.A large-scale binding and functional map of human RNA binding proteins[J].Nature,2020,583(7818):711-719.
(收稿日期:2022-12-15)
(本文編輯王雅潔)

