MCP-1基因對膿毒癥急性腎損傷發生的作用研究
郭峻氚, 王靜靜, 郭仁楠, 肖 東, 劉 艷
(新疆維吾爾自治區人民醫院重癥醫學科, 烏魯木齊 830000)
急性腎損傷(Acute kidney injury,AKI)是引發慢性腎臟病的重要原因,盡管部分患者能夠平安度過急性期,但其長期病死率仍居高不下[1]。近年來血液凈化技術和重癥監護治療水平有了較大的進步,但AKI患者的臨床治療及預后效果仍有待改善。有報道顯示,對于患有AKI的危重癥患者而言,其預后受到AKI影響的概率高達40%[2-4]。近1/3患有AKI的危重癥患者會在90 d內死亡,且其余危重癥患者90 d后的歸因死亡率約為10%。在誘發危重癥患者形成AKI的全部因素中,膿毒癥占比高達50%[5]。然而,目前臨床上對于膿毒癥所致AKI的病理生理機制尚未明確。基于此,本研究主要通過開展體外細胞生物學實驗探討單核細胞趨化蛋白-1(Monocyte chemotactic protein 1,MCP-1)基因表達與膿毒癥所致AKI的相關性,旨在為臨床明確膿毒癥所致AKI發病機制提供參考。
1 資料與方法
1.1 一般資料選取2022年9月-2023年9月新疆維吾爾自治區人民醫院重癥醫學科收治的50例膿毒癥AKI患者作為AKI組,納入同期50例健康受試者作為對照組。對照組男性27例,女性23例;年齡18~80歲,平均年齡(55.24±6.33)歲。AKI組男性28例,女性22例;年齡18~80歲,平均年齡(55.13±6.25)歲。高血壓病史23例,肺部感染32例;急性生理與慢性健康狀況評估Ⅱ(Acute physiology and chronic health evaluation,APACHE Ⅱ)評分12~20分,平均APACHE Ⅱ評分(15.98±0.52)分。本研究已獲得醫院倫理委員會批準(KY2021052616),受試者均知情同意。納入標準:(1)均符合《拯救膿毒癥運動:膿毒癥與膿毒性休克治療國際指南(2021版)》[6]中相關診斷標準,同時符合AKI相關臨床診斷標準[7];(2)首次入住ICU。排除標準:(1)自身免疫性疾病或感染性疾病;(2)既往慢性腎功能衰竭;(3)各種腎病、糖尿病;(4)孕婦。
1.2 實驗材料人MCP-1 酶聯免疫吸附試驗(Enzyme-linked immunosorbent assay,ELISA,上海科艾博生物技術有限公司);細胞角蛋白14(Cytokeratin 14,CK14)和細胞角蛋白18(Cytokeratin 18,CK18)抗體購自上海科敏生物科技有限公司;細胞增殖檢測試劑盒(Cell counting kit-8,CCK8,北京博奧森生物技術有限公司);白細胞介素-1β(Interleukin-1β,IL-1β)、白細胞介素6(Interleukin 6,IL-6)、白細胞介素10(Interleukin 10,IL-10)、γ-干擾素(Interferon-γ,IFN-γ)和腫瘤壞死因子-α(Tumor necrosis factor α,TNF-α)抗體均購自上海酶聯生物公司;細胞培養箱(上海市頤習儀器設備公司);酶標儀(江蘇省常州市銳品密儀器有限公司);核糖核酸(Ribonucleic acid,RNA)提取試劑盒(批號:AM1900,美國Thermo Fisher Scientific公司);實時定量聚合酶鏈式反應(Polymerase chain reaction,PCR)儀(美國Applied Biosystems公司);離心機(美國Thermo Fisher Scientific公司);熒光顯微鏡(德國Leica公司);倒置顯微鏡(日本奧林巴斯光學工業股份有限公司)。
1.3 方法
1.3.1 ELISA法檢測MCP-1在膿毒癥AKI患者外周血中的表達 分別采集全部受試者清晨空腹上肢靜脈血5 mL,以3 000 r/min離心15 min,取上清液,采用ELISA法測定AKI患者及健康人群血清中MCP-1表達。
1.3.2 尿液的收集和腎小管上皮細胞分離培養方法
1.3.2.1 尿液收集 先排空晨尿,飲用水后用無菌的15 mL離心管收集適量尿液,盡量取潔凈的中段尿,密封后置于冰上并及時進行尿液細胞分離以防尿液細胞在尿液中留置過久而死亡。
1.3.2.2 尿液腎小管上皮細胞分離 將盛有尿液的離心管置于離心機中,以1 500 r/min離心5 min。棄去上清液,留置沉渣約1 mL,向沉渣中加入適量沖洗緩沖液,小心吹打混勻,室溫下以1 500 r/min離心10 min。棄去上清液,留置沉淀約0.2 mL,向沉淀中加入1 mL尿液細胞初級培養液,吹打混勻后將其轉移至由0.1%明膠溶液包被過的孔板中,再加入1 mL細胞初級培養液,將其置于培養箱內恒溫培養。
1.3.2.3 腎小管上皮細胞傳代 每天觀察細胞的生長情況,3~7 d后出現小團的細胞克隆,每孔有5~20個小克隆,之后腎小管上皮細胞會進行穩定增殖。當細胞培養至80%~90%密度時,吸凈培養液,用磷酸鹽緩沖鹽溶液(Phosphate buffered saline,PBS)洗滌2次,加入0.25%胰酶溶液在室溫條件下消化約3 min,加入胰酶抑制劑終止消化,用槍頭輕輕吹打使細胞從孔壁上脫落。將細胞懸液抽吸至15 mL離心管中,1 000 r/min離心5 min,棄去上清液,加入2 mL培養液,用吸管將細胞吹勻,在恒溫條件下進行傳代培養。當各代細胞生長至80%~90%密度時,繼續按照上述方法進行傳代。
1.3.3 免疫熒光法檢測腎小管上皮細胞MCP-1的表達 按照AKI的風險損傷失效損失終末期腎臟疾病(Risk injury failure loss end stage kidney disease,RIFLE)診斷標準,收集AKI患者尿液,從尿液中分離出腎小管上皮細胞,用PBS進行漂洗,血清封閉,每張切片滴加50 μL適當濃度的特異性單克隆抗體MCP-1(鼠來源),4℃過夜后,用PBS漂洗數次,滴加用不同熒光素標記的二抗(分別是不同熒光素標記的抗鼠和抗兔的抗體),室溫孵育1 h后用PBS沖洗,滴加抗熒光淬滅封片液,蓋玻片封片后在熒光顯微鏡下觀察并拍照。
1.3.4 MCP-1過表達載體構建和RNA干擾 根據前期克隆MCP-1測序獲得的編碼序列(Coding sequence,CDS)設計3條特異性小干擾RNA(Small interfering RNA,siRNA),送生物公司合成。按照說明書要求用無RNA酶水稀釋至100 nmol/L后用于驗證和功能研究。利用前期克隆的MCP-1序列設計引物,結合pcDNA3.1載體酶切位點和MCP-1序列分析,引入酶切位點,PCR擴增、連接、轉化及測序鑒定,構建MCP-1過表達載體pcDNA3.1-MCP-1。將siRNA和pcDNA3.1-MCP-1轉染腎小管上皮細胞,檢測MCP-1最佳過表達條件和干擾序列。按此法分為:陰性對照組(Negative control,NC)、MCP-1組(過表達MCP-1基因)、siRNA組(干擾MCP-1基因)。
1.3.5 CCK8細胞增殖檢測試劑盒檢測細胞增殖 將細胞按150 μL、1 500個/孔接種于96孔板中,置于37℃、5%CO2培養箱培養24 h后,替換為不含血清的培養基。加入pcDNA3.1-MCP-1和MCP-1特異siRNA并設陰性對照孔。測定每孔pH值后放入培養箱,分別培養12、24、36、48、72 h。每孔加入10 μL CCK-8溶液孵育2 h,用酶標儀測定吸光度值。
1.3.6 RT-qPCR方法檢測細胞中MCP-1的表達 取分離好的腎小管上皮細胞,用Trizol試劑提取總RNA,經紫外分光光度計(A260/A280為1.8~2.0)和凝膠電泳鑒定后進行定量,用逆轉錄試劑盒進行逆轉錄合成cDNA模板,隨后進行PCR反應,在美國國家生物技術信息中心(National Center for Biotechnology Information,NCBI)數據庫上獲得MCP-1、炎性細胞因子白細胞介素-1β(IL-1β)、白細胞介素6(IL-6)、白細胞介素10(IL-10)、γ-干擾素(IFN-γ)、腫瘤壞死因子α(TNF-α)和內參GAPDH的mRNA序列,設計引物進行聚合酶鏈反應,建立25 μL PCR反應體系,94℃ 4 min、94℃ 50 s、60℃ 50 s、72℃ 80 s、72℃ 10 min,循環數35次,最后取6 μL PCR產物凝膠電泳分析。采用Real-TimePCR儀進行檢測,采用2-ΔΔCt法分析MCP-1表達情況。
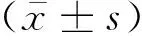
2 結果
2.1 MCP-1在AKI外周血和尿液中的表達ELISA檢測結果顯示,與對照組相比,AKI組患者外周血和尿液中的MCP-1表達量顯著升高(P均<0.05),見表1。
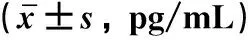
表1 兩組外周血與尿液中MCP-1表達水平比較
2.2 腎小管上皮細胞原代培養和鑒定基于收集的尿液樣本,首先采用percol梯度離心法聯合差速貼壁法獲得AKI患者的腎小管上皮細胞,然后利用CK14和CK18抗體進行細胞免疫熒光監測,對原代培養的腎小管上皮細胞進行鑒定。腎小管細胞培養24 h,分離培養的上皮細胞呈現多邊形,具有較強立體感,形態正常。培養至72 h,細胞匯合度達到90%,生長速度正常(圖1)。通過細胞免疫熒光鑒定(圖2),選擇上皮細胞標志物CK14和CK18,對細胞進行原代培養24 h,90%以上的細胞表達細胞標志物CK18,約84%的細胞表達CK14,表明分離獲得腎小管上皮細胞的純度較高。

原代培養24 h(10×) 原代培養72 h(10×)
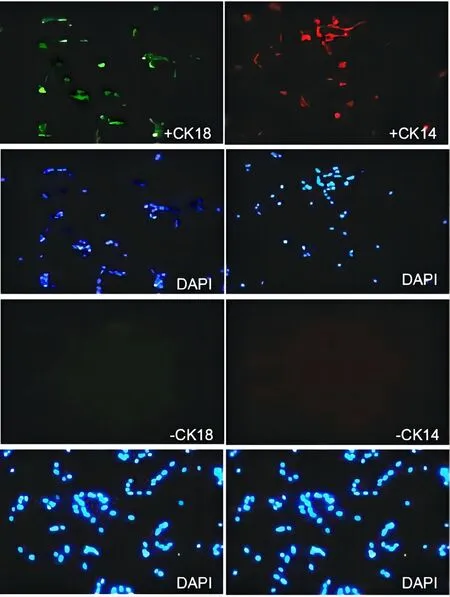
圖2 腎小管上皮細胞鑒定圖
2.3 MCP-1基因對腎小管上皮原代細胞增殖的影響利用原代培養的腎小管上皮細胞,通過過表達和干擾MCP-1基因的表達,利用CCK8細胞增殖檢測試劑盒檢測細胞增殖的變化。結果顯示,MCP-1組在24、48、72 h的細胞數量分別為(184.12±4.32)×1012個/L、(281.35±7.35)×1012個/L、(709.8±5.41)×1012個/L;siRNA組在24、48、72 h的細胞數量分別為(221.65±5.61)×1012個/L、(424.23±8.25)×1012個/L、(786.52±6.28)×1012個/L;NC組在24、48、72 h的細胞數量分別為(209.34±6.37)×1012個/L、(382.24±6.32)×1012個/L、(800.29±7.56)×1012個/L。與NC組相比,siRNA組在24、48 h細胞數量增加(P均<0.05);與MCP-1組相比,siRNA組在24、48、72 h的細胞數量增加(P均<0.05)。
2.4 MCP-1基因對腎小管上皮原代細胞炎性因子表達的影響利用RT-qPCR檢測過表達和干擾MCP-1基因后,腎小管上皮細胞炎性因子的表達變化。結果顯示,NC組的IL-1β、IL-6、INF-γ因子的表達水平隨著時間的推移逐漸升高。MCP-1組的IL-1β、IL-6、IL-10、INF-γ和TNF-α因子表達水平隨著時間的推移逐漸升高。siRNA組的IL-1β、IL-6、INF-γ因子無顯著升高趨勢。提示MCP-1顯著促進了腎小管上皮細胞的炎癥反應,見圖3。
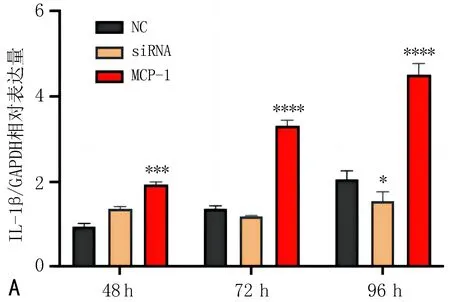
注:與NC組比較, *P<0.05, **P<0.01, ***P<0.001, ****P<0.000 1。
3 討論
膿毒癥導致AKI的病理生理學機制是多方面的,且不同的患者之間可能不同[8-10]。研究表明,膿毒癥所致的AKI是腎小管上皮細胞對炎性損傷信號的適應性應答[11-12]。免疫細胞激活后所合成或由病原體直接產生的炎性介質(也稱損害或病原體相關分子模式,DAMPs及PAMPs)被免疫系統識別后可對抗感染,然而該過程也會損傷宿主細胞。腎小管上皮細胞可通過與Toll樣受體4(TLR4)、骨髓分化因子88等受體結合,對DAMPs及PAMPs進行識別,從而誘發核因子κB(NF-κB)及腫瘤壞死因子α(TNF-α)的過度表達[13-15],進而可能對腎小管上皮細胞造成損傷。盡管目前臨床對于膿毒癥所致AKI的病理生理學已有了初步的認識,但其具體作用機制仍需進一步探討。
MCP-1為一種重要的炎癥因子,主要由單核細胞、巨噬細胞、腎臟固有細胞如腎小管上皮細胞、內皮細胞、系膜細胞、間質細胞和足細胞等受各種理化因素的刺激后合成和分泌[16]。MCP-1可以通過調控炎癥細胞運輸來控制炎癥反應,并能夠對組織損傷中白細胞的募集進行調節[17]。MCP-1可通過多種途徑導致不同程度的腎臟損傷。有文獻顯示,在腎小球腎炎模型和糖尿病模型中發現MCP-1通過促進腎臟巨噬細胞浸潤及腎間質損傷從而參與腎損傷過程[18]。然而,目前關于MCP-1是否在膿毒癥所致AKI中發揮作用尚缺乏研究。有關研究表明,在膿毒癥小鼠模型中抑制或拮抗MCP-1均可引起TNF-α、IL-1β等炎性細胞因子水平下降,從而改善小鼠預后[19]。本研究結果顯示,AKI患者外周血及尿液中的MCP-1表達量均顯著升高(P<0.05),與楊曉玲等[20]的研究結論一致,提示MCP-1作為促炎介質可能在膿毒癥所致AKI的發生中發揮重要作用。本研究結果顯示,過表達MCP-1基因后,腎小管上皮細胞的增殖速度下降,表明MCP-1基因可能對腎小管上皮細胞的生長和增殖具有抑制作用。而干擾MCP-1基因后,腎小管上皮細胞的增殖速度顯著增加,說明MCP-1基因對腎小管上皮細胞的增殖具有負向調控作用。而過表達MCP-1基因后,IL-1β的表達水平顯著增加,表明MCP-1可能通過調節IL-1β的表達來影響腎小管上皮細胞的生長和增殖。IL-1β可以促進炎癥反應和組織損傷[21]。因此,MCP-1可能通過促進IL-1β的表達來加重腎臟的炎癥反應和組織損傷,進而促進AKI的發生。此外,通過過表達和干擾MCP-1基因,本研究所選取腎小管上皮細胞炎性因子IL-6和INF-γ 的表達趨勢均與IL-1β的表達趨勢一致,表明MCP-1還可能通過調節其他炎性因子的表達來影響腎小管上皮細胞的炎癥反應。由上述結果推斷,膿毒癥患者可能由于腎臟中MCP-1表達上調,從而引起巨噬細胞的過度活化,促進IL-1β、IL-6、IL-10、INF-γ等炎癥因子的合成及分泌,進而引發AKI。
本研究結果表明,MCP-1基因在膿毒癥所致AKI中可能發揮重要作用,因此以MCP-1為靶點的治療策略有望成為膿毒癥所致AKI的臨床治療新方向。例如,臨床或許可以通過抑制膿毒癥患者MCP-1的表達,多靶點調控炎癥因子,阻斷炎癥細胞因子的級聯反應,從而減輕患者腎臟的炎癥反應,以期緩解患者腎臟損傷,以防AKI發生或改善膿毒癥所致AKI患者的預后。然而,上述治療策略具體實施方案及應用于防治膿毒癥所致AKI的安全性及有效性仍需開展大量臨床研究進行構建及驗證。

