長波紫外線對(duì)人黑素瘤細(xì)胞中視蛋白3的表達(dá)及細(xì)胞增殖的影響*
張玉蕾, 曾雯, 張偉, 董仙, 馮江龍, 靳姝琦, 羅歡歡, 劉婷,陸洪光***
(1.貴州醫(yī)科大學(xué) 臨床醫(yī)學(xué)院 皮膚病與性病學(xué)教研室, 貴州 貴陽 550004; 2.貴州醫(yī)科大學(xué)附屬醫(yī)院 皮膚科, 貴州 貴陽 550004; 3.貴州醫(yī)科大學(xué)附屬醫(yī)院 病理科, 貴州 貴陽 550004)
惡性黑色素瘤是一種具有高度侵襲性的皮膚腫瘤[1],也是致死率最高的皮膚惡性腫瘤[1]。從2008—2018年全球惡性黑素瘤發(fā)病率增加了44%,死亡率上升了32%[2-3],2018年全球共有60 712人死于惡性黑素瘤[2]。目前認(rèn)為惡性黑素瘤來源于失控的黑色素細(xì)胞增殖[1]。既往研究已證實(shí),遺傳易感基因與環(huán)境暴露因素的相互作用是導(dǎo)致惡性黑素瘤發(fā)生、發(fā)展的關(guān)鍵因素,其中長期的紫外線暴露是誘發(fā)惡性黑素瘤的最重要原因[4]。目前認(rèn)為,60%~70%的惡性黑色素瘤是由紫外線照射所致[4],長波紫外線(ultraviolet A, UVA)和短波紫外線(ultraviolet B, UVB)在惡性黑素瘤的發(fā)生中發(fā)揮了重要的作用[5],但到達(dá)地球表面的紫外線中UVA和UVB分別占90%~95%和5%~10%,紫外線誘發(fā)惡性黑素瘤主要通過直接和間接的脫氧核糖核酸(DNA)損傷所致[5-6]。UVA是否誘導(dǎo)間接DNA損傷發(fā)生的關(guān)鍵在于細(xì)胞能否感受UVA并及時(shí)轉(zhuǎn)換為熱能[4],真黑素可以將吸收的99.9%UVA轉(zhuǎn)化為熱能,從而避免DNA損傷發(fā)生[5],而UVA必須首先與內(nèi)源性光敏劑(如卟啉、黑色素)反應(yīng),進(jìn)而產(chǎn)生羥自由基和游離氧[7]。然而,這些光敏感分子的UVA吸收光譜是不同的[7],因此在UVA誘導(dǎo)惡性黑素瘤的發(fā)病過程中,感受UVA的細(xì)胞光敏感分子和蛋白發(fā)揮了關(guān)鍵的作用。細(xì)胞增殖是惡性黑素瘤的一個(gè)主要風(fēng)險(xiǎn)因素[8],在惡性黑素瘤的發(fā)生、發(fā)展及侵襲過程中發(fā)揮了關(guān)鍵的作用。UVA通過誘導(dǎo)癌基因包括B-Raf原癌基因,絲氨酸/蘇氨酸激酶(B-Raf proto-oncogene, serine/threonine kinase,BRAF)、神經(jīng)母細(xì)胞瘤病毒癌基因 RAS 同系物(neuroblastoma RAS viral oncogene homolog, NRAS)、細(xì)胞周期蛋白依賴性激酶抑制因子 2A(cyclin dependent kinase inhibitor 2A,CDKN2A)等的突變、活性氧(ROS)產(chǎn)生及光老化相關(guān)基質(zhì)金屬蛋白酶(MMP)的表達(dá)[9-10],促進(jìn)細(xì)胞轉(zhuǎn)錄、翻譯和細(xì)胞分裂[8],從而促進(jìn)黑素瘤細(xì)胞的增殖和侵襲。細(xì)胞如何感受UVA,啟動(dòng)黑素瘤細(xì)胞的增殖,目前還有待進(jìn)一步的研究。視蛋白3(opsin 3, OPN3)是人成纖維細(xì)胞感應(yīng)UVA的光敏蛋白[11],參與肝癌細(xì)胞的耐藥[12],介導(dǎo)藍(lán)光誘導(dǎo)的結(jié)腸癌細(xì)胞自噬[13];既往研究報(bào)道證實(shí),OPN3的表達(dá)與皮膚黑色素瘤及其他腫瘤發(fā)生和臨床預(yù)后之間存在一定關(guān)聯(lián)[14-15]。然而,OPN3是否介導(dǎo)UVA誘導(dǎo)的黑素瘤細(xì)胞增殖作用,迄今仍不清楚,本文擬檢測長波紫外線誘導(dǎo)OPN3在人黑素瘤細(xì)胞系(A375細(xì)胞和MV3細(xì)胞)的表達(dá)和對(duì)細(xì)胞增殖的影響,探討OPN3調(diào)控人黑素瘤細(xì)胞增殖的分子機(jī)制。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1細(xì)胞株 人黑素瘤細(xì)胞系A(chǔ)375(貨號(hào)BNCC352140)及人黑素瘤細(xì)胞系MV3細(xì)胞系(貨號(hào)BNCC339913)購自北京北納創(chuàng)聯(lián)生物技術(shù)研究院,經(jīng)短串聯(lián)重復(fù)序列測序分析鑒定,A375及MV3 細(xì)胞不存在交叉污染,均為單一細(xì)胞系。

1.1.3主要試劑 抗體:兔抗人OPN3(貨號(hào)DF4877,中國affinity公司),兔抗人Hippo信號(hào)通路相關(guān)大腫瘤抑制激酶 1(large tumor suppressor 1,LATS1;貨號(hào)C66B5,美國Cell Signaling Technology公司),兔抗人磷酸化Yes相關(guān)蛋白(phospho-yes-associated protein, p-YAP;貨號(hào)D9W2I,美國Cell Signaling Technology公司),兔抗人ras 同系物家族成員 A(ras homolog family member A,RhoA;貨號(hào)67B9,美國Cell Signaling Technology公司),鼠抗人Yes相關(guān)蛋白(yes-associated protein, YAP;貨號(hào)sc-101199,美國Santa Cruz Biotechnology公司),鼠抗人GAPDH(貨號(hào)60004-1-Ig,中國武漢三鷹生物技術(shù)有限公司),辣根過氧化物酶(horseradish peroxidase, HRP)標(biāo)記的山羊抗鼠單克隆二抗(貨號(hào)ab6789,英國Abcam公司)以及 HRP標(biāo)記的山羊抗兔單克隆二抗(貨號(hào)ab6721,英國Abcam公司)。主要試劑盒:TRIzol(貨號(hào)15596026,美國Invitrogen公司),FastKing 一步法除基因組 cDNA 第一鏈合成預(yù)混試劑(貨號(hào)KR118,中國天根生化科技有限公司)、Talent熒光定量檢測試劑盒(貨號(hào)FP209,中國天根生化科技有限公司,);BeyoClickTM5-乙炔基-2′脫氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)-594細(xì)胞增殖檢測試劑盒(貨號(hào)C0078S,中國上海碧云天生物技術(shù)有限公司),細(xì)胞增殖與活性檢測試劑(cell counting kit-8,CCK-8)試劑盒(貨號(hào)GK10001,中國GLPBIO公司),PierceTMECL Western Blotting Substrate(貨號(hào)32106,美國賽默飛公司)。其他試劑:高糖杜氏改良Eagle培養(yǎng)基(dulbecco's modified eagle medium,DMEM;美國 gibco公司,貨號(hào)C11995500BT)、胎牛血清(貨號(hào)10099141C,美國 Gibco 公司);青鏈霉素混合液(100×;貨號(hào)P1400,北京索萊寶有限公司)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(100 mmol/L;貨號(hào)P0100,北京索萊寶有限公司)、高效放射免疫沉淀法緩沖液(radioimmunoprecipitation assay buffer,RIPA;貨號(hào)P0010,北京索萊寶公司)、免疫印跡法一抗稀釋液(貨號(hào)P0023A-100 mL,上海碧云天公司)、免疫印跡法二抗稀釋液(貨號(hào)P0023D-100 mL,上海碧云天公司);OPN1、OPN2、OPN3、OPN4、OPN5、GAPDH引物(上海生工生物工程股份有限公司)序列見表1。

表1 實(shí)時(shí)熒光定量PCR(real time quantitative PCR,RT-qPCR)序列Tab.1 RT-qPCR sequences
1.2 研究方法
1.2.1細(xì)胞培養(yǎng) 使用含10%胎牛血清及1%青鏈霉素的高糖DMEM培養(yǎng)基在37 ℃,5%CO2培養(yǎng)箱中培養(yǎng)A375、MV3細(xì)胞,隔日換液,細(xì)胞培養(yǎng)至80%~90%密度時(shí)使用含0.25%胰酶及0.01% EDTA的D-Hanks緩沖液消化傳代,取對(duì)數(shù)生長期細(xì)胞進(jìn)行實(shí)驗(yàn)。
1.2.2日光模擬器模擬UVA照射 將處于對(duì)數(shù)生長期的A375、MV3細(xì)胞使用胰酶消化鋪板,待細(xì)胞貼壁后進(jìn)行日光模擬器模擬UVA進(jìn)行照射,將細(xì)胞培養(yǎng)皿或培養(yǎng)板中的完全DMEM吸丟后換入預(yù)熱磷酸鹽緩沖液(PBS),使用光功率計(jì)測量照射強(qiáng)度,根據(jù)所需照射劑量計(jì)算照射時(shí)間(min)=[照射劑量(J/m2)]/(600×照射強(qiáng)度)。根據(jù)照射劑量將細(xì)胞分為Control組(0 J/m2)、UVA照射組(包括0.75×104、1.5×104、3×104、6×104及9×104J/m2)照射距離10 cm,電壓220 V,電流40 A。
1.2.3實(shí)時(shí)熒光定量 PCR(RT-qPCR)檢測 A375、MV3細(xì)胞OPN1、OPN2、OPN3、OPN4、OPN5 mRNA表達(dá)水平 TRIzol 法提取各組細(xì)胞總RNA,根據(jù)逆轉(zhuǎn)錄試劑盒說明書以42 ℃ 15 min,95℃ 3 min逆轉(zhuǎn)錄成cDNA,以cDNA 為模板進(jìn)行RT-qPCR實(shí)驗(yàn)。反應(yīng)體系:SYBR Green Select Master Mix 6.25 μL,正反向引物各 0.4 μL,cDNA 1 μL,雙蒸水 4.45 μL。熒光定量PCR程序:95 ℃ 3 min;95 ℃ 5 s,55 ℃ 15 s,共40個(gè)循壞;繪制擴(kuò)增曲線及溶解曲線。mRNA相對(duì)表達(dá)水平=2-ΔCT,以GAPDH為內(nèi)參計(jì)算基因相對(duì)表達(dá)水平。
1.2.4EdU實(shí)驗(yàn)檢測A375、MV3細(xì)胞增殖情況 將A375、MV3細(xì)胞按3×103個(gè)細(xì)胞/孔接種于96孔板,24 h待細(xì)胞貼壁后吸去培養(yǎng)基換磷酸鹽緩沖液(PBS),然后根據(jù)照射強(qiáng)度分組分別給予細(xì)胞0.75×104、1.5×104、3×104、6×104及9×104J/m2UVA輻照,輻照后將PBS更換為完全DMEM培養(yǎng)基繼續(xù)培養(yǎng)48 h后,每孔加入20 μmol/L EdU工作液,然后繼續(xù)培養(yǎng)2 h后,吸去培養(yǎng)基,PBS沖洗2次后用4%多聚甲醛固定細(xì)胞,去除固定液,每孔用100 μL含3% 牛血清白蛋白的PBS洗滌液洗滌細(xì)胞3次,每次5 min,去除洗滌液,每孔用100 μL含0.3% Triton-X 100的PBS室溫孵育15 min,去除通透液,每孔用洗滌液洗滌細(xì)胞3次,每次5 min,每孔加入Click反應(yīng)液50 μL室溫避光孵育30 min,每孔用100 μL洗滌液洗滌細(xì)胞3次,每次5 min,Hoechst 33342 按1∶1 000稀釋,每孔50 μL,室溫避光孵育10 min,每孔用100 μL洗滌液洗滌細(xì)胞3次,每次5 min,后于熒光顯微鏡594 nm激發(fā)光下觀察及拍照,使用Image J軟件計(jì)算陽性細(xì)胞率。將過表達(dá)及沉默OPN3的A375、MV3細(xì)胞按6×103個(gè)細(xì)胞/孔接種于24孔板,待24 h細(xì)胞貼壁后吸去培養(yǎng)基換PBS沖洗2次,用4%多聚甲醛固定細(xì)胞,按上述方法進(jìn)行后續(xù)操作。Merge圖像為紅色EdU陽性細(xì)胞及藍(lán)色Hoechst 33342染色細(xì)胞融合形成。計(jì)算細(xì)胞增殖率:紅色為EdU陽性細(xì)胞,藍(lán)色為Hoechst 33342染色細(xì)胞,增殖率為EdU陽性細(xì)胞與Hoechst 33342染色細(xì)胞的比率。
1.2.5CCK-8法檢測A375、MV3細(xì)胞增殖情況 將A375、MV3細(xì)胞按5×103個(gè)細(xì)胞/孔接種于96孔板,待24 h后細(xì)胞貼壁吸去培養(yǎng)基換PBS,然后進(jìn)行細(xì)胞UVA輻照,劑量分別為0.75×104、1.5×104、3×104、6×104及9×104J/m2,輻照后將PBS更換為完全DMEM培養(yǎng)基繼續(xù)培養(yǎng)48 h后,每孔加入10 μL CCK-8 溶液,37 ℃ 5%CO2培養(yǎng)箱繼續(xù)培養(yǎng)2 h后,將樣本置入酶標(biāo)儀中測量 450 nm 處的吸光度。將過表達(dá)及沉默OPN3的A375、MV3細(xì)胞按5×103個(gè)細(xì)胞/孔接種于96孔板,接種后0、24、48及72 h分別進(jìn)行CCK-8法檢測,按上述方法進(jìn)行后續(xù)操作。計(jì)算細(xì)胞存活率(%)= [(實(shí)驗(yàn)孔吸光度-空白孔吸光度)/(對(duì)照孔吸光度-空白孔吸光度)]×100。
1.2.6免疫印跡法(Western blot )檢測LATS1、p-YAP、YAP、RhoA蛋白表達(dá) 用含 1 mmol/L PMSF 的RIPA裂解液冰上裂解細(xì)胞,在旋渦振蕩器上反復(fù)充分振蕩,冰上裂解30 min,4 ℃ 12 000 r/min離心15 min分離上清液至1.5 mL EP管中,于NanoDropTM2000/2000c分光光度計(jì)測蛋白濃度后,將30 μg蛋白樣品加入5×變性上樣緩沖液于100 ℃變性10 min。將蛋白樣品進(jìn)行10%濃縮膠、 8%分離膠 SDS-PAGE 凝膠電泳并轉(zhuǎn)移到 PVDF 膜上,5%脫脂奶粉TBST緩沖液室溫封閉1 h后用一抗工作液(OPN3、LATS1、p-YAP、YAP、RhoA為1∶1 000稀釋,GAPDH為1∶10 000稀釋)4 ℃搖床慢搖孵育過夜,TBST洗膜4次,每次5 min,然后用相應(yīng)的兔鼠二抗工作液室溫下?lián)u床孵育 1 h,TBST洗膜6次,每次5 min。在PVDF膜上孵育發(fā)光底物,在bio-rad曝光成像系統(tǒng)檢測目的條帶,通過image J軟件分析各目的蛋白灰度值進(jìn)行統(tǒng)計(jì)分析。目的蛋白相對(duì)表達(dá)水平=目的蛋白分析灰度值/GAPDH分析灰度值。
1.2.7小干擾RNA( small interfering RNA,siRNA) 轉(zhuǎn)染 特異性siRNA為上海權(quán)陽生物科技有限公司合成,siRNA-OPN3序列為5′-GUCACCUUUACCUUCGUGUTT-3′,對(duì)照序列為5′-UUCUCCGAACGUGUCA CGUTT-3′。SiRNA細(xì)胞轉(zhuǎn)染:將處于對(duì)數(shù)生長期的A375、MV3細(xì)胞以 3×104細(xì)胞/孔接種在 6 孔板中,次日當(dāng)細(xì)胞貼壁并處于對(duì)數(shù)生長期時(shí),使用 Lipofectamine 2000 轉(zhuǎn)染試劑協(xié)助siRNA轉(zhuǎn)染細(xì)胞,使用siRNA-NC和siRNA-OPN3(終濃度為30 nmol/L)將細(xì)胞分為si-NC組和si-OPN3組,其中si-NC組為使用siRNA-NC轉(zhuǎn)染的對(duì)照組,si-OPN3組為使用siRNA-OPN3的沉默OPN3組。在無血清的Opti-MEM 培養(yǎng)基中進(jìn)行轉(zhuǎn)染后 6 h,將細(xì)胞培養(yǎng)基更改為含血清的培養(yǎng)基繼續(xù)培養(yǎng) 48 h,收取細(xì)胞進(jìn)行Western Blot驗(yàn)證OPN3是否成功沉默。
1.2.8慢病毒感染 OPN3特異性沉默慢病毒hU6-MCS-CBh-gcGFP-IRES-puromycin及過表達(dá)慢病毒Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin由上海吉?jiǎng)P基因醫(yī)學(xué)科技股份有限公司合成。將MV3細(xì)胞按3×105個(gè)細(xì)胞/孔接種于12孔板內(nèi),12~16 h細(xì)胞進(jìn)入對(duì)數(shù)生長期后進(jìn)行分別加入過表達(dá)及沉默OPN3病毒液,根據(jù)MOI=10,計(jì)算加入病毒病毒體積(μL)=MOI×細(xì)胞數(shù)/病毒滴度×1 000,LV-NC、LV-RNAi-NC作為對(duì)照,過表達(dá)及沉默OPN3組分別為LV-OPN3組和LV-RNAi-OPN3組。轉(zhuǎn)染48 h后加入10 mg/ L嘌呤霉素繼續(xù)培養(yǎng)篩選穩(wěn)定過表達(dá)及沉默黑素瘤細(xì)胞,于熒光顯微鏡下90%細(xì)胞可見綠色熒光后收取細(xì)胞進(jìn)行Western Blot檢測OPN3的表達(dá)變化。
1.2.9篩選關(guān)鍵通路 構(gòu)建過表達(dá)及沉默OPN3的MV3細(xì)胞系,通過qRT-PCR驗(yàn)證后將樣本進(jìn)行RNA-seq檢測,將過表達(dá)及沉默OPN3的交集差異基因的檢測結(jié)果進(jìn)入David網(wǎng)站[DAVID Functional Annotation Bioinformatics Microarray Analysis (ncifcrf.gov)]進(jìn)行KEGG數(shù)據(jù)庫分析,篩選P-adjust<0.05富集出相關(guān)信號(hào)通路進(jìn)行后續(xù)驗(yàn)證。
1.3 統(tǒng)計(jì)學(xué)分析
所有數(shù)據(jù)采用GraphPad Prism 9.3軟件進(jìn)行統(tǒng)計(jì)分析,所有數(shù)據(jù)以均數(shù)表示,每組組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 UVA可誘導(dǎo)黑素瘤細(xì)胞發(fā)生增殖
將MV3、A375細(xì)胞暴露于0.75×104、1.5×104、3×104、6×104及9×104J/m2UVA輻射下48 h進(jìn)行EdU實(shí)驗(yàn),結(jié)果如圖1所示。MV3細(xì)胞在1.5 ×104J/m2和3×104J/m2UVA輻照下細(xì)胞增殖率高于Control組,在6 ×104J/m2和9 ×104J/m2UVA輻照下細(xì)胞增殖率低于Control組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);在0.75×104J/m2UVA輻照下,細(xì)胞增殖率與Control組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。A375細(xì)胞在0.75×104、1.5×104及3×104J/m2UVA輻照下,細(xì)胞增殖率高于對(duì)照,在9×104J/m2UVA輻照下細(xì)胞增殖率低于Control組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);在6×104J/m2UVA輻照下細(xì)胞增殖率與Control組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。CCK-8法結(jié)果顯示,MV3細(xì)胞在1.5×104J/m2和3×104J/m2UVA照射后細(xì)胞存活率高于Control組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);A375細(xì)胞在1.5×104J/m2UVA照射后細(xì)胞存活率高于Control組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖1。提示黑素瘤細(xì)胞在適當(dāng)UVA劑量照射后可發(fā)生增殖。

注:A、B分別為EdU檢測下不同劑量UVA照射后的細(xì)胞增殖情況和各組細(xì)胞增殖率統(tǒng)計(jì),圖中紅色為EdU陽性細(xì)胞,藍(lán)色為Hoechst 33342染色細(xì)胞;C、D分別為CCK-8測定法檢測下不同UVA劑量照射后48 h的細(xì)胞存活率統(tǒng)計(jì)。(1)與Control組比較,P<0.05。
2.2 UVA促進(jìn)黑素瘤細(xì)胞中OPN3的表達(dá)
qRT-PCR檢測結(jié)果(圖2)發(fā)現(xiàn),在A375、MV3細(xì)胞系中OPN3 mRNA表達(dá)水平明顯高于其他OPN,差異有統(tǒng)計(jì)學(xué)意義(P<0. 05);MV3細(xì)胞在3×104J/m2照射劑量下OPN3表達(dá)增多(P<0.05),A375細(xì)胞在1.5×104J/m2和3×104J/m2UVA照射劑量下OPN3表達(dá)也增多,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。提提示OPN3在黑素瘤細(xì)胞中可能起重要作用,可能作為紫外線引起的黑素瘤細(xì)胞增殖的光感受器。
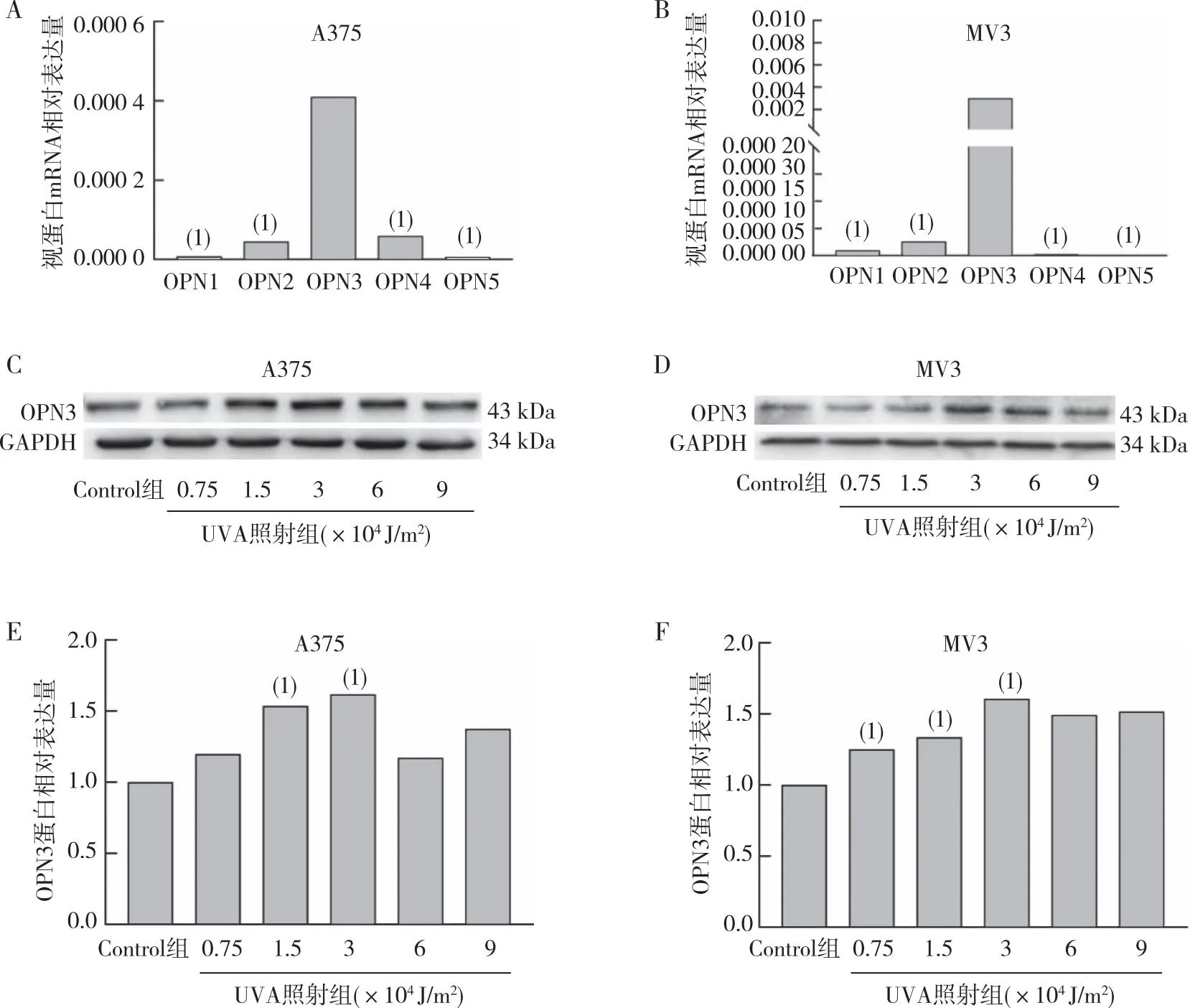
注:A、B分別為A375、MV3細(xì)胞中OPN1、OPN2、OPN3、OPN4及OPN5 mRNA相對(duì)表達(dá)量統(tǒng)計(jì),(1)與OPN3相比,P<0.05;C、D分別為不同劑量UVA照射后細(xì)胞中OPN3蛋白的表達(dá)情況;E、F不同劑量UVA照射后細(xì)胞中OPN3蛋白的表達(dá)統(tǒng)計(jì),(1)與Control組相比,P<0.05。
2.3 OPN3影響黑素瘤細(xì)胞的增殖功能
使用慢病毒感染構(gòu)建過表達(dá)及沉默OPN3的穩(wěn)轉(zhuǎn)MV3、A375細(xì)胞系,過表達(dá)及沉默OPN3后進(jìn)行qRT-PCR及Western blot實(shí)驗(yàn),結(jié)果顯示如圖3所示,OPN3 mRNA和蛋白表達(dá)水平 與Control組比較有明顯差異,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);提示成功過表達(dá)及沉默OPN3。過表達(dá)及沉默OPN3的穩(wěn)轉(zhuǎn)株分別采用EdU實(shí)驗(yàn)及CCK-8法檢測細(xì)胞的增殖率,可發(fā)現(xiàn)在EdU及CCK-8實(shí)驗(yàn)中過表達(dá)OPN3的細(xì)胞株增殖率高于Control組,沉默OPN3的細(xì)胞株增殖率低于Control組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖3。提示OPN3過表達(dá)及沉默可影響黑素瘤細(xì)胞的增殖功能。

注:A為通過RT-qPCR檢測OPN3 mRNA表達(dá)的過表達(dá)和沉默,B、C、D為蛋白質(zhì)印跡法檢測OPN3蛋白表達(dá)的過表達(dá)和沉默;E、F為CCK-8測定法檢測過表達(dá)和沉默OPN3 后24、48及72 h的OD值;G、H分別為EdU實(shí)驗(yàn)檢測下OPN3過表達(dá)和沉默后的增殖情況及對(duì)應(yīng)增殖率統(tǒng)計(jì);(1) 與LV-NC組比較,P<0.05;(2)與Si-NC組比較,P<0.05。
2.4 UVA通過OPN3引起細(xì)胞增殖
將成功沉默OPN3的A375、MV3細(xì)胞予3×104J/m2UVA照射后通過Western blot 檢測OPN3蛋白表達(dá)水平,發(fā)現(xiàn)在MV3細(xì)胞中LV-RNAi-OPN3組在UVA照射后OPN3蛋白表達(dá)水平增高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。進(jìn)行EdU實(shí)驗(yàn)及CCK-8法檢測細(xì)胞的增殖率及存活率,發(fā)現(xiàn)A375、MV3細(xì)胞中LV-RNAi-OPN3組增殖率及存活率低于LV-RNAi-NC組細(xì)胞,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與LV-RNAi-NC組比較,LV-RNAi-NC+UVA 3×104J/m2組細(xì)胞增殖率及存活率增高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與LV-RNAi-OPN3組比較,LV-RNAi-OPN3+UVA 3×104J/m2組細(xì)胞增殖率及存活率增高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),LV-RNAi-OPN3+UVA 3×104J/m2組增殖率及存活率低于LV-RNAi-NC+UVA 3×104J/m2組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖4。提示UVA通過OPN3引起細(xì)胞增殖。
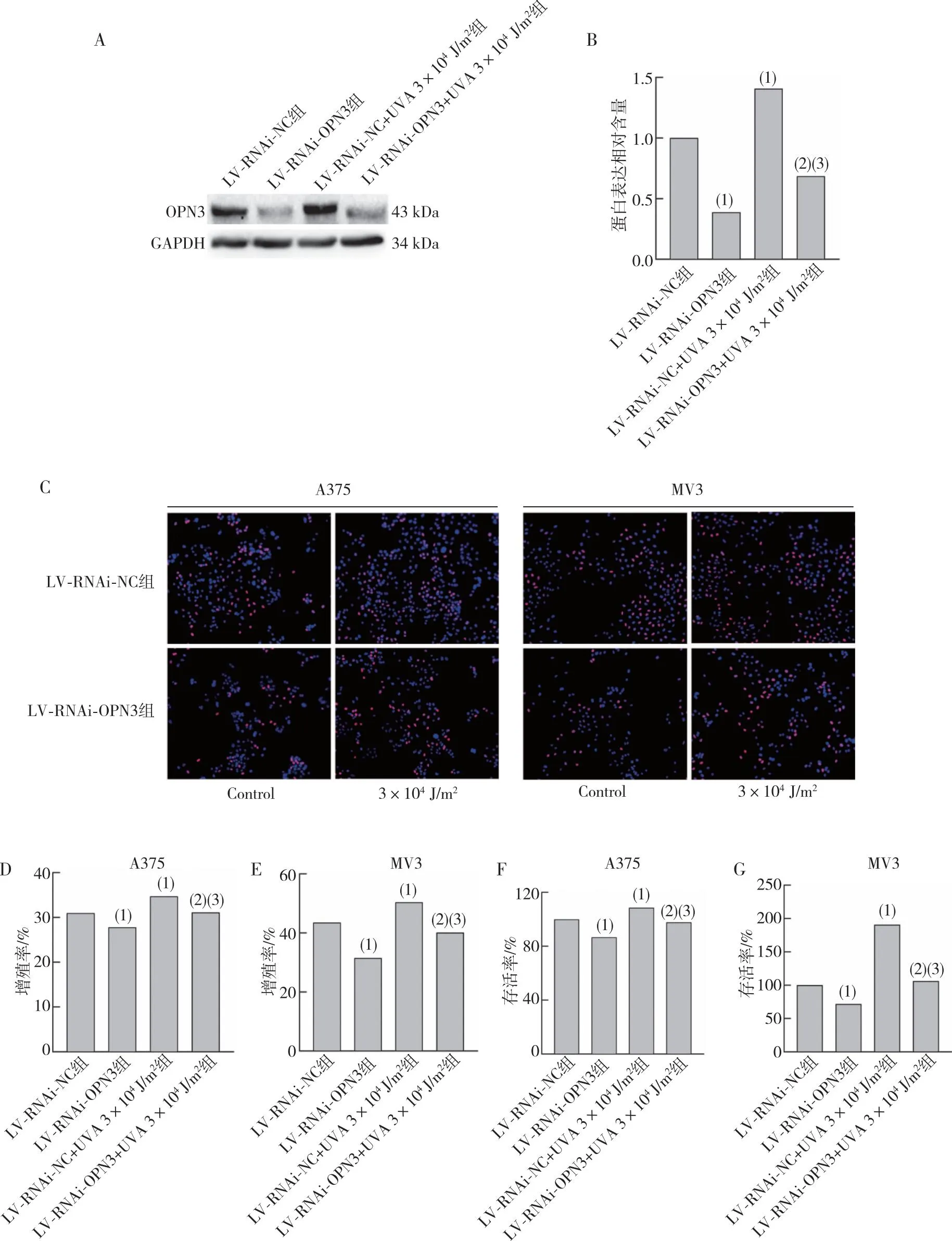
注:A、B為沉默OPN3的MV3細(xì)胞經(jīng)過3×104 J/m2 UVA照射后OPN3蛋白表達(dá)水平及統(tǒng)計(jì)結(jié)果,C、D、E為A375、MV3細(xì)胞通過EdU實(shí)驗(yàn)檢測沉默OPN3組細(xì)胞在經(jīng)過3×104 J/m2 UVA照射后照射后的細(xì)胞增殖率及統(tǒng)計(jì)結(jié)果,F、G為使用CCK-8法檢測沉默OPN3組細(xì)胞在經(jīng)過3×104 J/m2 UVA照射后的細(xì)胞存活率;(1) 與LV-RNAi-NC組比較,P<0.05;(2)與LV-RNAi-OPN3組比較,P<0.05;(3)與LV-RNAi-NC+UVA 3×104 J/m2組比較,P<0.05。
2.5 OPN3可影響Hippo通路調(diào)控細(xì)胞增殖
將MV3細(xì)胞分別過表達(dá)及沉默OPN3后進(jìn)行RNA-seq測序,將數(shù)據(jù)進(jìn)行交集分析可得到141個(gè)差異基因,將差異基因進(jìn)入David網(wǎng)站進(jìn)行KEGG分析,篩選P-adjust<0.05可以發(fā)現(xiàn)過表達(dá)及沉默差異基因富集出9條信號(hào)通路,其中-Log10(FDR)值最高的為Hippo信號(hào)通路,提示OPN3可能通過Hippo信號(hào)通路發(fā)揮作用。隨后分別在MV3、A375兩株細(xì)胞系中使用siRNA沉默OPN3,通過 Western blot 檢測了Hippo信號(hào)通路相關(guān)蛋白LATS1、p-YAP、YAP、RhoA的蛋白表達(dá)水平,與si-NC組相比,Si-OPN3 組中LATS1表達(dá)水平增高,p-YAP、RhoA表達(dá)水平降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖5。
3 討論
既往研究表明紫外線輻射對(duì)黑色素瘤的發(fā)生、發(fā)展有著重要作用[16-17]。盡管長期以來人們都知道暴露于紫外線輻射是導(dǎo)致黑素瘤發(fā)生的最常見的原因,但紫外線輻射在黑素瘤進(jìn)展中的確切作用仍然知之甚少,在分子、細(xì)胞及微環(huán)境水平上的研究還不夠[18]。既往研究證實(shí),UVA主要通過細(xì)胞黏附喪失[19-21]、細(xì)胞外基質(zhì)降解[23]以及皮膚微環(huán)境改變[16]等方式促進(jìn)黑色素瘤的進(jìn)展。OPNs是G蛋白偶聯(lián)受體超家族中的一員,最早在眼睛中被發(fā)現(xiàn),其在視覺過程中的光轉(zhuǎn)導(dǎo)中發(fā)揮關(guān)鍵作用[24]。已經(jīng)發(fā)現(xiàn) OPN3 與皮膚黑色素瘤、肺癌、肝細(xì)胞癌的腫瘤發(fā)生和臨床預(yù)后之間密切相關(guān)[12-15]。近年研究也發(fā)現(xiàn),OPN3可作為光感受器感受UVA誘導(dǎo)的人真皮成纖維細(xì)胞光老化[11],并且UVA可誘導(dǎo)黑素瘤細(xì)胞及結(jié)腸癌細(xì)胞在適當(dāng)劑量下發(fā)生增殖[22],在本研究中也觀察到紫外線可誘導(dǎo)黑素瘤細(xì)胞發(fā)生增殖,但感受UVA引起細(xì)胞增殖的光感受器尚未報(bào)道。
黑素瘤轉(zhuǎn)移的兩個(gè)重要特征是增殖和侵襲[23]。Pastila等[21]表明,單次8 J/cm2UVA可照射誘導(dǎo)小鼠黑色素瘤細(xì)胞鈣黏蛋白E向鈣黏蛋白N轉(zhuǎn)換,導(dǎo)致其轉(zhuǎn)移能力增強(qiáng)[21]。Kamenisch等[23]證實(shí),UVA照射通過增加乳酸鹽的生成直接上調(diào)黑素瘤細(xì)胞中的基質(zhì)金屬蛋白酶,從而增強(qiáng)黑素瘤的侵襲。Bald等[16]證明,紫外線照射損傷的角質(zhì)形成細(xì)胞,從而激活中性粒細(xì)胞釋放HMGB1,刺激黑色素瘤細(xì)胞向內(nèi)皮細(xì)胞遷移和向血管浸潤。本研究結(jié)果闡明OPN3 的轉(zhuǎn)錄表達(dá)水平和蛋白質(zhì)表達(dá)水平均明顯高于其他OPN,提示OPN3可能起重要作用。隨后參考上述報(bào)道的UVA輻照劑量,在本實(shí)驗(yàn)中設(shè)置劑量梯度檢測不同劑量下黑素瘤的增殖情況,發(fā)現(xiàn)在A375、MV3細(xì)胞中進(jìn)行1.5及3 cm/J2的UVA輻照劑量后細(xì)胞出現(xiàn)增殖,并且OPN3表達(dá)明顯增高,提示OPN3可能在UVA誘導(dǎo)的細(xì)胞增殖中起一定作用。
那么OPN3是否作為UVA光感受器直接參與黑素瘤細(xì)胞增殖過程有待進(jìn)一步研究。既往研究證明,沉默OPN3的表達(dá)可影響人成纖維細(xì)胞、人血管內(nèi)皮細(xì)胞的增殖功能[25-26];OPN3 的高表達(dá)與肢端雀斑樣黑色素瘤的轉(zhuǎn)移表型和預(yù)后不良有關(guān),在此研究中來自同一患者的七個(gè)配對(duì)樣本顯示,OPN3表達(dá)隨著從原發(fā)性到腹股溝淋巴結(jié)轉(zhuǎn)移肢端雀斑黑色素瘤的進(jìn)展而增加[14]。本研究通過過表達(dá)及沉默OPN3后可影響黑素瘤細(xì)胞的增殖能力,并且沉默OPN3后UVA引起細(xì)胞增殖的能力減弱。為進(jìn)一步探討OPN3調(diào)控黑素瘤細(xì)胞增殖的具體機(jī)制,通過過表達(dá)及沉默MV3細(xì)胞進(jìn)行RNA-seq測序結(jié)果篩選出141個(gè)差異基因, KEGG分析篩選差異基因富集信號(hào)通路9條,其中最主要的是Hippo信號(hào)通路。既往研究表明,G蛋白偶聯(lián)受體可以介導(dǎo)多種信號(hào)來調(diào)節(jié)Hippo 通路的活性[27]。本研究通過免疫印跡法檢測沉默OPN3后Hippo信號(hào)通路相關(guān)蛋白的變化,發(fā)現(xiàn)RhoA降低、LATS1增加、磷酸化蛋白p-YAP降低、YAP降低。既往研究表明,G蛋白偶聯(lián)受體可通過RhoA調(diào)節(jié)LATS激酶,從而調(diào)控YAP表達(dá)水平,YAP是Hippo通路下游關(guān)鍵的蛋白[28]。在小鼠中YAP的激活也會(huì)導(dǎo)致多種組織的過度增殖[29];YAP可促進(jìn)黑色素瘤細(xì)胞侵襲和自發(fā)轉(zhuǎn)移,是體外黑色素瘤細(xì)胞侵襲的必要條件和充分條件[30]。總而言之,本次研究發(fā)現(xiàn),抑制OPN3可調(diào)控RhoA誘導(dǎo)LATS1表達(dá)增加從而導(dǎo)致YAP減少,然而OPN3具體如何調(diào)節(jié)RhoA、LATS1以及影響YAP激活還值得進(jìn)一步研究。
綜上所述,本研究提示在UVA照射A375和MV3細(xì)胞后OPN3蛋白表達(dá)水平明顯升高,細(xì)胞增殖能力明顯增強(qiáng),而OPN3通過影響Hippo信號(hào)通路進(jìn)而調(diào)節(jié)黑素瘤細(xì)胞的增殖功能, OPN3可能為黑素瘤的預(yù)防及治療提供新的生物靶點(diǎn)和臨床見解。
 貴州醫(yī)科大學(xué)學(xué)報(bào)2024年1期
貴州醫(yī)科大學(xué)學(xué)報(bào)2024年1期
- 貴州醫(yī)科大學(xué)學(xué)報(bào)的其它文章
- 血漿纖溶酶原激活劑抑制物-1聯(lián)合C反應(yīng)蛋白與白蛋白比值對(duì)老年膿毒癥患者28天預(yù)后的評(píng)估價(jià)值*
- 滋腎育胎丸聯(lián)合優(yōu)思明對(duì)PCOS不孕癥患者子宮內(nèi)膜容受性、內(nèi)分泌指標(biāo)及妊娠結(jié)局的影響*
- 糖皮質(zhì)激素不同給藥方式對(duì)AECOPD患者臨床療效的影響*
- 貴陽市某三甲醫(yī)院婦產(chǎn)科醫(yī)護(hù)人員加速康復(fù)外科知信行現(xiàn)狀及講座的干預(yù)效果*
- MLMT與MLST在新生隱球菌基因分型中的應(yīng)用研究*
- 貴州老年流動(dòng)人口與常住人口心理健康狀況調(diào)查*
