NUSAP1在腫瘤相關巨噬細胞中的表達及對非小細胞肺癌的影響
李曉敏 于哲 曹珊珊 槐梅 韓洪涌
肺癌分為小細胞肺癌(small-cell lung cancer,SCLC)和非小細胞肺癌(non-small-cell lung cancer,NSCLC),其中非小細胞肺癌確診病例約占肺癌比例的80%~95%[1],在如此高的比例下,死亡率也使占據(jù)總死亡數(shù)的首位,所以在中國NSCLC可以說是首屈一指的腫瘤殺手。所以目前最緊要的任務時積極探索NSCLC發(fā)生發(fā)展的分子機制,對于改善肺癌患者生存率至關重要。M2型腫瘤相關巨噬細胞在非小細胞肺癌(NSCLC)腫瘤進展中與腫瘤生長呈正相關趨勢。在NSCLC中,NUSAP1敲低增加了B細胞易位基因2(BTG2)的表達,降低了磷酸肌醇3-激酶(PI3K)和磷酸化絲氨酸/蘇氨酸激酶(p-AKT)的表達水平,促進NSCLC細胞凋亡,抑制細胞增殖,細胞遷移和侵襲。腫瘤相關巨噬細胞(TAMs)是腫瘤微環(huán)境(TME)中含量最多的細胞對腫瘤生長中血管淋巴管的形成、降解血管基底膜以及細胞外基質(zhì)、抑制腫瘤免疫等多方面作用,對腫瘤生長遷移發(fā)揮促進作用[2]。由于M2巨噬細胞的不同亞型表現(xiàn)出不同的功能,所以M2型巨噬細胞可以很靈活的適應不同腫瘤環(huán)境分泌炎性因子,促進腫瘤生長。腫瘤相關巨噬細胞可以通過分泌基質(zhì)金屬蛋白酶(MMPs)、纖溶酶、絲氨酸蛋白酶等降解血管基底膜和細胞外基質(zhì),促進腫瘤細胞的轉移[3-5]。核仁紡錘體相關蛋白1(NUSAP1)是一種微管結合蛋白,它可以促進有絲分裂紡錘體微管的形成[6]。并且NUSAP1在許多惡性腫瘤中高表達,對有絲分裂早期和晚期起調(diào)節(jié)作用[7-9]。在此我們通過探究NUSAP1在腫瘤相關巨噬細胞中表達對非小細胞肺癌的影響以及分子機制。
1 材料與方法
1.1 材料與儀器 人來源非小細胞肺癌樣本均有華北石油管理局總醫(yī)院提供;C57BL/6雄性小鼠購自購自北京福貝斯公司;Lewis 肺癌(lewis lung carcinoma , LLC), 源于 C57 BL/6 小鼠,屬鼠源性的非小細胞肺癌細胞株,購于醫(yī)學科學院。試劑:pH值 6.0枸櫞酸緩沖液購自上海碧云天生物技術有限公司;BSA購自上海酶聯(lián)生物科技有限公司;DMEM培養(yǎng)基購自美國Gibco公司;DMEM:F12(C11330500BT)培養(yǎng)基購自美國Gibco公司;慢病毒及shRNA等生物制品均有生工生物工程(上海)股份有限公司合成;全營養(yǎng)培養(yǎng)基購自西班牙PharmaMar公司;RPMI-1640培養(yǎng)基購自美國Gibco公司;WB所用NUSAP1、p-PI3K、t-PI3K、MMP-9、GAPDH均購自美國Abcam公司。
1.2 方法
1.2.1 體外細胞共培養(yǎng)體系:共培養(yǎng)結束后分別收集小室上下腔M2和Lewis 細胞,進行后續(xù)蛋白質(zhì)分析實驗和細胞侵襲實驗。
1.2.1.1 流式細胞分選:NSCLC新鮮人體組織樣本采集后立即放入無血清培養(yǎng)基中,并在低溫儲存過的胰酶操作液中剪碎組織并經(jīng)過反復吹打分離,得到NSCLC癌組織與癌周組織粗細胞懸液。經(jīng)過100目、200目、600目不銹鋼細胞濾網(wǎng)過濾細胞懸液并將濾過的單細胞接種于含5%胎牛血清的全能培養(yǎng)基中,調(diào)整細胞數(shù)目5×104個細胞/孔。常規(guī)細胞培養(yǎng)48 h后使用Coulter Epics XLTM流式細胞儀進行流式分選篩選出腫瘤相關巨噬細胞群,使用DMEM培養(yǎng)基(含10%FBS、100 U/mL青霉素、100 μg/mL鏈霉素),37℃二氧化碳恒溫培養(yǎng)箱培養(yǎng)7 d,每48小時更換1次培養(yǎng)基。準備TAM細胞進行后續(xù)蛋白分析實驗。
1.2.1.2 細胞培養(yǎng):原代小鼠巨噬細胞分離方法[11]:從C57BL/6雄性小鼠股骨中分離骨髓細胞,并在DMEM中培養(yǎng)基中培養(yǎng)7 d,并添加10% FBS和50 U/mL青霉素、50 μg/mL鏈霉素。每48小時更換1次培養(yǎng)基,并清除污染或衰弱細胞。將培育獲得的健康骨髓細胞添加10% FBS 和100 U/mL rhM-CSF的DMEM中培養(yǎng)7 d,以獲得小鼠原代巨噬細胞。
1.2.1.3 細胞感染方法:巨噬細胞細胞接種于6孔細胞培養(yǎng)板,調(diào)整細胞濃度 1 × 105細胞/孔,常規(guī)細胞培養(yǎng)24 h。慢病毒載體包裝shRNA-NUSAP1組及對照shRNA(sh-NC)組,過表達慢病毒(OV-NUSAP1)和陰性對照(OV-NC)組以及過表達MMP-9(OV-MMP-9)組及其陰性對照(OV-NC)組。慢病毒感染48 h后western blot分析驗證慢病毒感染效率。
1.2.1.4 巨噬細胞細胞與Lewis 細胞系共培養(yǎng):人非小細胞肺癌細胞系Lewis 于10%胎牛血清和1%青霉素/鏈霉素的RPMI-1640培養(yǎng)基中維持培養(yǎng)。極化M2細胞于10% FBS 和100 U/mL rhM-CSF的DMEM培養(yǎng)基中維持培養(yǎng)。所有細胞均處于的37℃,5% CO2培養(yǎng)箱中生長。使用孔徑為0.4 μmol/L的聚對苯二甲酸乙二醇酯薄膜(Corning 3450)的Transwell腔室和24孔細胞培養(yǎng)板作為共培養(yǎng)系統(tǒng)。共培養(yǎng)M2和Lewis 細胞組,將shRNA-NUSAP1組、sh-NC組、ov-NUSAP1組、ov-NC組、sh-NC+OV-NC、shRNA-NUSAP1+OVMMP-9、shRNA-NUSAP1+OVNC以及Control組M2細胞置于小室上腔,Lewis 細胞置于小室下腔,每組每個腔室接種的細胞數(shù)量為5×104細胞。細胞培養(yǎng)使用全營養(yǎng)培養(yǎng)基,37℃,5%CO2全自動細胞培養(yǎng)箱培養(yǎng),倒置顯微鏡隨時觀察細胞狀態(tài)。
1.2.2 細胞劃痕遷移測試:將共培育的各組Lewis 細胞進行重懸,并接種于6孔板中,常規(guī)培養(yǎng)至細胞融合達90%時使用200 μL移液槍頭在各組孔板中央垂直劃破全層細胞。注意要洗掉脫落的細胞,并于全自動細胞培養(yǎng)箱中孵育,拍照記錄0 h、24 h細胞遷移情況。Image J軟件測量5個隨機位點的遷移距離,計算平均遷移率。遷移率=(0 h劃痕寬度-24 h劃痕寬度)/0 h劃痕寬度×100%。
1.2.3 Western blot檢測:收集培養(yǎng)至對數(shù)期細胞(細胞生長至70%)經(jīng)胰酶處理低溫離心機分離細胞,冰鎮(zhèn)環(huán)境添加RIPA裂解液分離獲得樣本總蛋白。經(jīng)BCA試劑盒檢測蛋白濃度,進行SDS-PAGE電泳分離等量的蛋白質(zhì)樣品并將蛋白凝膠電轉至PVDF膜上。使用含5%脫脂奶粉的TBST封閉天然抗原。一抗NUSAP1、p-PI3K、t-PI3K、MMP-9、GAPDH 4℃孵育過夜,二抗稀釋液室溫孵育。ECL顯色后Bio-Rad檢測系統(tǒng)檢(Bio-Rad V3 Western Workflow系統(tǒng))測蛋白質(zhì)信號。GAPDH作為內(nèi)參蛋白,分析各組分蛋白相對灰度值得到蛋白表達信息。

2 結果
2.1 Western blot檢測癌與癌周巨噬細胞中NUSAP1表達 在癌癥組織中巨噬細胞內(nèi)NUSAP1高表達(P<0.05);NUSAP1通過調(diào)控PI3K通路發(fā)揮作用,而PI3K通路活化是促進MMP家族蛋白表達的關鍵通路,故而進一步檢測PI3K與MMP-9的表達情況,結果顯示癌組織巨噬細胞內(nèi)磷酸化(p)PI3K表達水平及MMP-9表達量相較于癌周組織巨噬細胞內(nèi)相應蛋白表達量顯著升高(P<0.05)。見表1、2,圖1、2。

圖1 非小細胞肺癌患者癌組織與癌周組織巨噬細胞中NUSAP1蛋白表達圖

圖2 非小細胞肺癌患者癌組織和癌周組織巨噬細胞中p-PI3K、t-PI3K、MMP-9蛋白表達圖
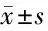
表1 Western blot檢測人癌周巨噬細胞和人癌(NSCLC)巨噬細胞中NUSAP1相對表達量
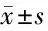
表2 Western blot檢測人癌周巨噬細胞和人癌(NSCLC)巨噬細胞中p-PI3K和MMP-9相對表達量
2.2 與人非小細胞肺癌Lewis 細胞系共培養(yǎng)的巨噬細胞當中NUSAP1、p-PI3K和MMP-9的相對表達量 采用巨噬細胞感染shRNA-NUSAP1及OV-UNSAP1使其敲低或過表達NUSAP1,并與肺癌細胞Lewis 共培養(yǎng)以模擬體內(nèi)腫瘤環(huán)境。結果顯示:Western blot檢測慢病轉染敲低NUSAP1后p-PI3K與MMP-9均表達降低,相反上調(diào)NUSAP1后p-PI3K與MMP-9表達均升高。見表3,圖3。

圖3 NUSAP1敲低和過表達對與人非小細胞肺癌Lewis細胞系共培養(yǎng)的巨噬細胞表達NUSAP1、p-PI3K、MMP-9蛋白表達量的影響
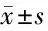
表3 Western blot檢測與人非小細胞肺癌Lewis 細胞系共培養(yǎng)的巨噬細胞當中NUSAP1、p-PI3K和MMP-9的相對表達量
2.3 Western blot檢測MMP-9過表達糾正NUSAP1敲低與人非小細胞肺癌Lewis 細胞系共培養(yǎng)的巨噬細胞當中NUSAP1、p-PI3K和MMP-9的相對表達量 為了確定MMP-9的表達對Lewis 細胞的影響,我們設計實驗在通過敲低NUSAP1的基礎上進行OV-MMP-9糾正實驗。Western blot結果證實MMP-9過表達(OV-MMP-9)抵消了由于敲低NUSAP1所造成的MMP-9表達水平降低。同時shRNA-NUSAP1+OV MMP-9組侵襲率明顯高于shRNA-NUSAP1+OVNC(P<0.05)組。見表4,圖4。

圖4 MMP-9過表達糾正NUSAP1敲低對與人非小細胞肺癌Lewis 細胞系共培養(yǎng)的巨噬細胞表達NUSAP1、MMP-9的影響
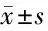
表4 Western blot檢測MMP-9過表達糾正NUSAP1敲低與人非小細胞肺癌Lewis 細胞系共培養(yǎng)的巨噬細胞當中NUSAP1、p-PI3K和MMP-9的相對表達量
2.4 細胞劃痕實驗檢測MMP-9過表達糾正NUSAP1敲低巨噬細胞與人非小細胞肺癌Lewis 細胞系共培養(yǎng)中Lewis 細胞遷移能力 通過對比可見shRNA NUSAP1(NUSAP1敲低)組比sh NUSAP1組的遷移寬度明顯增加,說明遷移能力受限;在敲低NUSAP1的基礎尚過表達MMP-9(OV-MMP-9)后遷移能力明顯變強,遷移寬度顯著變小。見表5,圖5。

圖5 MMP-9過表達糾正NUSAP1敲低巨噬細胞與人非小細胞肺癌Lewis 細胞系共培養(yǎng)中Lewis 細胞遷移能力的影響(×10)
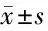
表5 細胞劃痕實驗檢測MMP-9過表達糾正NUSAP1敲低巨噬細胞與人非小細胞肺癌Lewis 細胞系共培養(yǎng)中Lewis 細胞遷移能力 μm,
3 討論
在世界范圍內(nèi),NSCLC是主要的癌癥死亡原因,并呈逐年增長的趨勢。目前對于NSCLC的常用治療手段為手術治療、放射治療和化學治療,根據(jù)病變范圍,這些手段可以單獨或聯(lián)合應用,但這些治療手段的不良反應也比較明顯,所以尋找更加安全有效的治療方法也日趨急迫。NUSAP1蛋白表達量升高與非小細胞癌的相關性也有相關報道[12]。在多文獻中也可查詢到NUSAP1蛋白與惡性腫瘤細胞的增殖和侵襲相關。例如上調(diào)NUSAP1通過PI3K/Akt信號通路促進腎母細胞瘤細胞的增殖、侵襲和遷移[13]、NUSAP1通過AMPK / PPARγ信號通路促進乳腺癌細胞的轉移[14]、NUSAP1表達增加與膀胱尿路上皮癌淋巴結轉移和生存預后相關[15]。在NSCLC中,NUSAP1的敲低也通過PI3K信號通路發(fā)揮促細胞凋亡作用[16]。PI3K信號通路是細胞內(nèi)重要的信號轉導通路,在細胞增殖和凋亡過程中發(fā)揮著重要的轉導作用,以p-PI3K活化的形式存在,通過調(diào)控下游相關基因的表達參與細胞增殖和凋亡過程,在非小細胞肺癌細胞增殖、遷移中發(fā)揮作用[17]。TAMs具有促進腫瘤的侵襲轉移和血管形成等作用,可以與腫瘤干細胞相互作用,促進腫瘤發(fā)生、轉移和耐藥。M2型TAMs與NSCLC的腫瘤分期、淋巴結轉移及胸膜侵犯密切相關,腫瘤間質(zhì)中高密度M2型TAMs浸潤是腫瘤預后不良的重要因素。也有研究顯示通過構建共培養(yǎng)模型驗證了M2對非小細胞肺癌侵襲的起促進作用[18]。不過,目前對于NSCLC中M2型TAMs的研究仍不完善。MMP-9是MMPs家族重要成員可通過分解細胞外基質(zhì)、影響細胞生長因子的激活、對新生血管的調(diào)節(jié)等,對腫瘤生長起促進作用[19]。據(jù)報道,MMPs中的多態(tài)性與非小細胞肺癌(NSCLC)具有相關性[20]。MMP-9在腫瘤樣本和癌癥患者血清中的上調(diào)表達與腫瘤分期呈正相關,且在多種癌癥組織中均有高表達現(xiàn)象,這表明MMP-9甚至可以被認為是癌癥患者的潛在預后標志物[21]。
在本實驗中通過巨噬細胞M2極化后與Lewis 細胞共培養(yǎng),構建體外模擬實驗探索NUSAP1對Lewis 細胞侵襲和遷移的影響。然而本次實驗也存在一定局限性,沒有進一步的研究PI3K信號通路的詳細機制,也需要進一步通過體內(nèi)相關實驗驗證腫瘤相關巨噬細胞中NUSAP1的調(diào)節(jié)作用。因此,我們將在下一次的實驗中增加體內(nèi)相關實驗,并進一步研究NUSAP1在NSCLC中作用機制。
綜上所述,本實驗結果表明TAM(腫瘤相關巨噬細胞)中的NUSAP1通過加速MMP-9的表達,促進非小細胞肺癌的遷移和侵襲。

