高敏丙型肝炎病毒核糖核酸在丙型肝炎中的診斷價值
戴倩梅,丁體龍△,代雪楓,于 莉,陳 策
中國人民解放軍聯勤保障部隊第九O二醫院:1.中心實驗室;2.感染科,安徽蚌埠 233015
丙型肝炎是較常見的病毒性肝炎之一,發病率僅次于乙型肝炎。丙型肝炎病毒核糖核酸(HCV-RNA)是判斷丙型肝炎活動性的最重要指標。由于技術原因,普通HCV-RNA的檢測下限一般為500 IU/mL,HCV-RNA陰性患者丙型肝炎病毒(HCV)仍可能處于活動期,傳染性也可能仍然較強,不能準確反映HCV在體內的復制狀態。高敏HCV-RNA檢測是近年來發展起來的一項新技術,將HCV-RNA的檢出下限提升至15 IU/mL,甚至10 IU/mL,為丙型肝炎的療程監測和治療終點的判斷提供了很大的幫助。有關高敏HCV-RNA研究的相關報道較少,本研究采用賽沛全自動醫用聚合酶鏈反應(PCR)分析系統檢測48例HCV抗體陽性患者和40例HCV抗體陰性的健康體檢者血清中HCV-RNA水平,計算靈敏度和特異度,與普通PCR法檢測的HCV-RNA和HCV核心抗原進行比較,探討高敏HCV-RNA在丙型肝炎診斷和病情監測中的應用價值,現將結果報道如下。
1 資料與方法
1.1一般資料 選擇2020年5月至2022年10月于本院門診及住院的48例慢性丙型肝炎患者作為觀察組,男32例,女16例;年齡11~78歲,平均(49.0±11.3)歲;HCV抗體均為陽性,符合《丙型肝炎防治指南(2015年更新版)》的診斷標準[1]。另選擇同期本院健康體檢中心40例健康體檢者作為對照組,其中男25例,女15例;年齡18~69歲,平均(47.6±12.6)歲;HCV抗體均為陰性。所有研究對象乙型肝炎病毒表面抗原、人類免疫缺陷病毒抗體、梅毒螺旋體抗體檢測結果均為陰性,無精神病史;1周內未使用抗病毒藥物和保肝降酶藥物。所有研究對象均充分了解并同意參與本研究,本研究開展前獲得本院醫學倫理委員會批準(倫理批號20200302001),對所有研究對象的個人資料和檢查結果予以保密。
1.2方法
1.2.1標本采集 采集所有研究對象空腹靜脈血5 mL,以2 000 r/min轉速分離血清,—80 ℃低溫冰箱保存待檢。
1.2.2高敏HCV-RNA檢測的性能驗證 參照CNAS-GL037《臨床化學定量檢驗程序性能驗證指南》(2019版)對賽沛全自動醫用PCR分析系統(GeneXpert)檢測HCV-RNA進行性能驗證。(1)正確度驗證:采用HCV血清(凍干)標準物質S3(4.40×105IU/mL)和陰性血漿制成驗證標本,稀釋成GeneXpert檢測單位,每個濃度單位10份標本,分別為HCV1(44 000 IU/mL)、HCV2(4 400 IU/mL)、HCV3(440 IU/mL)、HCV4(44 IU/mL)、HCV5(11 IU/mL),統計所有標本的檢測結果。(2)精密度驗證:采用HCV2作為精密度驗證標本,重復檢測3次,并計算精密度。(3)線性區間驗證:采用HCV血清(凍干)標準物質S3(4.40×105IU/mL)和陰性血漿制成驗證標本,稀釋成GeneXpert檢測單位,每個濃度單位3份標本,分別為HCV1(44 000 IU/mL)、HCV2(4 400 IU/mL)、HCV3(440 IU/mL)、HCV4(44 IU/mL)、HCV5(11 IU/mL),將檢測定值結果繪制成線性圖。將HCV1、HCV2、 HCV3、 HCV4、HCV5檢測定值的平均值取對數值后,與理論靶值結果作圖,驗證不同濃度的線性相關性。(4)可報告范圍驗證:采用HCV血清(凍干)標準物質S3(4.40×105IU/mL)和陰性血漿制成驗證標本,稀釋成GeneXpert檢測單位為HCV LoD(4.4 IU/mL)上機檢測,統計檢測結果。(5)特異度驗證:采用溶血血漿和脂血血漿將HCV血清(凍干)標準物質S3(4.40×105IU/mL)分別稀釋成4 400 IU/mL和440 IU/mL兩個可檢測濃度,每份標本重復檢測3次,計算平均值和標準差。(6)靈敏度驗證:采用HCV血清(凍干)標準物質S3(4.40×105IU/mL)和陰性血漿制成驗證標本,稀釋成GeneXpert檢測單位為HCV LoD(4.4 IU/mL)上機檢測,統計檢測結果。
1.2.3HCV抗體檢測 HCV抗體采用酶聯免疫吸附試驗檢測試劑盒檢測,試劑盒購自華大吉比愛生物技術有限公司,嚴格按照試劑盒說明書操作。
1.2.4高敏HCV-RNA檢測 GeneXpert購自美國賽沛(Cepheid AB)生物技術有限公司,型號為XVI Dx,所用試劑為Xpert HCV Viral Load,由瑞典賽沛(Cepheid AB)生物技術有限公司生產,檢測下限值為10 IU/mL。試驗前,對高敏HCV-RNA進行了性能驗證,性能驗證試驗所用標本購自北京康徹斯坦生物技術有限公司,HCV血清(凍干品)標準物質,國家標準物質證書:GBW(E)090142,濃度編號S3,靶值4.40×105IU/mL,不確定度為±0.5×105IU/mL,參考范圍為(3.90~4.90)×105IU/mL(對數值:5.59~5.69)。
1.2.5普通HCV-RNA檢測 采用廈門安普利生物技術有限公司的全自動核酸提純系統(Anadas9850)、熒光定量PCR分析系統及其配套的核酸提取試劑(批號:A105420220713)、擴增試劑(批號:A2020202220811),由專人嚴格按照設備及試劑盒說明書操作。
1.2.6HCV抗體及HCV核心抗原檢測 HCV抗體及HCV核心抗原檢測采用酶聯免疫吸附試驗,試劑盒由山東萊博生物科技有限公司提供,批號:202209005,由專人嚴格按照試劑盒說明書操作。
1.3統計學處理 采用簡明統計V14.0軟件進行數據處理及統計學分析。計數資料以百分率表示,組間比較采用χ2檢驗。線性范圍驗證采用不同濃度的標準品取對數與預期濃度對數值進行回歸方程,計算R2。以P<0.05為差異有統計學意義。
2 結 果
2.1高敏HCV-RNA性能驗證結果
2.1.1正確度驗證結果 HCV1、 HCV2、 HCV3、 HCV4、HCV5檢測結果的對數值與理論值偏差都在±0.5之內,符合標準物質說明書正確度要求(檢測值與理論值取對數偏差不超過±0.5)。
2.1.2精密度驗證結果 HCV2重復檢測3次結果分別為4 255、4 683、4 435 IU/mL,變異系數分別為-3%、6%、1%,都在±10%以內,檢測重復性良好,試劑盒精密度符合要求。
2.1.3線性區間驗證結果 不同濃度標準物質檢測結果計算得到回歸方程Y=1.022 5X—0.131 2,︱r︱>0.98,斜率>0.95驗證通過,線性預測結果可靠,一致性好。見圖1。GeneXpert檢測提供的說明書中表示HCV VL Assay在0.8~8.0 log 10 IU/mL范圍內呈線性,R2>0.997,在0.994~0.998以內,所有基因型均呈線性反應。
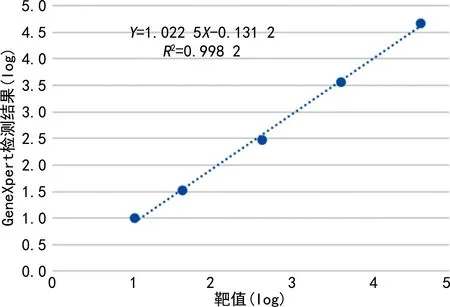
圖1 GeneXpert HCV-RNA檢測值與靶值線性相關關系
2.1.4可報告范圍驗證結果 HCV LoD(4.4 IU/mL)的檢測結果為HCV-RNA<10 IU/mL,GeneXpert可檢測濃度為104IU/mL,最大稀釋倍數為104倍,檢測上限值為108IU/mL。可報告范圍為10~108IU/mL,符合可報告范圍要求,最低檢出限和最高檢出限符合驗證標準。
2.1.5特異度驗證結果 溶血血漿和脂血血漿稀釋后的標準物質與定值比較,變異系數均在±10%以內,特異度高,試劑盒特異度驗證符合標準。
2.1.6靈敏度驗證結果 HCV LoD(4.4 IU/mL)的檢測結果為HCV-RNA<10 IU/mL,最低檢測下限為10 IU/mL,靈敏度驗證符合要求。
2.2高敏HCV-RNA與普通HCV-RNA在丙型肝炎診斷中的靈敏度及特異度比較 高敏HCV-RNA診斷靈敏度為91.67%,特異度為92.50%,診斷試驗四格表見表1,普通HCV-RNA 診斷靈敏度為68.75%,特異度為100.00%,診斷試驗四格表見表2。高敏HCV-RNA診斷丙型肝炎的靈敏度明顯高于普通HCV-RNA,特異度略低于普通HCV-RNA,差異有統計學意義(P<0.05)。

表1 高敏HCV-RNA診斷丙型肝炎結果(n)

表2 普通HCV-RNA診斷丙型肝炎結果(n)
2.3高敏HCV-RNA與HCV核心抗原在丙型肝炎診斷中的靈敏度及特異度比較 HCV核心抗原診斷靈敏度為66.67%,特異度為97.50%,診斷試驗四格表見表3。高敏HCV-RNA診斷丙型肝炎的靈敏度明顯高于HCV核心抗原,特異度略低于HCV核心抗原,差異有統計學意義(P<0.05)。

表3 HCV核心抗原診斷丙型肝炎結果(n)
3 討 論
HCV-RNA檢測結果主要用于判斷HCV的復制情況,是丙型肝炎傳染性強弱的重要標志,也可用于丙型肝炎抗病毒治療方案的選擇和治療后的預后判斷[2]。傳統的HCV-RNA檢測方法主要采用熒光定量PCR法檢測,檢測下限值一般為500 IU/mL。由于實驗環境中可能存在RNA酶而導致擴增抑制,造成假陰性結果,或者擴增產物的污染易造成假陽性結果[3]。目前常用的核酸提取方法分為磁珠提取法和柱提法。有研究發現,磁珠提取法比柱提法敏感度更高,尤其在低病毒載量標本的檢測中優勢明顯[4],具有較高的臨床應用價值。隨著分子診斷技術的不斷進步,HCV-RNA的檢測下限值不斷被刷新。GeneXpert運用半巢式定量PCR+微流控技術,整合標本制備、核酸擴增和檢測3個步驟于一個獨立的試劑盒中,并將其自動化,使標本處理既方便又快捷,整個標本處理過程可在2 min內處理完畢。核酸提取過程則在試劑盒的不同通道中完成,可最大限度地減少污染的發生。為了比較高敏HCV-RNA與普通HCV-RNA在診斷丙型肝炎中的靈敏度,課題組采用GeneXpert和廈門安普利Anadas9850同時檢測了48例HCV抗體陽性患者和40例HCV抗體陰性的健康體檢者的HCV-RNA,結果顯示高敏HCV-RNA的靈敏度明顯高于普通HCV-RNA,差異有統計學意義(P<0.05)。HCV核心抗原是丙型肝炎診斷的另一敏感指標,可能會通過影響基因組的表達調控,從而影響細胞的增殖分化[5]。本研究結果顯示,高敏HCV-RNA診斷丙型肝炎的靈敏度明顯高于HCV核心抗原,差異有統計學意義(P<0.05)。與鞠偉[6]的研究結論相類似,提示高敏HCV-RNA在丙型肝炎病原學診斷中優勢最為明顯。
由于常規PCR法檢測HCV的靈敏度較低,在臨床上易造成部分患者的漏診和漏治。歐洲肝病協會在有關丙型肝炎防治指南中推薦采用高敏HCV-RNA(檢測下限15 IU/mL)作為急慢性丙型肝炎的診斷指標[7],對于治療方案的擬訂和預后判斷具有重要的指導意義。目前,臨床上常用的丙型肝炎抗體檢測方法有酶聯免疫吸附試驗、金標法和化學發光法等[8]。一般來說,酶聯免疫吸附試驗的陽性檢出率比金標法高,具有較高的靈敏度和特異度,磁微粒化學發光法與酶聯免疫吸附試驗比較,其靈敏度更高,檢測時間更短,可提高臨床丙型肝炎檢測的準確度[9]。但由于窗口期的存在,HCV感染后3~4周才能檢測到HCV抗體,或者由于患者本身的免疫缺陷,導致機體不能產生抗體或抗體產生的量達不到檢測標準,都會導致HCV抗體假陰性,本研究對照組40例HCV抗體陰性者中,HCV-RNA陽性有3例,可能屬于上述情況。常規PCR檢測HCV-RNA,由于靈敏度不夠,在HCV抗體陰性患者中鑒別是否有HCV感染優勢不明顯。而高敏HCV-RNA則可在HCV急性感染的早期檢出,提示高敏HCV-RNA檢測在HCV抗體陰性人群中有較大意義,可用于義務獻血人群丙型肝炎的篩查。
HCV-RNA與丙氨酸氨基轉移酶(ALT)水平可能存在一定的相關性,有研究發現,血清ALT水平較高的患者,HCV-RNA相對較高,二者呈正相關(P<0.05)[10-12]。ALT主要存在于肝細胞中,可少量釋放于血液中,一般不高于40 IU/L。病毒性肝炎的急性期或藥物性肝炎導致肝細胞大量壞死時,ALT可大量釋放入血液中,所以ALT是反映肝細胞損傷的重要標志物。有研究發現HCV-RNA高水平組[(1×106~1×108)copy/mL]谷氨酰轉移酶(GGT)、天門冬氨酸氨基轉移酶(AST)、ALT等肝功能指標水平均明顯高于低水平組[(1×103~1×105)copy/mL]和中等水平組[(1×105~1×106)copy/mL][13]。也有學者認為,血清ALT水平與HCV-RNA存在相關關系,但ALT異常率與HCV-RNA之間無相關性[14]。HCV-RNA與ALT的關系將是本課題組未來的研究方向。
丙型肝炎HCV-RNA載量與多個血清學指標相關。據報道,HCV-RNA載量與T細胞亞群明顯相關,與CD8+水平呈正相關,與CD4+、CD4+/CD8+水平呈負相關[15-16];HCV-RNA載量與血清白細胞介素(IL)-6、IL-10、IL-32及免疫球蛋白(Ig)G、IgA、IgM水平存在顯著正相關[17];血常規中紅細胞分布寬度/血小板比值(RPR)及血小板/淋巴細胞比值(PLR)與慢性丙型肝炎肝硬化代償期的發生、纖維化進展程度相關[18-19];HCV-RNA水平與血小板計數(PLT)和血小板壓積(PCT)呈負相關,與血小板分布寬度(PDW)、平均血小板體積(MPV)和血小板比值指數評分(APRI)呈現正相關[20];抗核抗體的產生與丙型肝炎肝功能指標和HCV-RNA載量有關[21]。以上研究提示HCV-RNA與血清學指標聯合檢測有助于判斷丙型肝炎病情。
綜上所述,HCV-RNA一定程度上可反映肝臟的損傷情況,高敏HCV-RNA的靈敏度明顯高于普通HCV-RNA和HCV核心抗原檢測,在丙型肝炎的臨床診斷中具有十分重要的應用價值。

