中國近海洄游日本鰻鱺(Anguilla japonica)玻璃鰻腸道微生物菌群分析*
姜之信 李 慷 巴旭冰 曾祥標 劉利平
中國近海洄游日本鰻鱺()玻璃鰻腸道微生物菌群分析*
姜之信1, 2, 3李 慷1, 2, 3①巴旭冰1, 2, 3曾祥標1, 2, 3劉利平1, 2, 3①
(1. 中國-東盟海水養殖技術“一帶一路”聯合實驗室(上海) 上海海洋大學 上海 201306; 2. 上海海洋大學 水產種質資源發掘與利用教育部重點實驗室 上海 201306; 3. 上海海洋大學 上海水產養殖工程技術研究中心 上海 201306)
為研究長江口日本鰻鱺玻璃鰻腸道菌群的結構與多樣性特征, 初步探究野生鰻鱺仔魚的營養需求, 分別采集浙江臺州市、舟山市以及江蘇鹽城市鄰近海域的玻璃鰻樣品, 利用16S rDNA擴增子測序技術, 分析三個采樣點玻璃鰻腸道優勢菌群及營養代謝相關的功能差異。結果顯示, 三個采樣點的玻璃鰻腸道菌群均以變形菌門(Proteobacteria, 68.7%~82.0%)和放線菌門(Actinobacteria, 4.2%~19.0%)為主要優勢菌門。在屬分類水平上, 不動桿菌屬(, 12.4%~17.3%)和假單胞菌屬(, 8.07%~13.03%)豐度較高, 屬固定優勢菌屬。此外, 每個采樣點樣本中都含有豐富的獨特細菌群, 包括臺州市的氣單胞菌屬()、舟山市的內生單胞屬()和丙酸桿菌屬()以及鹽城市的嗜冷桿菌屬()和穩桿菌屬(), 推測是受采樣點不同水環境因素影響。不動桿菌、假單胞菌、內生單胞菌等菌屬在多種魚類腸道中有著消化蛋白質的功能, 氣單胞菌雖屬于纖維素降解菌, 也可分泌胞外蛋白酶。此外, 通過對玻璃鰻腸道菌群進行功能預測發現, 三個采樣點玻璃鰻菌群功能均以氨基酸的轉運和代謝占比最高, 推測玻璃鰻在洄游過程中可能攝取較多的蛋白質成分作為其餌料。初步探明了我國近海野生玻璃鰻腸道微生物菌群的多樣性組成, 可為研究野生鰻鱺仔魚攝食習慣及食物組成提供依據, 同時為日本鰻鱺人工繁殖仔稚魚的餌料設計提供參考。
日本鰻鱺; 幼魚; 腸道菌群; 微生物多樣性; 高通量測序
日本鰻鱺()是東亞重要的經濟魚類之一, 在我國、日本以及韓國廣泛養殖(劉利平等, 2017)。生活史復雜, 按照生長階段可分為: 受精卵、柳葉鰻、玻璃鰻、線鰻、黃鰻、銀鰻等多個階段(Manabe, 2011; Wahlberg, 2014)。自然界中捕撈到柳葉鰻的概率極低, 且多為偶然性獲得, 截至目前, 養殖成鰻所需的苗種(即玻璃鰻)完全依賴于天然捕撈, 鰻苗的大量捕撈導致日本鰻鱺資源銳減(Tsukamoto, 2009), 在2014年國際自然保護聯盟(IUCN)發表的“紅色名錄”中, 日本鰻鱺被認定為瀕危物種。雖然Tanaka研究團隊于2003年通過人工促熟獲得少量變態成功的玻璃鰻(Tanaka, 2003), 但幼魚成活率低、餌料成本高, 仍無法達到工廠化養殖的要求, 其重要因素在于開口餌料問題沒有得到有效的解決。研究表明, 自然界中的初孵仔魚可能以海洋顆粒有機物POM為食, 比如海洋雪(Miller, 2013), 通常認為海洋雪是深海中由有機物所組成的碎屑, 其成分包括: 已死或將死的動植物(浮游生物)、原生生物(如硅藻)、細菌、糞便顆粒、泥沙和塵土等(Alldredge, 1988)。由于自然界中的柳葉鰻獲得概率極低, 目前仍無足夠的樣品數量支持系統性的研究, 因此對其食物來源仍有爭議。
魚類腸道菌群可通過分泌消化酶等方式參與營養物質的代謝吸收, 而不同食性的魚類腸道菌群中存在不同的標志性微生物, 因此可通過研究野生鰻鱺幼魚的優勢腸道菌群及其功能, 推測其攝食習慣, 有助于確定其早期食物組成和促進開口餌料的研發。近年來, 高通量測序技術在醫學(Zhang, 2021)、水環境(Yang, 2022)以及家禽(Zhao, 2018)等領域得到了廣泛的應用, 是目前研究生境內微生物最常用的技術手段, 越來越多的學者將高通量測序技術應用于水產動物腸道微生物研究, Hsu等(2018)對成年日本鰻鱺、花鰻鱺()以及太平洋雙色鰻鱺()的腸道進行高通量測序, 發現鰻鱺腸道優勢菌屬為鯨桿菌屬()、梭菌屬()、希瓦氏菌屬()、不動桿菌屬()和擬桿菌屬()等。張金花等(2017)研究發現, 斑馬魚腸道優勢菌門為變形菌門(Proteobacteria)、放線菌門(Actinobacteria)、梭菌屬和藍細菌(Cyanobacteria)。
本研究通過對采集的野生玻璃鰻腸道微生物進行高通量測序, 分析不同洄游采樣點玻璃鰻腸道菌群結構特點, 明確腸道菌群多樣性變化及其腸道優勢菌, 分析玻璃鰻腸道消化功能及為可能的食物組成提供科學依據。
1 材料與方法
1.1 玻璃鰻樣本采集
根據玻璃鰻由南至北的洄游習性, 于2021年3~4月依次在浙江省臺州市(T)、浙江省舟山市(D)、江蘇省鹽城市(Y)用定置網捕集野生玻璃鰻樣品(表1), 每個采樣點隨機選取60條體表無傷、活力良好的玻璃鰻進行體質量、體長的測量, 隨后在無菌環境中進行解剖, 將已去除內容物的腸道保存在1.5 mL離心管中放于–80 °C冰箱, 用于后續試驗分析。
表1 玻璃鰻采樣點坐標信息

Tab.1 Geographical coordinates of glass eel sampling sites
1.2 DNA提取及高通量測序
每個采樣點隨機選取6條腸道樣品, 每2條腸道樣品進行混樣, 用于DNA提取和測序。樣品DNA提取參照海洋動物組織基因組DNA提取試劑盒(TIANGEN)說明書進行, 所提DNA濃度和純度經檢測(Nanodrop 2000)合格后送至廣東美格基因科技有限公司進行高通量測序。
1.3 高通量測序
基因擴增及測序過程如下: 根據16S rRNA基因序列特點和Illumina MiSeq平臺測序要求, 針對V3+V4區域設計特異引物338F: 5′-ACTCCTACG GGAGGCAGCA-3′, 806R: 5′-GGACTACHVGGGTW TCTAAT-3′進行PCR擴增(引物片段大小470 bp, 帶有barcode)。PCR反應體系(50 μL)為2x Premix Taq 25 μL, 正反引物(10 mmol/L)各1 μL, 樣品DNA (20 ng/μL) 50 ng, 補充Nuclease-free water至50 μL。PCR反應條件: 94 °C 5 min; 94 °C 30 s, 52 °C 30 s, 72 °C 30 s, 30個循環; 72 °C 10 min; 4 °C保存直至使用。使用 E.Z.N.A.?Gel Extraction Kit凝膠回收試劑盒回收PCR混合產物, T.E緩沖液洗脫回收目標DNA片段。建庫按照NEBNext?ULTRATMDNA Library Prep Kit for Illumina?試劑盒標準流程進行建庫操作, 完成后進行上機測序。
1.4 數據分析
實驗所得的形態學數據采用EXCEL 2019和SPSS 24.0軟件進行處理和單因素方差分析, 差異顯著者進行LSD多重比較, 設顯著性水平為<0.05。
對原始數據(Raw reads)進行雙端去雜、拼接和去嵌合體等質控處理, 獲得優質的有效序列(Valid tags), 以相似度97%的閾值為基礎來進行可操作分類單元歸類, 對OTUs代表序列進行物種注釋, 并與Silva數據庫序列信息比對, 獲得生物注釋。利用序列最少的樣本對OTUs豐度進行歸一化處理, 進行Alpha多樣性分析, 最后通過PICRUSt 2預測三個采樣點玻璃鰻腸道菌群功能, 根據COG數據庫進行功能推斷, 以上生物信息分析通過廣州美格生物云在線平臺(http://cloud.magigene.com/yomics)進行。
2 結果與分析
2.1 玻璃鰻的形態學指標
隨著采樣點緯度的增加, 玻璃鰻的體長和體質量呈逐漸增長趨勢, 但相鄰采樣點間體長、體質量差異不顯著(圖1,>0.05)。鹽城玻璃鰻樣品平均體長[(56.49±0.13) mm]大于舟山與臺州的樣品[(55.48± 0.29) mm, (54.98±0.05) mm]; 玻璃鰻平均體質量的結果相似, 由大至小分別為鹽城樣品[(0.12±0.01) g]、舟山樣品[(0.11±0.01) g]和臺州樣品[(0.10±0.08) g]。

圖1 洄游路徑上不同采樣點(T, D, Y)玻璃鰻樣品的平均體長和平均體重(n=60)
注: 字母T、D、Y代表采樣點臺州、舟山、鹽城; 圖中不同字母表示差異顯著(<0.05)
2.2 基于16S rRNA測序的腸道微生物菌群多樣性
本研究基于16S rRNA高通量測序技術對日本鰻鱺玻璃鰻腸道微生物V3+V4區進行分析, 9組樣品總計獲得122 241條有效數據(表1), 根據97%的相似度進行OTU分類, 獲得327個OTUs, 臺州、舟山和鹽城分別得到112、152、171個OTUs, 其中三個采樣點共有的OTUs數目為33個, 共涉及19門33綱85目133科184屬。
稀釋性曲線可以直觀地反映高通量測序數據的準確性以及菌群的多樣性, 本實驗對所有樣本多種α多樣性指數進行了分析, 具體結果如圖2所示, Shannon指數曲線逐漸趨于平坦, 雖然有的分組數據量較少, 但都已經過轉折點進入平臺期, 繼續增加數據量, 只會出現少量新物種, 說明測序數據量合理, 實驗結果可信。覆蓋率指數曲線顯示所有樣本的覆蓋率均在95%以上, 表明測序數據具有較好的覆蓋性。
表2 日本鰻鱺玻璃鰻腸道菌群樣品測序數據統計

Tab.2 Sequencing and data processing of intestinal microorganisms from glass eel (A. japonica)

圖2 洄游路徑上不同采樣點(T, D, Y)玻璃鰻腸道微生物的OTU α多樣性指數
注: 字母T、D、Y代表采樣點臺州、舟山、鹽城
2.3 腸道微生物群落組成分析
根據物種注釋結果在門水平對物種相對豐度進行統計分析, 由圖3可知, 相對豐度居前5的物種包括變形菌門、放線菌門、厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)以及綠彎菌門(Chloroflexi)。三個采樣點均以變形菌門和放線菌門為優勢菌門, 其中變形菌門、放線菌門、擬桿菌門、厚壁菌門的總豐度占細菌總量的95%以上, 舟山采樣點的厚壁菌門以及鹽城采樣點的擬桿菌門豐度較其他兩個采樣點高, 但彼此間差異不顯著(>0.05)。
在屬水平上對每個樣品的菌群結構及分布進行統計分析, 樣品組豐度前5的菌屬包括: 變形桿菌門下的不動桿菌屬、氣單胞菌屬()、假單胞菌屬()、內生單胞屬(), 放線菌門下的丙酸桿菌屬()等菌屬。臺州微生物以不動桿菌(17.33%)、氣單胞菌(35.09%)、假單胞菌(11.64%)、腸桿菌屬(, 4.48%)、丙酸桿菌(2.97%)的豐度較高, 為優勢菌屬; 舟山以不動桿菌(13.52%)、內生單胞屬(16.91%)、丙酸桿菌(11.39%)、假單胞菌屬(8.06%)、鞘氨醇單胞菌屬(, 7.88%)的豐度較高, 為優勢菌屬; 鹽城以不動桿菌(12.36%)、假單胞菌(13.03%)、嗜冷桿菌屬(, 12.91%)、穩桿菌屬(, 9.88%, 屬于擬桿菌門)、鹽單胞菌屬(, 8.48%)的豐度較高, 為優勢菌屬。三個采樣點共享以不動桿菌屬和假單胞菌屬為優勢菌群的微生物, 屬于玻璃鰻的固定優勢菌群。

圖3 洄游路徑上不同采樣點(臺州、舟山、鹽城)玻璃鰻腸道細菌主要類群的組成
注: 相對占比低于0.01%的菌群以及數據庫中沒有找到對應于該序列分類信息的菌群均歸類于其他
2.4 腸道共有及特有微生物菌群分析
通過對不同洄游采樣點玻璃鰻腸道微生物不同分類等級進行分析, 得出各個采樣點中玻璃鰻腸道共有和特有的腸道菌群的種類和數量, 便于我們比較不同洄游采樣點的相似性和差異性。如圖4所示, 臺州(T)、舟山(D)、鹽城(Y)玻璃鰻腸道微生物菌群樣品中共有的OTUs數量為33種, 臺州特有的OTU數目為61種, 舟山特有的OTUs數目為81種, 鹽城特有的OTUs數目為110種。
不同洄游采樣點間共享的屬水平的微生物菌群包括不動桿菌、假單胞菌、丙酸桿菌、氣單胞菌等菌群(圖5)。不動桿菌屬以及假單胞菌屬在三個采樣點玻璃鰻腸道中均占有較高的豐度, 氣單胞菌屬僅在臺州采樣點占有較高的豐度(臺州、舟山、鹽城占比分別為35.09%、3.27%、1.58%), 而舟山采樣點內生單胞菌屬以及丙酸桿菌屬豐度較其余兩地高, 鹽城采樣點也有高于其余兩地的菌群, 如嗜冷桿菌屬、穩桿菌屬()等。因此, 玻璃鰻在洄游過程中共享一個核心菌群, 但不同采樣點間菌群的占比豐度略有差異。
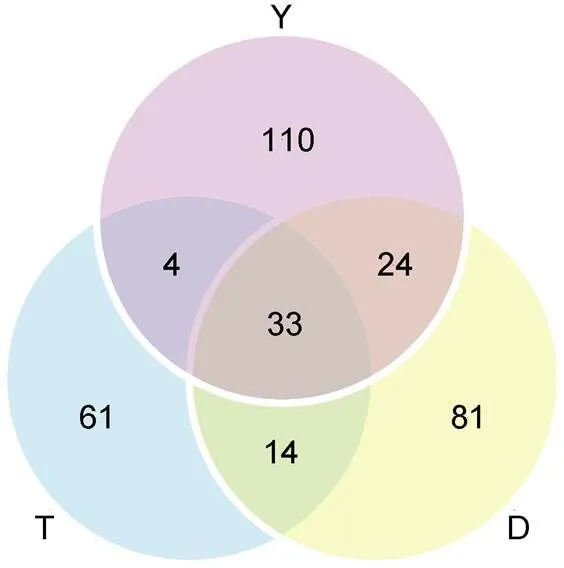
圖4 洄游路徑上不同采樣點(T, D, Y)玻璃鰻腸道內共有和獨特的OTU數目
注: 字母T、D、Y代表采樣采樣點臺州、舟山、鹽城
同時, 不同洄游采樣點玻璃鰻腸道中具有多種特有的腸道菌群。如圖5所示, 臺州特有的腸道菌群為產丙酸細胞菌屬()、微白霜菌屬()、聚糖菌屬()等; 舟山豐度較高的腸道菌群為異常球菌屬()、、羅斯氏菌屬()等; 鹽城以默里特氏菌屬()、、海生桿菌屬()等特有菌屬的豐度較高。同樣, 三個采樣點玻璃鰻腸道中有多種菌群僅在T和D采樣點腸道中存在, 如放線菌門下的放線菌屬()和厚壁菌門下的鏈球菌屬(); 而乳桿菌()、鹽單胞菌屬等僅在D和Y采樣點腸道中發現, 微桿菌屬()、假蒼白桿菌()等多個菌群在T和Y中占據較低的豐度, 在D采樣點并未檢測到。不同采樣點玻璃鰻腸道中特有的微生物菌群種類多樣, 但其菌群豐度非常低, 占比均未超過1%。
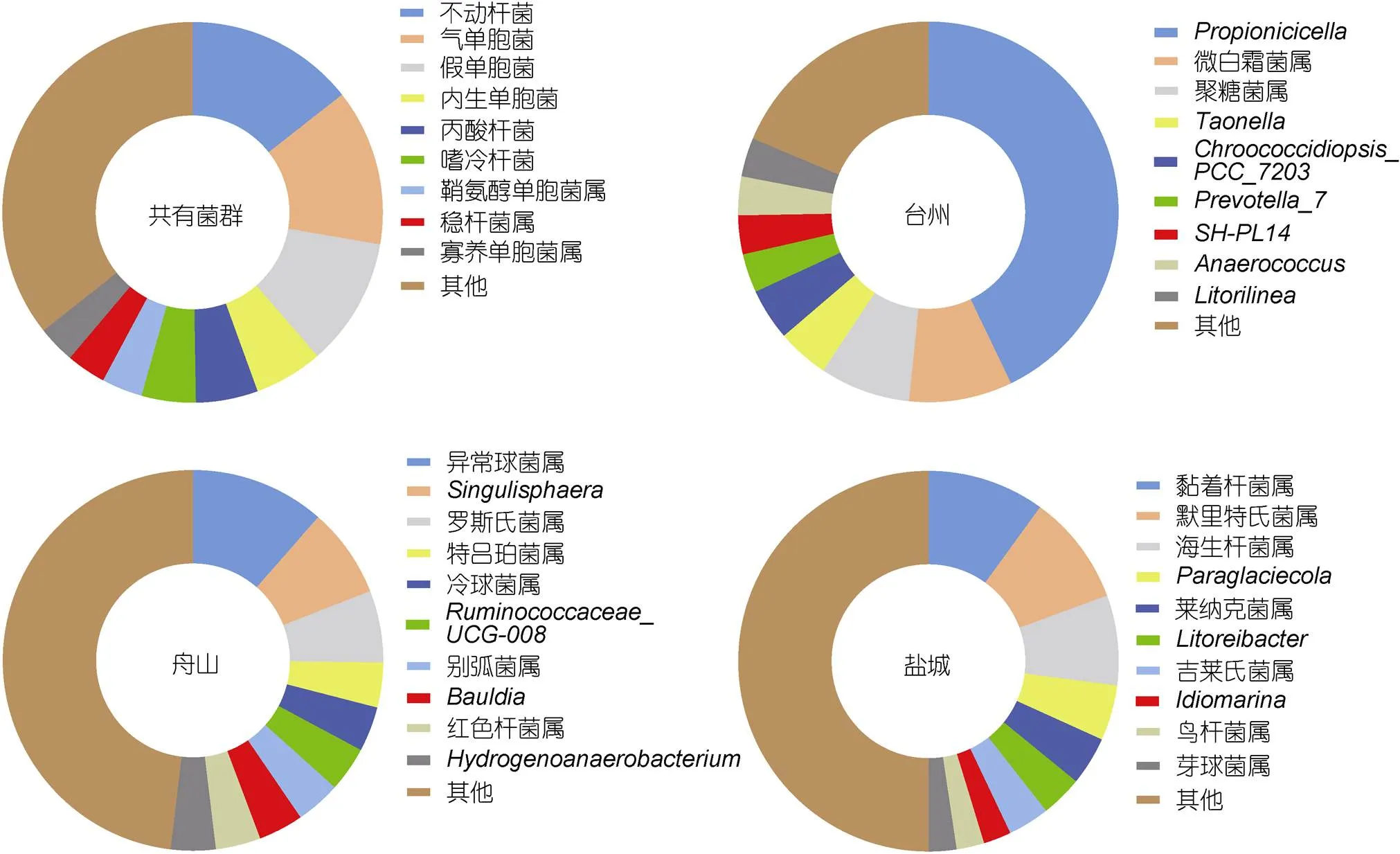
圖5 洄游路徑上不同采樣點(T, D, Y)玻璃鰻腸道內共有和獨特的微生物菌群
注: 字母T、D、Y代表采樣采樣點臺州、舟山、鹽城
2.5 腸道菌群功能預測
本研究利用 PICRUSt2對三個采樣點的玻璃鰻腸道微生物進行功能預測分析。在一級功能層面上,各采樣點玻璃鰻腸道菌群的主要功能包括代謝(Metabolism)、細胞加工(Cellular processes and signaling)、信息存儲和處理(Information storage and processing)和缺失的功能描述(Poorly characterized)等;在二級功能層面上, 對相對豐度大于等于0.01%的腸道菌群進行功能注釋和聚類, 共獲得24個功能類別(圖6)。結果顯示, 在代謝類別中, 三個采樣點玻璃鰻腸道均以氨基酸運輸和代謝(Amino acid transport and metabolism)功能占比最高, 而碳水化合物的轉運和代謝(Carbohydrate transport and metabolism)、脂質的轉運和代謝(Lipid transport and metabolism)功能分別位于第八位和第十一位。
3 討論
本研究結果顯示, 洄游路徑上不同采樣點玻璃鰻腸道菌群主要由變形菌門、放線菌門、厚壁菌門和擬桿菌門組成。變形菌門是細菌中最大的一門, 也是本試驗玻璃鰻腸道豐度最高的菌群, 占比68.7%~ 82.0%, 與大菱鲆(邢孟欣, 2013)和牙鲆仔稚魚(劉增新, 2017)等魚類腸道菌群研究結果相似。通過測序發現, 玻璃鰻腸道中的變形菌門包括不動桿菌、氣單胞菌以及內生單胞菌屬等, 其中三個采樣點占比最高的腸道菌屬為不動桿菌屬(12.4%~17.3%)。Iida等(1984)通過對未進食的日本鰻鱺鰻苗進行餌料投喂實驗, 發現隨著餌料由顫蚓(sp.)逐漸轉變為配方飼料時, 不動桿菌屬和氣單胞菌屬占比上升, 可見不動桿菌可能為日本鰻鱺的優勢固有菌群, 也是銀鯽()、青魚()、鳙()等淡水魚中的優勢菌屬, 可產生抑制鰻弧菌的物質, 有效預防病原菌感染(Spanggaard, 2001; 張涵等, 2013), 具有產生胞外蛋白酶的能力(鄧智明, 2018)。胞外蛋白酶可直接消化、促進吸收蛋白質, 增強魚類機體對營養物質的攝取(Ray, 2012; 鄧智明, 2018), 玻璃鰻腸道中不動桿菌的存在為其降解蛋白質提供可能性。部分假單胞菌屬可作為腸道益生菌改善水產動物的營養消化、生長以及提升動物的抗逆能力(Pérez, 2010)。研究人員發現, 草魚和鯽魚腸道內的假單胞菌可分泌胞外消化酶, 如蛋白酶、脂肪酶、淀粉酶和纖維素酶, 促進了兩種魚對餌料的消化吸收(馮雪等, 2008)。軍曹魚體內也分離出具有較強的產蛋白酶能力的假單胞菌(王瑞旋等, 2008), 由此可見, 假單胞菌的一些種類對營養物質尤其是蛋白質具有分解作用。舟山樣品中, 菌群豐度較高的內生單胞菌屬(占比16.9%)也同樣具有分解蛋白質的功能, 其通常存在于宿主組織內的細胞聚集體中, 參與宿主相關的蛋白質和碳水化合物運輸和循環(Neave, 2016)。氣單胞菌是一類主要存在于魚類腸道中的纖維素降解菌(Talwar, 2018), 尤其是草魚等草食性魚類的核心菌群(Wu, 2012), 在臺州的腸道樣品中, 氣單胞菌屬的豐度占比為35.1%, 顯著超過其他兩個采樣點的菌群豐度, 可能是玻璃鰻在臺州攝取較多的浮游植物或受到水環境中微生物的影響導致的這一結果(孟曉林等, 2019)。在虹鱒腸道中分離出可分泌高效蛋白酶的氣單胞菌(Koca, 2015), 表明部分種類的氣單胞菌也具有消化蛋白質的功能。通過對腸道菌群進行功能預測發現, 氨基酸的轉運和代謝占據最高的豐度占比(8.7%~10.0%), 證明玻璃鰻在洄游途中可能攝取以蛋白質為主的餌料作為其能量來源。

圖6 不同洄游采樣點(T, D, Y)玻璃鰻腸道微生物功能預測圖
注: 字母T、D、Y代表采樣采樣點臺州、舟山、鹽城
厚壁菌門含有諸多有益菌, 如乳桿菌和鏈球菌等, 有助于機體對碳水化合物的利用(Nuriel-Ohayon, 2016; 田娟等, 2022)。本研究在玻璃鰻腸道中檢測到乳桿菌和鏈球菌, 但三個采樣點略有差異, 其中臺州采樣點未檢測到乳桿菌屬, 鹽城采樣點未發現鏈球菌屬, 而舟山采樣點兩者均有發現, 但豐度均較低, 占比不到1%。厚壁菌門的明串珠菌屬()和放線菌門的放線菌屬也屬于纖維素降解菌(Talwar, 2018; 馮雪等, 2018)。有研究表明, 放線菌門中的紅球菌屬()能夠分泌大量的活性物質, 可利用有機化合物作為能源和碳源, 同時可以降解藻類物質(李小彩, 2007; 邱孜博等, 2016)。本實驗玻璃鰻腸道中以上幾種細菌豐度較低, 推測可能是玻璃鰻在洄游過程中對纖維素類餌料的需求較蛋白質類餌料的數量少, 而腸道菌群功能預測結果中, 氨基酸轉運與代謝的占比高于碳水化合物和脂質的占比也驗證了此觀點。受采樣點環境的影響, 本實驗不同采樣點樣品有些特異菌屬, 此類現象在水生動物中比較常見, 比如羅非魚養殖, 通過對兩種不同養殖環境下的羅非魚腸道微生物進行比較分析, 發現稻田組羅非魚腸道菌群豐度較高的為鯨桿菌屬、幽門螺旋菌屬()和羅姆布茨菌屬(), 而池塘組羅非魚豐度較高的菌群為鯨桿菌屬、腸弧菌屬()和鄰單胞菌屬() (張婧怡等, 2020)。不同生長環境也會影響魚類腸道菌群的物種組成及豐度, 因此推測是三個采樣點海水環境差異, 導致玻璃鰻腸道中含有較多相對豐度占比很低的特有菌群。
玻璃鰻腸道菌群中除消化功能的細菌外, 優勢菌屬中也包含部分致病菌屬, 如常見的氣單胞菌屬和不動桿菌屬(Thanh, 2021; 孫莉, 2015)。氣單胞菌屬中已報道的維氏氣單胞菌() (楊求華, 2012)和嗜水氣單胞菌() (張偉妮, 2010), 以及不動桿菌屬中的鮑曼不動桿菌() (孫云等, 2020)便是鰻鱺養殖中常見的致病菌。2019年海南海口某養殖場暴發的美洲鰻細菌性疾病, 死亡率高達80%, 便是由鮑曼不動桿菌引起的(孫云等, 2020)。2010年廈門某日本鰻鱺養殖場出現大面積發病情況, 是維氏氣單胞菌引發(楊求華等, 2012)。推測本實驗中腸道所含致病菌也可能來源于水體環境。
綜上所述, 三個采樣點的玻璃鰻共享以不動桿菌和假單胞菌為主的核心菌群, 其在洄游過程中可能主要攝取以蛋白質含量較高的餌料, 對碳水化合物以及脂質成分需求量相對較少。海洋中的浮游植物和浮游動物均含有蛋白質(楊宇峰等, 2000), 且浮游動物蛋白質含量遠遠高于浮游植物, 因此玻璃鰻在洄游過程中可能更偏向于以浮游動物為攝食對象, 該研究可為今后日本鰻鱺仔稚魚餌料的研發提供參考。
4 結論
本研究表明, 三個采樣點玻璃鰻腸道菌群共享不動桿菌屬和假單胞菌屬等核心菌群, 受采樣點環境的影響, 不同采樣點玻璃鰻腸道中均含有豐度較高的特殊菌群, 如臺州市的氣單胞菌、舟山市的內生單胞屬和丙酸桿菌以及鹽城市的嗜冷桿菌屬和穩桿菌屬等, 不動桿菌屬、假單胞菌屬、氣單胞菌屬以及內生單胞菌屬在其他魚類腸道中被證實有著消化蛋白質的功能, 推測玻璃鰻在洄游過程中攝取較多的蛋白質氨基酸作為其主要的能量來源。
王瑞旋, 馮娟, 2008. 軍曹魚腸道細菌及其產酶能力的研究[J]. 海洋環境科學, 27(4): 309-312.
鄧智明, 2018. 野生與養殖圓口銅魚腸道微生物研究[D]. 南京: 南京農業大學.
田娟, 謝寧寧, 肖文富, 等, 2022. 滅活植物乳桿菌及其代謝物對草魚生長性能和腸道健康的影響[J]. 水產學報, 46(10): 1980-1991.
馮雪, 吳志新, 祝東梅, 等, 2008. 草魚和銀鯽腸道產消化酶細菌的研究[J]. 淡水漁業, 38(3): 51-57.
邢孟欣, 2013. 養殖大菱鲆腸道微生物多樣性及功能分析[D]. 青島: 中國科學院研究生院(海洋研究所).
劉利平, 劉登攀, 蒲金成, 等, 2017. 日本鰻鱺仔魚的開口餌料和行為特征[J]. 水產學報, 41(5): 703-710.
劉增新, 2017. 牙鲆()仔稚幼魚腸道菌群結構變化及定植規律研究[D]. 上海: 上海海洋大學.
孫云, 何明旺, 張盼盼, 等, 2020. 美洲鰻鱺致病性鮑曼不動桿菌的分離、鑒定及致病性分析[J]. 水產學報, 44(9): 1561-1571.
孫莉, 2015. 鮑曼不動桿菌血流感染的流行特征和危險因素分析[D]. 杭州: 浙江大學.
李小彩, 2007. 一株紅球菌的溶藻特性及應用研究[D]. 濟南: 山東大學.
楊宇峰, 黃祥飛, 2000. 浮游動物生態學研究進展[J]. 湖泊科學, 12(1): 81-89.
楊求華, 郭松林, 關瑞章, 等, 2012. 鰻鱺病原性維氏氣單胞菌的分離與鑒定[J]. 生物技術通報, (7): 134-139.
邱孜博, 汪榮, 張楊, 等, 2016. 紅球菌及其生物降解作用研究進展[J]. 食品科學, 37(7): 254-258.
張偉妮, 朱志華, 陳智偉, 等, 2010. 日本鰻鱺腐皮病病原菌的分離及鑒定[J]. 淡水漁業, 40(2): 41-46.
張金花, 桂芳, 司婧, 等, 2017. 斑馬魚腸道微生物的研究進展[J]. 中國實驗動物學報, 25(6): 637-642.
張涵, 周濤, 王巖, 2013. 綜合養殖池塘中三角帆蚌和魚類腸道細菌的組成[J]. 水生生物學報, 37(5): 824-835.
張婧怡, 肖俊, 梁軍能, 等, 2020. 不同養殖環境下羅非魚腸道微生物的比較分析[J]. 廣西科學院學報, 36(2): 164-170.
孟曉林, 李文均, 聶國興, 2019. 魚類腸道菌群影響因子研究進展[J]. 水產學報, 43(1): 143-155.
ALLDREDGE A L, SILVER M W, 1988. Characteristics, dynamics and significance of marine snow [J]. Progress in Oceanography, 20(1): 41-82.
HSU H Y, CHANG F C, WANG Y B,, 2018. Revealing the compositions of the intestinal microbiota of three Anguillid eel species using 16S rDNA sequencing [J]. Aquaculture Research, 49(7): 2404-2415.
IIDA T, YAMAMOTO A, WAKABAYASHI H, 1984. Changes in intestinal flora of the juvenile eel,, after beginning to feed [J]. Fish Pathology, 19(3): 201-204.
KOCA S B, YIGIT N ?, DIDINEN B I,, 2015. Effects of enzyme-producing probiotic bacteria isolated from the gastrointestinal tract of trout on the growth performance, survival, and digestive enzyme activity of rainbow trout fry () [J]. Israeli Journal of Aquaculture- Bamidgeh, 67: 1-9.
MANABE R, AOYAMA J, WATANABE K,, 2011. First observations of the oceanic migration of Japanese eel, from pop-up archival transmitting tags [J]. Marine Ecology Progress Series, 437: 229-240.
MILLER M J, CHIKARAISHI Y, OGAWA N O,, 2013. A low trophic position of Japanese eel larvae indicates feeding on marine snow [J]. Biology Letters, 9(1): 20120826.
NEAVE M J, APPRILL A, FERRIER-PAGèS C,, 2016. Diversity and function of prevalent symbiotic marine bacteria in the genus[J]. Applied Microbiology and Biotechnology, 100(19): 8315-8324.
NURIEL-OHAYON M, NEUMAN H, KOREN O, 2016. Microbial changes during pregnancy, birth, and infancy [J]. Frontiers in Microbiology, 7: 1031.
PéREZ T, BALCáZAR J L, RUIZ-ZARZUELA I,, 2010Host-microbiota interactions within the fish intestinal ecosystem [J]. Mucosal Immunology, 3(4): 355-360.
RAY A K, GHOSH K, RING? E, 2012. Enzyme-producing bacteria isolated from fish gut: a review [J]. Aquaculture Nutrition, 18(5): 465-492.
SPANGGAARD B, HUBER I, NIELSEN J,, 2001. The probiotic potential against vibriosis of the indigenous microflora of rainbow trout [J]. Environmental Microbiology, 3(12): 755-765.
TALWAR C, NAGAR S, LAL R,, 2018. Fish gut microbiome: current approaches and future perspectives [J]. Indian Journal of Microbiology, 58(4): 397-414.
TANAKA H, KAGAWA H, OHTA H,, 2003. The first production of glass eel in captivity: fish reproductive physiology facilitates great progress in aquaculture [J]. Fish Physiology and Biochemistry, 28(1/2/3/4): 493-497.
THANH N C, RAJESWARI V D, NARAYANAN M,, 2021. Evaluation of probiotic susceptibility of virulentsp. by a study on gut histology of[J]. Process Biochemistry, 111: 154-159.
TSUKAMOTO K, AOYAMA J, MILLER M J, 2009. Present status of the Japanese eel: resources and recent research [M] // CASSELMAN J M, CAIRNS D. Eels at the Edge: American Fisheries Society, Symposium. Bethesda: American Fisheries Society: 21-35.
WAHLBERG M, WESTERBERG H, AARESTRUP K,, 2014. Evidence of marine mammal predation of the European eel (L.) on its marine migration [J]. Deep Sea Research Part I: Oceanographic Research Papers, 86: 32-38.
WU SG, WANG G T, ANGERT E R,, 2012. Composition, diversity, and origin of the bacterial community in grass carp intestine [J]. PLoS One, 7(2): e30440.
YANG Z B, WANG J, SHANG C C,, 2022. Spatial and temporal changes in bacterial community structure in adjacent waters of Dagu River estuary of Jiaozhou Bay (China) revealed by high-throughput sequencing [J]. Regional Studies in Marine Science, 52: 102302.
ZHANG Y Y, MA L Y, 2021. Application of high-throughput sequencing technology in HIV drug resistance detection [J]. Biosafety and Health, 3(5): 276-280.
ZHAO L L, YIN H C, LU T F,, 2018. Application of high-throughput sequencing for microbial diversity detection in feces of specific-pathogen-free ducks [J]. Poultry Science, 97(7): 2278-2286.
ANALYSIS OF INTESTINAL MICROFLORA OF JAPANESE EEL () IN MIGRATION ALONG CHINA OFFSHORE
JIANG Zhi-Xin1, 2, 3, LI Kang1, 2, 3, BA Xu-Bing1, 2, 3, ZENG Xiang-Biao1, 2, 3, LIU Li-Ping1, 2, 3
(1. China-ASEAN Belt and Road Joint Laboratory on Mariculture Technology (Shanghai), Shanghai Ocean University, Shanghai 201306, China; 2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China; 3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China)
In order to study the structure and diversity of the intestinal microbiota of glass eels of Japanese eel () in the Changjiang (Yangtze) River estuary, and to investigate the nutritional requirements of wild glass eel, they were sampled in the adjacent waters of Taizhou and Zhoushan of Zhejiang Province, and Yancheng of Jiangsu Province. Using 16S rDNA amplicon sequencing technology, the dominant bacterial communities and functional differences related to nutrient metabolism in the glass eel intestines were analyzed. Results show that the intestinal bacterial community of glass eels at all the three sites was dominated by Proteobacteria and Actinobacteria, which accounted for 68.7%~82.0% and 4.2%~19.0%, respectively.andwere the most abundant genera, accounting for 12.4%~17.3% and 8.07%~13.03%, respectively, being dominant genera constantly. In addition, each site featured rich and unique bacterial groups, includingin Taizhou,andin Zhoushan, andandin Yancheng, which is believed that different water environment factors resulted in site-specific bacterial groups.,, andhave protein-degrading functions in the intestines of various fish species.is a cellulose-degrading bacterium and can also secrete extracellular proteases. Furthermore, we found by functional prediction that the transport and metabolism of amino acids took the highest proportion of the functions, which implies that glass eels could consume more protein-rich components for food during migration. This study unveiled the diversified composition in intestinal microbiota of wild glass eels along offshore in East China, and provided a basis for studying the feeding habits and food composition of wild eels, as well as a reference for the design of bait for the artificial breeding of Japanese eel.
Japanese eel (); larvae; intestinal microbiota; microbial diversity; high-throughput sequencing
* 上海市科技興農技術創新項目, 2020-02-08-00-10-F01471號; 國家自然科學基金項目, 32072994號。姜之信, 碩士研究生, E-mail: 807592788@qq.com
李 慷, E-mail: kli@shou.edu.cn; 劉利平, E-mail: lp-liu@shou.edu.cn
2023-03-18,
2023-05-04
S965; Q955
10.11693/hyhz20230300065

