基于網絡藥理學探討黃芩素對豬丁型冠狀病毒感染的潛在作用機制
劉賀娟,史晨曦,王 靜,王美樂,王棟涵,魏戰勇,尹素改*
(1.河南中醫藥大學醫學院,鄭州 450046; 2.河南農業大學動物醫學院,鄭州 450046)
冠狀病毒(Coronaviruses,CoVs)是廣泛存在于自然界的一大類人畜共患病毒,冠狀病毒感染可造成人和其他動物呼吸道、消化道和神經系統的功能發生障礙。CoVs屬于巢狀病毒目、冠狀病毒科、冠狀病毒亞科的單股正鏈RNA病毒,冠狀病毒亞科又被國際病毒學分類委員會分為α、β、γ和δ4個屬[1]。人類和其它脊椎動物是冠狀病毒的主要宿主,如2003年爆發的嚴重急性呼吸綜合征病毒(SARS-CoV),2012年爆發的中東呼吸綜合征病毒(MERS-CoV),均導致嚴重的呼吸道疾病甚至死亡[2]。2019年在武漢爆發并隨之席卷全球的新型冠狀病毒(SARS-CoV-2),是目前已知的第7種可感染人類的冠狀病毒,截至2021年11月1日下午5:04,在全球范圍內有246 594 191例COVID-19確診病例,已造成近500萬人死亡,給全球人類健康帶來巨大威脅[3]。除了感染人以外,冠狀病毒還可以感染家畜、家禽、鼠以及鳥類和蝙蝠等多種動物[4]。其中以豬的感染較為普遍,如豬呼吸道冠狀病毒(PRCV)、豬傳染性胃腸炎病毒(TGEV)、豬腸道α 冠狀病毒(PEAV)、豬流行性腹瀉病毒(PEDV)、豬丁型冠狀病毒(PDCoV)等[5]。其中PDCoV是2014年在豬群中新發現的一種冠狀病毒,主要引起7日齡以內的仔豬發生嚴重腹瀉,仔豬感染PDCoV死亡率高達30%,給我國養豬業造成了巨大的經濟損失[6]。據報道PDCoV還存在跨種傳播的特性,可人工感染雞、牛、鼠等,此外,從海地3名兒童血漿樣品中也檢測到突變后的PDCoV,表明PDCoV可能存在人畜共患的風險,對人類健康構成潛在威脅[7]。目前尚無PDCoV商品化疫苗或特異性藥物上市。
近年來,中醫藥治療冠狀病毒取得了一定療效,研究發現,中藥小分子如黃酮類、生物堿類、多糖類、蒽醌類等是中藥的關鍵活性成分,均能夠促進細胞生長、增強機體免疫、減輕病毒感染[8]。因此,應用中獸醫理論可以加速抗PDCoV天然藥物的挖掘、研究和開發。黃芩為唇形科植物黃芩的干燥根,始載于《神農本草經》,性味苦寒,有“清熱燥濕,瀉火解毒,止血,安胎”之功效,廣泛應用于臨床,常與其他中藥配伍用于治療呼吸道感染、急性菌痢、病毒性肝炎、過敏性疾病和婦科疾病等。黃芩素是中藥黃芩的主要活性成分,也是含量最高的黃酮類化合物之一。黃芩素被國家藥典委員會正式命名為百可利(baicalein,BAI),別名黃芩苷元、黃芩黃素[9]。近年來有研究表明,黃芩素在抗病毒方面作用突出,既可以抗RNA病毒也可以抗DNA病毒,其顯著的抗病毒作用近年來逐漸成為研究熱點。黃芩素可誘導艾滋病病毒整合酶的構象變化,抑制逆轉錄酶活性從而影響病毒復制[10];通過阻止病毒的吸附,直接殺傷病毒以及抑制病毒復制等途徑發揮抗登革熱病毒的作用[11-12];能夠劑量依賴地抑制流感病毒活性并減輕流感病毒所致的炎癥反應等[13];還具有調節細胞因子,增強白細胞發揮先天抗病毒免疫的能力從而發揮抗水皰性口炎病毒的作用[14]。黃芩素可通過抑制病毒DNA合成,發揮抗人巨細胞病毒的作用;可以降低日本腦炎病毒的感染能力[15-16]。黃芩素對多種病毒都表現出良好的抗病毒活性,且安全性高,這種低毒高效的特性使其在抗病毒藥物開發領域有著巨大優勢。
網絡藥理學在“疾病-靶點-藥物”多層次網絡基礎上,從整體上構建網絡靶標,在藥物和疾病之間建立源于疾病特異性網絡的分子聯系,綜合分析中藥的組成成分,預測藥物治療疾病的靶點,破譯藥物或中藥配方的治療效果機制及其可能的毒性和未知藥理活性[17],減少不必要的摸索性科研研究,為藥理作用及其機制研究開拓了新的思路,也為臨床科研試驗提供了新的理論支撐[18]。本研究使用網絡藥理學方法,從分子水平探索黃芩素抗PDCoV感染的機制。通過數據庫搜索收集黃芩素的靶標,構建“藥物-靶標-疾病”網絡,確定網絡中的重要核心基因,并對核心基因進行功能富集分析,找到黃芩素與PDCoV之間的關聯,為黃芩素作為潛在的抗PDCoV感染藥物的開發提供依據。
1 材料與方法
1.1 黃芩素結構檢索及靶點獲取
1.1.1 黃芩素結構檢索 檢索Pubchem(https://pubchem.ncbi.nlm.nih.gov/)有機小分子生物活性數據庫獲得黃芩素(Baicalein,CAS:491-67-8)的3D結構、PubChem-CID和SMILES文件。
1.1.2 黃芩素靶點獲取 利用Pharmmapper(http://www.lilab-ecust.cn/pharmmapper/)、SEA Search Server(http://sea.bkslab.org/)、TCMSP(http://tcmspw.com/tcmsp.php)、Swiss Target Prediction(http://www.swisstarget-prediction.ch/)和STITCH在線數據庫(http://stitch.embl.de/)檢索黃芩素的作用靶點,將上述數據庫檢索得到的靶點進行去重整理后,通過Uniprot(http://www.uniprot.org/)蛋白質數據庫將上述靶點蛋白轉化為整理為Gene Symbol,構建黃芩素靶點的網絡數據庫。
1.2 黃芩素-靶點作用圖的構建
采用Cytoscape 3.8.0軟件構建“黃芩素-黃芩素靶點”網絡,并運用Cytoscape的插件Network Analyze進行分析。
1.3 PDCoV感染相關靶點分析
PDCoV HNZK-02(基因序列號MH708123)以MOI=0.001的接毒量感染LLC-PK細胞(豬腎上皮細胞),分別于感染后1、6和18 h后收取蛋白樣品送至杭州景杰生物公司進行蛋白質組學分析,篩選出有1.2倍差異表達的蛋白(P<0.05),通過Uniprot數據庫將靶點蛋白轉化為整理為Gene Symbol,構建PDCoV感染過程中的疾病靶點。
1.4 黃芩素抗PDCoV感染靶點篩選
采用Draw Venny Diagram(http:// bioinformatics.psb.ugent.be/webtools/Venn/)在線程序將PDCoV與黃芩素(BAI)靶基因取交集獲得黃芩素與疾病的共同靶點,此集合為黃芩素治療PDCoV感染的可能靶點。
1.5 PPI網絡繪制及蛋白互作網絡分析
將上述交集得到的75個共同靶點導入STRING(https://string-db.org/)數據庫,構建PPI核心靶點網絡圖,設置置信度>0.400,其他參數保持默認值。將PPI網絡互作關系導入Cytoscape軟件中進行可視化分析,再利用CytoHubba以及MOCED插件對網絡進行分析,按基因的核心程度進行排序篩選出關鍵的子網絡和top10的核心靶點。
1.6 GO和KEGG分析
將黃芩素靶點與PDCoV相關靶點的交集靶點導入Metascape進行GO功能富集和KEGG通路富集分析(https://metascape.org/gp/index.html#/main/step1)。選擇Custome Analysis,P-value<0.01,其他選擇系統默認設置,按照排序在Gene List Summary下分別選擇GO功能分析(包括GO Biological Process(BP):生物過程;GO Cellular Component(CC):細胞組成;GO Molecular Function(MF):分子功能)以及KEGG Pathway。下載富集分析文件,GO僅展示前10條具有統計學顯著差異的結果;通過設置count值及In Term Inlist值,KEGG展示前20條具有統計學顯著差異的結果。利用微生信(http://www.bioinformatics.com.cn/)在線做圖將Metascape分析出的結果制作成高級氣泡圖并導入Cytoscape 3.8.0構建“藥物-疾病-靶點-通路”網絡圖。
1.7 體外驗證試驗
1.7.1 藥物、細胞、毒株 黃芩素購自成都曼思特生物科技有限公司(貨號:A0018,CAS:491-67-9,HPLC≥98%),溶解于DMSO,母液濃度為20 mg·mL-1,分裝避光保存在-20 ℃冰箱。試驗所用豬睪丸細胞(ST)購自中國獸監察所并由河南省動物性食品安全重點實驗室傳代保存。本試驗所用毒株為本實驗室分離保存的PDCoV毒株 HNZK-02(GenBank登錄號:MH708123),P33代,病毒滴度為108.75TCID50·mL-1。ST細胞用含10%胎牛血清(批號 04-001-1A,BI)的DMEM高糖培養基(批號:PYG0003,博士德)培養。實時熒光定量PCR(qRT-PCR)試劑盒購自南京諾唯贊公司(批號:Q341-02)。
1.7.2 試驗過程 ST細胞復蘇后經傳代3次用于本試驗,細胞接種于12孔板約24 h后,將細胞分為正常細胞對照組(Con)、陽性感染組(PDCoV)、黃芩素組(PDCoV+BAI)、以及黃芩素對照組(BAI),每組設3個重復。PDCoV組和PDCoV+BAI組用PDCoV(MOI=1)感染ST細胞,于37 ℃細胞培養箱吸附1 h后棄液,用D-Hanks洗2遍,Con組和PDCoV組加入無血清DMEM,PDCoV+BAI、BAI組加入黃芩素終濃度為50 μg·mL-1的無血清DMEM,培養18 h后收集細胞,提取樣品中的總RNA,并反轉錄成cDNA,采用實時熒光定量(qRT-PCR)方法檢測細胞中PI3K、AKT和NF-κBmRNA的相對表達水平(以β-actin作為內參基因),根據本實驗室建立的PDCoV絕對熒光定量PCR方法計算PDCoV S基因組拷貝數。試驗所用引物序列見表1。

表1 qRT-PCR引物序列
2 結 果
2.1 黃芩素和疾病靶點基因的收集和整理
輸入關鍵詞:baicalein,通過Pharmmapper得到化合物預測靶點89個;通過SEA Search Server獲得化合物預測靶點13個;通過SwissTarget Prediction獲得化合物的預測靶點104個;通過TCMSP數據庫獲得化合物靶點37個;通過Pubchem獲得化合物相關靶點88個;通過STITCH化學物質相互作用數據庫獲取與黃芩素相關靶點12個;去重整理后得到黃芩素的有效作用靶點共計268個。疾病靶點的獲取:對不同時間點樣品蛋白組學結果整理分析,共得到1 771個下調靶點,1 997個上調靶點。
2.2 黃芩素與黃芩素靶點網絡構建
將得到的268個黃芩素靶點導入Cytoscape得到圖1。該網絡由269個節點(黃芩素和268個黃芩素靶點)、268條邊組成。外環紫色凹四邊形代表黃芩素靶點,中間黃色菱形代表黃芩素。
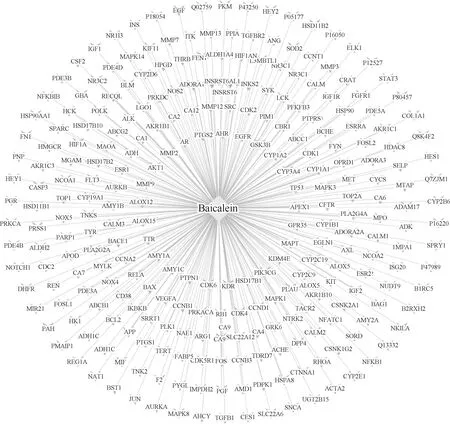
圖1 黃芩素-黃芩素靶點網絡
2.3 黃芩素主要靶點-PDCoV共同靶點
運用Draw Venny Diagram在線程序將收集的黃芩素主要靶基因和PDCoV感染相關靶基因集取交集后共獲得75個黃芩素治療PDCoV感染的潛在靶點(圖2),左側紫色圓圈為黃芩素有效成分靶點,右側為PDCoV感染相關靶點,中間交集為黃芩素抗PDCoV感染的潛在靶點。
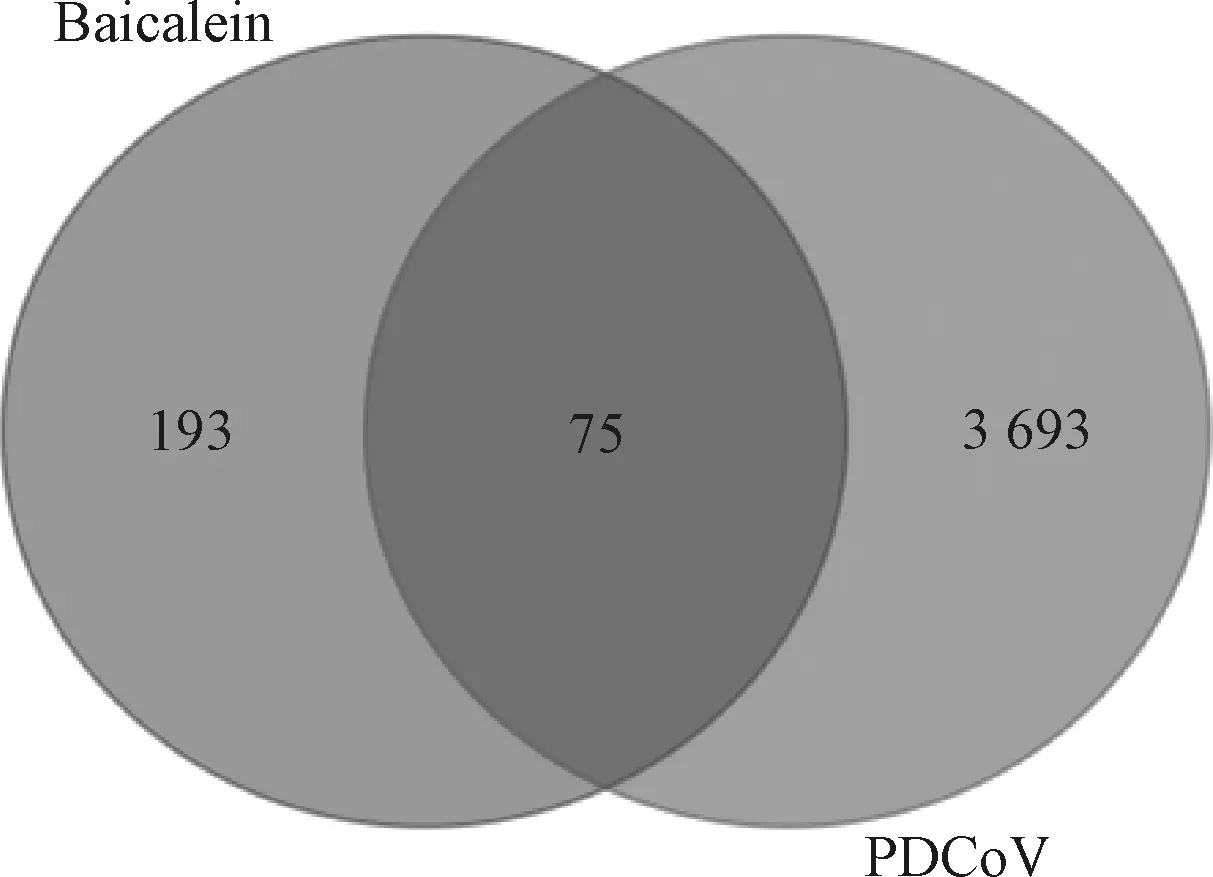
圖2 黃芩素-抗PDCoV感染韋恩圖
2.4 黃芩素抗PDCoV感染PPI網絡繪制及蛋白網絡互作分析
將單體與疾病共同靶點導入String數據庫,線條的粗細程度反映蛋白間互作關系的強弱,隱藏網絡中斷開連接的節點,得到黃芩素抗PDCoV感染PPI網絡圖(圖3),該PPI靶點網絡由75個節點和480條邊組成,平均節點度為12.8,平均局部聚類系數為0.554,預期的邊數為分223,PPI富集P值<1.0×10-16。將PPI所得結果導入Cytoscape并利用MCODE插件可視化分析并尋找關鍵蛋白和3個主要子網絡(圖4)。其中紅色代表上調基因,綠色代表下調基因,cluster 1得分15.444,cluster 2得分6.364,cluster 3得分5,越靠近圓環中心,節點越大,相關性越大,表示與其他靶點聯系越緊密。表2展示了3個主要子網絡的節點、邊數以及靶蛋白。利用Cytoscape的插件Cytohubba根據蛋白的degree對網絡數據進行拓撲學分析,選取節點top10的關鍵蛋白(表3),黃芩素抗PDCOV的關鍵靶點蛋白為AKT1、HSP90AA1、SRC、EGFR、CASP3、MAPK1、STAT3、FN1、RHOA、MAPK3,圖5展示了關鍵靶蛋白的互作網絡圖,顏色越深代表在網絡中越重要。
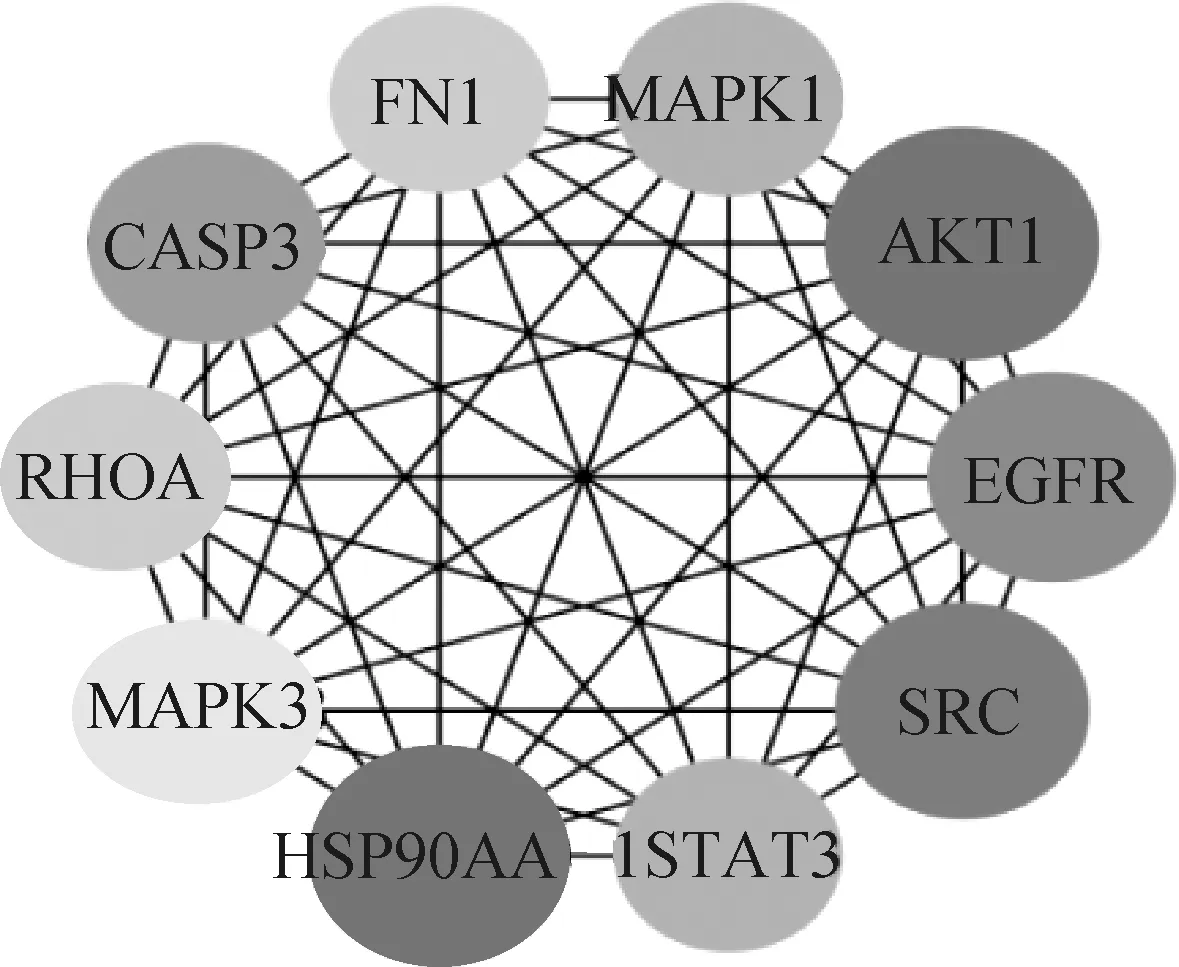
圖5 關鍵靶蛋白互作網絡圖

表2 黃芩素-PDCoV共同靶點的Cluster數據
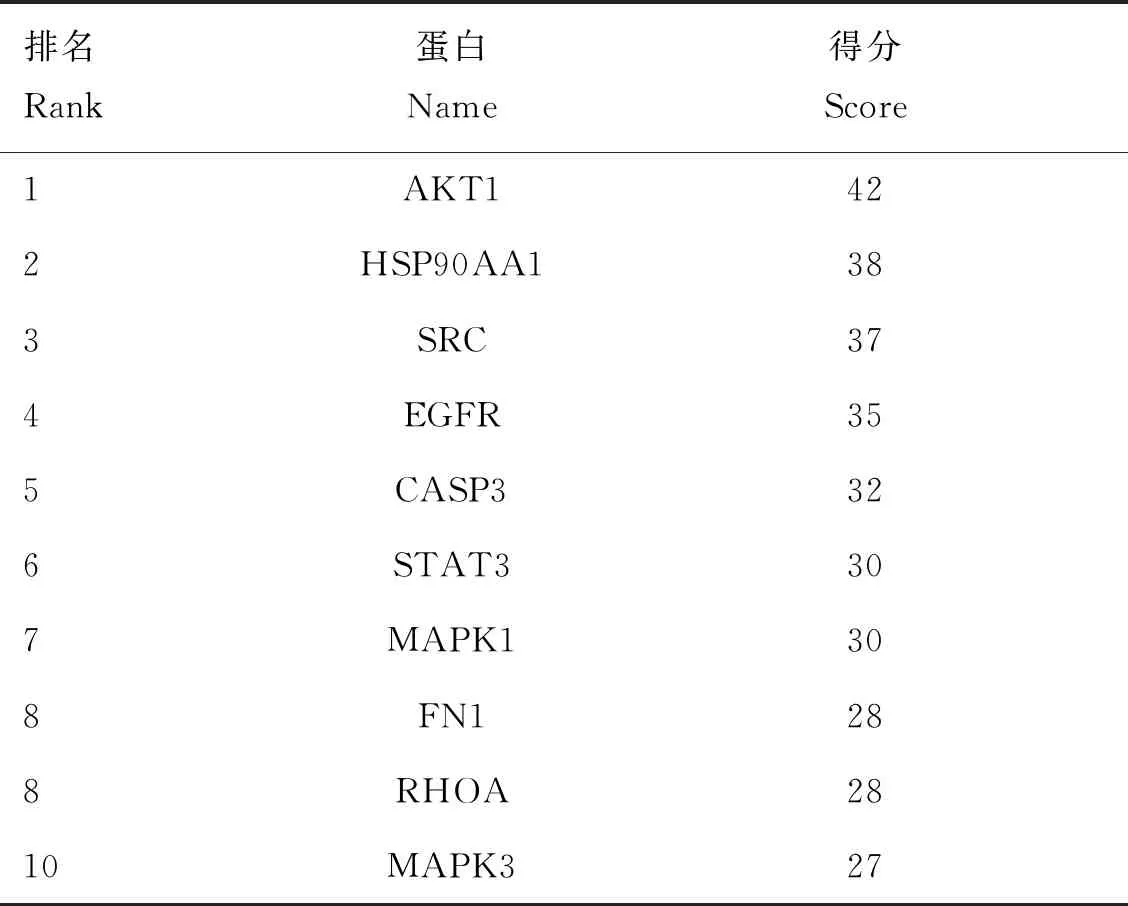
表3 黃芩素抗PDCoV感染的關鍵靶蛋白
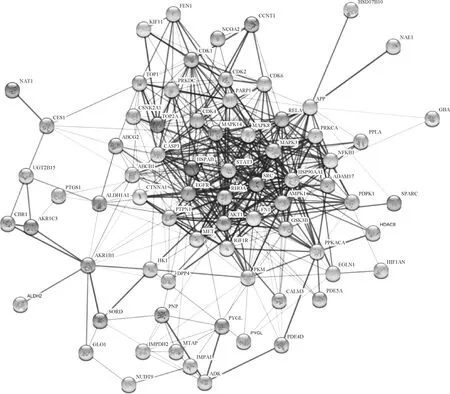
圖3 靶蛋白互作PPI網絡圖
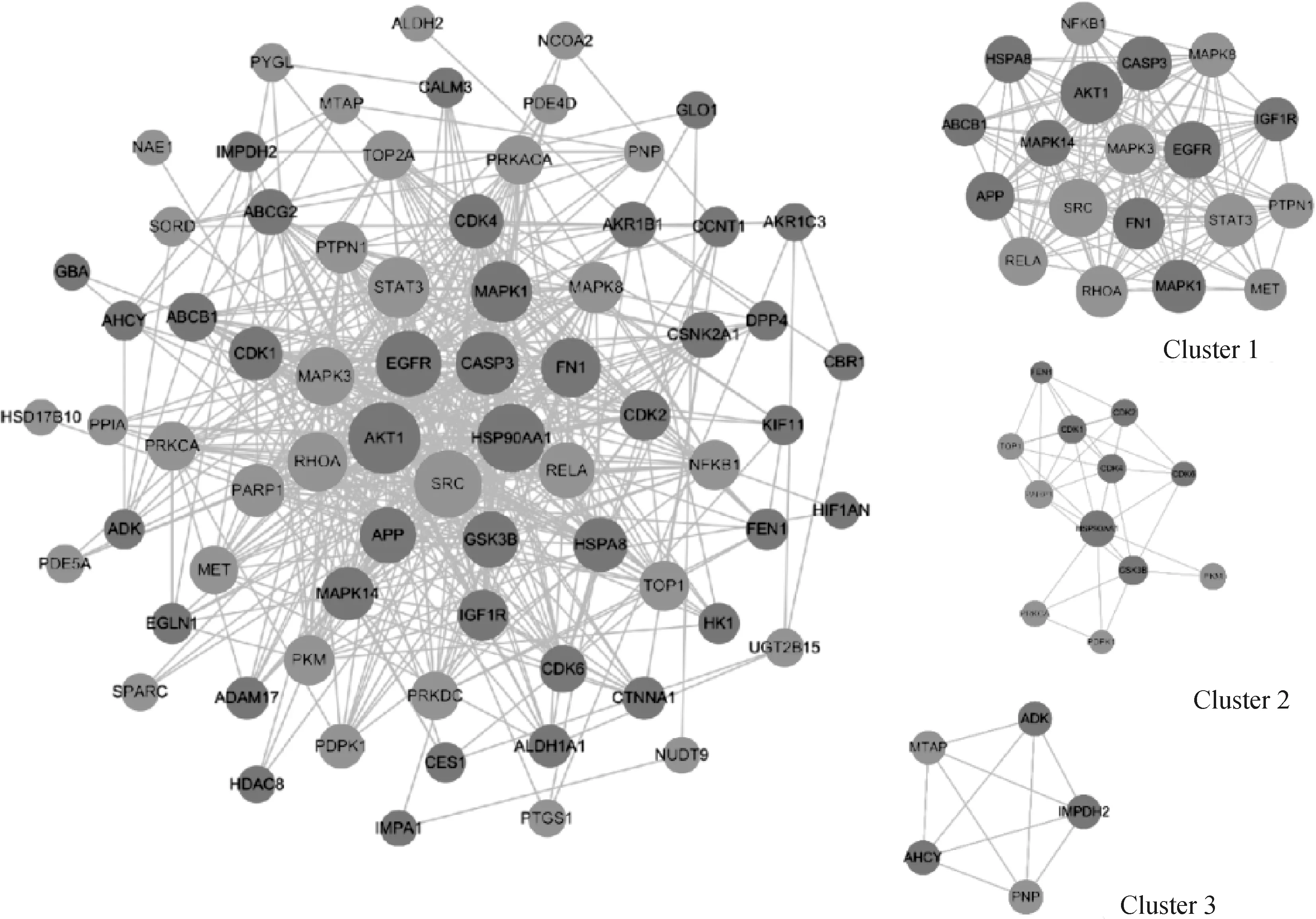
圖4 靶蛋白互作及主要子網絡圖
2.5 GO富集分析結果
將黃芩素可能對PDCoV感染發揮作用的核心基因靶點導入Metascape進行基因本體(GO)功能富集分析(圖6)以及KEGG通路富集分析(圖7)。GO富集分析發現,黃芩素抗PDCoV感染的靶點基因影響的生物過程有941個,生物組分有47個,分子功能有90個,按P值大小將排在前10的結果輸入到微生信平臺制作富集BP,CC,MF三合一柱狀圖(圖6)。橫軸為黃芩素抗PDCoV感染可能通過的生物過程、生物組分和分子功能的GO名稱,縱軸為富基基因的靶點數量。由圖可知,絲氨酸修飾、JNK信號級聯、糖代謝和單羧酸代謝過程是黃芩素參與抗PDCoV感染中的重要生物過程;細胞周期蛋白依賴型的蛋白激酶、細胞膜筏、線粒體膜和紡錘體等是黃芩素參與抗PDCoV感染中的重要的生物組分;磷酸轉移酶活性、蛋白激酶活性、蛋白結構域結合活性、MAPK激酶活性等是黃芩素參與抗PDCoV感染中的重要分子功能。
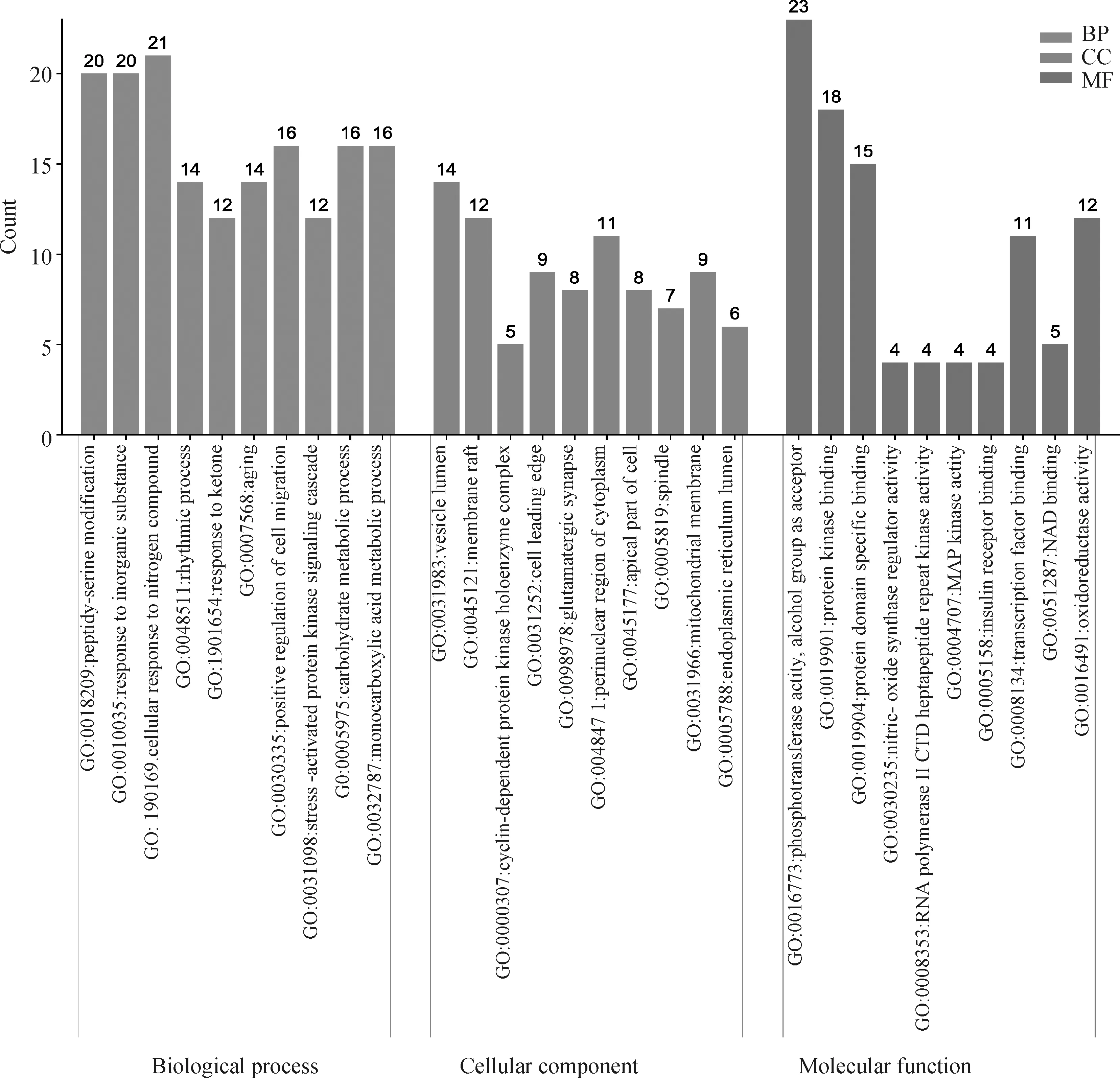
圖6 黃芩素-抗PDCoV感染GO富集分析部分結果(前10)
KEGG通路富集分析結果顯示,共篩選得到277條信號通路(P<0.01),整理分析篩選得到的數據,通過設置Count值及In Term Inlist,選擇通路上蛋白富集多,排名靠前的信號通路,利用微生信平臺,展示前20條具有統計學顯著差異的結果(圖7)。黃芩素-抗PDCoV感染的核心靶點基因主要參與癌癥、肝炎、PI3K-Akt通路、EB病毒感染、缺氧誘導因子1信號通路、MAPK信號通路等,提示黃芩素治療PDCoV感染可能是通過這些通路發揮作用的。
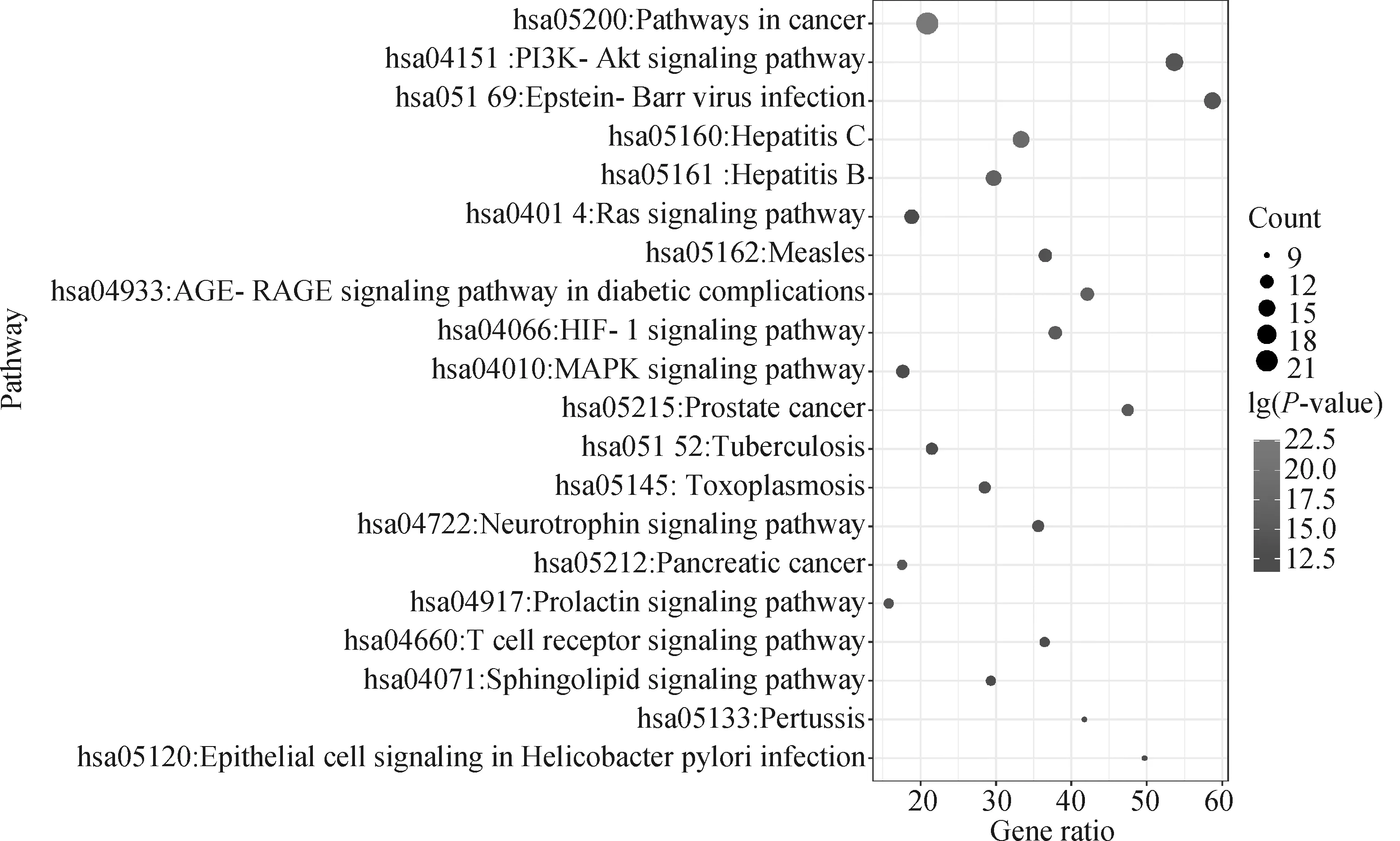
圖7 KEGG分析結果氣泡圖(前20)
2.6 黃芩素-PDCoV感染-靶點-通路網絡分析
通過KEGG分析結果,將通路和靶點導入Cytoscape,獲得了“黃芩素-PDCoV感染-靶點-通路”網絡圖(圖8),共有53個節點和735條邊,外環菱形代表KEGG富集得到的前20個參與黃芩素抗PDCoV感染的信號通路,中環圓形代表黃芩素抗PDCoV感染的關鍵靶蛋白,中心多邊形代表PDCoV感染,其上方的箭頭代表黃芩素。

圖8 “黃芩素-PDCoV感染-通路”網絡圖
2.7 體外驗證黃芩素對PI3K-AKT及其下游基因表達的影響
首先在ST細胞上檢測黃芩素對PDCoV復制的影響,結果如圖9所示,與PDCoV組相比,黃芩素處理極顯著降低了PDCoV的基因組拷貝數(P<0.001)。隨后檢測了黃芩素在抑制PDCoV感染程中對PI3K-AKT信號通路及其下游基因表達的影響(圖9)。試驗結果表明,與Con組相比,PDCoV組PI3K、AKT和NF-κB的表達量極顯著升高(P<0.001);與PDCoV組相比,黃芩素處理顯著降低了PI3K(P<0.001)、AKT(P<0.05)和NF-κB(P<0.001)的mRNA表達量(P<0.001)。
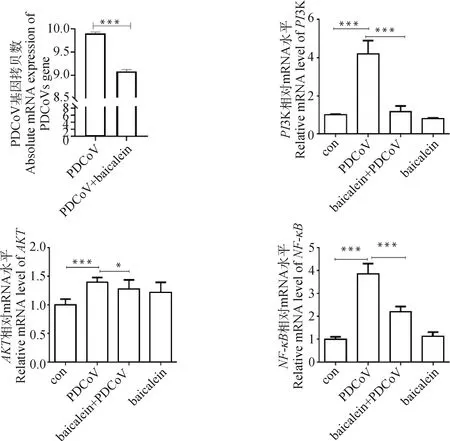
*P<0.05表示差異顯著,**P<0.01、***P<0.001表示差異極顯著。
3 討 論
近年來,冠狀病毒對人和動物的威脅日益加劇,給全球公共衛生安全帶來巨大威脅。冠狀病毒存在跨種傳播,能夠感染鳥類、老鼠、蝙蝠等其他野生動物,并通過在中間宿主家畜和家禽中的傳播感染人類[19]。冠狀病毒感染仔豬會導致病毒性腹瀉,哺乳仔豬死亡率可高達90%,并可感染不同年齡段的豬,具有高致病性、高陽性率、高死亡率的特點,危害大,更應引起重視[20-21]。目前,尚未研制出抗PDCoV的疫苗和特異性藥物,天然產物是開發抗病毒藥物的一個方向,應用好中華傳統醫藥對開發抗病毒新藥研究十分重要。黃芩是中藥組方中最常用藥物之一,通過分子對接發現黃芩中的重要活性物質黃芩素與SARS-CoV-2 3CL水解酶結合性強,體外試驗表明黃芩素可有效抑制SARS-CoV-2 3CL水解酶的活性,其顯著的抗病毒作用近年來逐漸成為研究熱點,有望開發成廣譜抗冠狀病毒藥物[22-24]。黃芩素是從中藥黃芩中提取的黃酮類化合物,含量較高,具有抗病毒、抗炎、免疫調節、抗菌、抗腫瘤等多種功效[25]。黃芩素可能通過抑制ATP合成酶活性抑制大腸桿菌感染,且可以通過阻止病毒黏附,抑制細胞因子的產生等多種方式抑制病毒感染[26-27]。但這都不足以揭示其復雜的抗病毒機制,因而可以借助網絡藥理學針對性地深入探索其抗病毒感染機制。
本研究采用了TCMSP、Pharmmapper、Pubchem、STITCH和Swiss Targer Prediction數據庫等數據庫進行分析,這些數據庫相對權威也更全面。以PharmMapper為例,該數據庫整合了TargetBank、DrugBank、BindingDB和PDTD中的所有目標中提取的大型內部藥效團數據庫支持,尋找所有靶標的最佳映射姿勢,是一個相對權威的藥物靶點數據庫。TCMSP以系統藥理學為基礎,囊括《中國藥典》,提供了豐富的活性成分、作用靶點以及相關疾病資料且被廣泛認可引用。網絡藥理學為研究藥物作用機制和新藥開發提供了新思路,但同時也面臨挑戰,比如中醫藥數據積累不足,數據的質量受限于生物技術的發展等[17,43]。為了使藥物靶點更全面準確,本研究分別在各個具有權威性的數據庫進行了查詢,隨后對查詢結果進行去重處理,因此,藥物靶點是較為全面準確的。通過挖掘多個化合物靶點數據庫和本實驗室前期蛋白質組學的數據(數據尚未發表),發現了75個黃芩素抗PDCoV感染的潛在靶點。通過PPI網絡尋找這其中的關鍵子網絡,發現了包含36個關鍵蛋白的3個子網絡,其中包括調控炎癥反應的STAT3、NFB1、MAPK1等,與細胞凋亡相關的CASP3、MAPK8、MAPK14、SRC、AKT1等,與細胞自噬有關的AKT1、MAPK3、MAPK8、IGF1R等,與細胞周期有關的CDK1、CDK2、CDK4、CDK6、SRC、AKT1等,以及參與蛋白質正確折疊的HSPA8、HSP90AA1等,說明黃芩素抗PDCoV感染的作用機制除了調控炎癥反應、細胞凋亡與細胞自噬,還參與調控了細胞周期和蛋白質折疊等其它機制。
GO富集分析結果發現,在分子功能方面,磷酸轉移酶的活性、蛋白激酶的結合能力和特定蛋白結構域的結合能力富集因子最多,結合生物過程中富集因子最高的絲氨酸修飾分析,提示一些受磷酸化影響的信號通路可能在黃芩素抗PDCoV感染中發揮重要的功能。在細胞組成中,富集分析表明,細胞周期蛋白依賴型的蛋白激酶可能在黃芩素抗PDCoV感染的過程中起著重要作用。研究顯示,在多種豬冠狀病毒感染中,病毒感染可以調控細胞周期。如豬傳染性胃腸炎病毒可誘導細胞阻滯在S期和G2/M期,且經UV滅活的病毒不能阻滯細胞周期,表明細胞周期阻滯依賴于病毒感染[28];另有研究顯示,豬流行性腹瀉病毒感染細胞后,細胞周期阻滯在G2/M期[29],表明細胞周期在病毒感染過程中起著重要的作用。黃芩素通過下調細胞周期蛋白依賴性的蛋白激酶,將HeLa細胞周期阻斷在G0/G1期,從而抑制細胞遷移和誘導細胞凋亡來治療宮頸癌[30]。本研究顯示,黃芩素可能是通過調控細胞周期蛋白依賴型的蛋白激酶的表達,調節PDCoV感染引起的細胞周期阻滯,從而發揮抗病毒感染的作用。
KEGG富集分析結果篩選得到277條信號通路(P<0.01),鑒于富集通路較多,在數據分析中通過設置Count值,以及InTerm Inlist值,選擇通路上富集蛋白多且排名靠前的前20條信號通路。黃芩素抗PDCoV感染的關鍵靶點主要富集在癌癥通路、PI3K-Akt信號通路、Ras信號通路和MAPK信號通路。其中富集因子最大的是癌癥通路,主要受上述討論的細胞周期影響及上調的差異蛋白AKT1、EGFR等表達量的影響。目前對PDCoV致病機制研究較少,天然免疫應答可能起重要作用[31],研究證實PDCoV感染會引起炎癥、自噬、凋亡等[32-33]。PI3K/AKT信號通路、Ras信號通路和MAPK信號通路均是由磷酸化修飾級聯介導的信號通路,這一現象與GO分析得到的結果相一致。PI3K-Akt信號通路作用很廣,參與調控多種細胞進程,如細胞凋亡、細胞自噬、蛋白合成、細胞分化、DNA修復等。PI3K-Akt信號通路被激活后,會磷酸化凋亡調控蛋白caspase9來使其失活,從而產生抗凋亡作用[34];除此以外,PI3K-Akt信號通路還能通過抑制線粒體凋亡蛋白的釋放發揮抗凋亡功能[35]。凌云等[36]的研究證明,黃芩素可以通過抑制Akt/mTOR信號通路增加乳腺癌細胞中LC3-Ⅱ/LC3-Ⅰ的比例,進而誘導細胞自噬。在胃癌細胞系上的研究表明,黃芩素也可以通過PI3K-Akt信號通路來誘導細胞自噬,從而發揮抗癌作用[37]。本研究的研究結果提示,黃芩素抗PDCoV感染的機制可能與PI3K/AKT信號通路調控的細胞自噬和炎癥有關。與PI3K-Akt信號通路一樣,Ras信號通路和MAPK信號通路的作用也十分廣泛,參與調控細胞分化、自噬、凋亡、增殖和炎癥反應,且這三個通路之間可以形成網絡相互影響。孫曉林[38]研究證明,綿羊肺腺瘤病毒的囊膜蛋白可以激活Akt和MAPK信號通路,調控Beclin1的表達從而抑制細胞自噬。在流感病毒H1N1感染過程中,研究發現有MAPK信號通路的參與,且應用疏清顆粒可以通過調控MAPK信號通路來干預病毒感染[39]。王慧蓮等[40]的研究表明,在類風濕關節炎成纖維樣滑膜細胞中,漢黃芩素可以激活MAPK信號通路來誘導細胞凋亡。通過抑制Ras信號通路,黃芩素能夠將細胞周期阻滯在G1期,從而誘導宮頸癌細胞凋亡,該研究提示,在宮頸癌的發生和發展過程中,Ras信號通路參與調控細胞周期,而應用黃芩素可以抑制癌癥的發生和發展[41]。隨著數據庫不斷的更新、計算機算法的精進以及生物技術的發展,多學科交叉協作將為研究人員提供更可靠的信息。鑒于網絡藥理學揭示藥物對疾病的作用機制仍存在局限性,比如忽略了部分數據庫的更新、算法的精進、各數據庫間的對比等,研究還需要結合臨床和科學驗證[42-43]。結合PDCoV的可能致病機制和病理生理過程,因此,本研究選擇了PI3K-AKT通過體外細胞試驗初步驗證了網絡藥理學的預測結果,為進一步的深入研究奠定了基礎。
4 結 論
綜上所述,本研究表明黃芩素主要作用于AKT1、HSP90AA1、SRC、EGFR、CASP3、MAPK1等關鍵靶蛋白,并通過調節PI3K-Akt、Ras和MAPK等多個信號通路,從而發揮抗PDCoV感染的作用。本文借助生物信息學相關技術和方法,通過對關鍵靶點、生物過程和信號通路的分析,全面系統地研究了黃芩素抗PDCoV感染的潛在作用機制,揭示了黃芩素是通過多靶點、多通路、多機制來抑制PDCoV的感染。雖然本研究只是針對黃芩素抑制PDCoV感染作用機制進行了預測,還存在局限性。但是,本研究將中醫藥理論與網絡藥理學聯合應用,進行科學的預測,減少了不必要的摸索性試驗研究,大大節省了時間、科研經費,為抗豬丁型冠狀病毒天然藥物的挖掘、研究和開發,提供了新的理論支撐,同時也為其他動物類疾病的研究提供思路與方向。

