阿司匹林丁香酚酯對體外脂多糖誘導小鼠巨噬細胞炎癥反應的抑制效應
劉 旭,潘寅川,楊亞軍,劉希望,馬 寧*,李劍勇*
(1.河北農業大學動物醫學院(中獸醫學院) 河北省獸醫生物技術創新中心,保定 071000;2.中國農業科學院蘭州畜牧與獸藥研究所 農業農村部獸用藥物創制重點實驗室 甘肅省新獸藥工程重點實驗室,蘭州 730050)
炎癥可引起寵物疼痛不安,造成生存質量下降,嚴重影響寵物福利[1]。與炎癥相關的疾病主要有犬、貓的關節炎、皮炎、胃腸炎、胰腺炎以及術后炎癥等。此外,代謝性疾病如血脂異常、肥胖等在犬、貓中也具有很高的發病率,而炎癥是引起此類疾病的重要病因之一[2-3]。對炎癥的干預和治療,對于炎癥本身及預防相關疾病的發生發展十分重要,有助于維持寵物的健康狀態和提高寵物的生活質量,已日益受到重視。
阿司匹林(aspirin,Asp)是一種用于止痛、消炎、解熱的常用藥物[4]。前期相關研究證實,Asp可以預防犬貓等寵物的炎癥性疾病[5]。然而,由于Asp會引起胃腸道并發癥,限制了Asp的長期使用[6]。丁香酚(eugenol,Eug)是丁香花蕾揮發油中的活性成分,具備多種治療效果,包括抗菌、抗炎、抗血栓、解熱等[7]。由于Eug含有酚羥基,具有刺激性和易氧化的特點,其臨床應用受到一定限制。為了減少Asp和Eug的副作用,提高治療效果,通過酯化反應合成了阿司匹林丁香酚酯(aspirin eugenol ester,AEE)[8]。AEE通過酯化反應對羧基和酚羥基進行修飾,既解決了Asp進入體內時對腸胃的刺激,同時克服了Eug的不穩定性和刺激性氣味[9-10]。其急性毒性、藥效學、穩定性、致畸性和致突變性研究表明,AEE的LD50為10.39 g·kg-1,低于Asp和Eug[11],大鼠連續灌胃15 d(50 mg·kg-1),無顯著毒性作用[12],鼠傷寒沙門菌試驗(Ames)和小鼠骨髓微核試驗證實其遺傳毒性不顯著[13]。藥理學表明,AEE通過調節一氧化氮合酶和Nrf2信號通路,保護血管內皮細胞免受氧化損傷[14],并對高血脂、血栓具有一定的治療作用[15-16]。然而,該藥物作為Asp衍生物,其抗炎作用和抗炎機制尚需進一步研究。
花生四烯酸(Arachidonic acid,AA)是一種ω-6多不飽和脂肪酸,主要以細胞膜上的磷脂的形式存在。當細胞處于應激狀態時,AA被磷脂酶A2(phospholipase A2,PLA2)分解成游離形式并釋放到細胞液中,然后在代謝酶的作用下形成上百種生物活性代謝物。目前,參與AA代謝的酶主要有3種,分別是環氧化酶(cyclooxygenase,COX)、脂氧合酶(lipoxygenase,LOX)和細胞色素P450(cytochrome P450,CYP450)[17-18]。AA代謝網絡是產生炎癥介質并誘導炎癥的主要網絡[19],其在炎癥的形成和發展中發揮著極其重要的作用,且不是一個孤立的過程。本研究以脂多糖(lipopolysaccharide,LPS)誘導小鼠巨噬細胞(RAW264.7細胞)體外炎癥模型,分析AEE對RAW264.7細胞存活率和炎癥因子含量的影響,明確AEE對炎癥反應的抑制效應;并進一步結合RT-PCR和分子對接方法,研究AEE對AA代謝通路關鍵酶的作用,探討AEE潛在的抗炎機制,為將AEE開發為獸醫臨床抗炎藥物提供一定的理論基礎。
1 材料與方法
1.1 藥品試劑
小鼠巨噬細胞(RAW264.7細胞)購自中國科學院上海細胞庫;AEE(純度>99%)由中國農業科學院蘭州畜牧與獸藥研究所農業農村部獸用藥物創制重點實驗室合成制備;阿司匹林、丁香酚購自上海阿拉丁生化科技股份有限公司;脂多糖、胰蛋白酶、Cell Counting Kit-8購自北京索萊寶科技有限公司;Foundation FBS、DMEM高糖培養液購自MCE有限公司;ELISA試劑盒購自上海江萊生物科技有限公司;RNA提取試劑盒、反轉錄試劑盒、熒光定量PCR試劑盒購自北京聚合美生物工程有限公司。
1.2 細胞培養
將消化好的RAW264.7細胞懸液加入細胞培養瓶內,加入5 mL含10% FBS的高糖DMEM培養基、100 U·mL-1青霉素和100 μg·mL-1鏈霉素,細胞在37 ℃加濕培養箱中生長,培養箱中含有5% CO2,操作過程保持無菌,觀察細胞的狀態和成長情況,待細胞生長至對數生長期時,取生長狀態良好的細胞用于試驗。
1.3 試驗分組及處理
取對數生長期細胞,用胰酶消化制成細胞懸液,密度為5×104個·mL-1接種于24孔板。并將細胞分為對照組(Control):正常培養24 h;炎癥模型組(LPS):1 μg·mL-1的LPS作用24 h;Asp組:LPS+Asp,向培養液中加入濃度為150 μmol·L-1的Asp預處理細胞4 h,1 μg·mL-1的LPS作用24 h,Eug處理組:LPS+Eug,向培養液中加入濃度為150 μmol·L-1的Eug預處理細胞4 h, 1 μg·mL-1的LPS作用24 h;AEE處理組:LPS+AEE(低、中、高濃度):向培養液中分別加入濃度為75、150、300 μmol·L-1的AEE預處理細胞4 h,1 μg·mL-1的LPS作用24 h;每組設5個重復。
1.4 細胞毒性試驗
細胞毒性試驗采用CCK-8法,在96孔板中接種細胞懸液(100 μL·孔-1),將培養板放在培養箱中預培養24 h;加入濃度為(5、15、45、75、100、150、300、350 μmol·L-1)的AEE溶液;將培養板在培養箱孵育24 h;向每孔加入10 μL的CCK-8溶液;將培養板置于培養箱內孵育2 h;用酶標儀測定在450 nm處的吸光度,并計算細胞存活率。細胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100。
1.5 ELISA檢測TNF-α、IL-6、IL-8、IL-1β含量
取對數生長期RAW264.7細胞接種于48孔板中,細胞分組及處理方法同“1.3”,培養結束后,收集各組細胞培養上清液,ELISA法檢測各組TNF-α、IL-6、IL-8、IL-1β含量,操作步驟按照試劑盒說明書。
1.6 RT-PCR法檢測COX-1、COX-2、5-LOX、PLA2和CYP450基因轉錄水平
取對數生長期RAW264.7細胞接種于24孔板中,細胞分組及處理方法同“1.3”,培養完成后,提取各組細胞總RNA,依試劑盒說明書操作方法,把mRNA逆轉錄為cDNA,獲得的cDNA用于RT-PCR,檢測COX-1、COX-2、5-LOX、PLA2和CYP450基因的相對轉錄水平。PCR引物見表1,并選用了β-actin為內參基因。RT-PCR的反應條件是95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循環40次;mRNA的相對轉錄量采用2-△△Ct方法計算。

表1 RT-PCR相關引物序列表
1.7 分子對接
應用RCSB PDB(http://www.rcsb.org/)數據庫下載相關蛋白晶體結構,保存為pdb格式,利用AutoDock 4.2.6軟件進行分子對接,利用Pymol軟件進行可視化處理,研究Asp、Eug、AEE與COX-1、COX-2、5-LOX、PLA2和CYP450蛋白的結合模式,根據得到的結合能(binding energy)值評價不同藥物和關鍵靶點之間的對接結果。
1.8 數據分析
利用SPSS軟件進行分析,統計分析采用組間單因素方差分析法(one-way AVOVA),數據都以“Mean±SD”表示,P≤0.05時差異具有統計學意義。
2 結 果
2.1 AEE對RAW264.7細胞活力的影響
與空白對照組相比,CCK-8法檢測結果顯示,AEE處理對細胞生長沒有抑制作用,5、15、45、75、100、150、300、350 μmol·L-1處理細胞活力均在93%以上,且各組間沒有統計學差異(圖1)。在本試驗中,將150 μmol·L-1的AEE用于后續試驗,在此基礎之上,將低劑量確定為75 μmol·L-1,高劑量確定為300 μmol·L-1。為比較AEE、Asp、Eug之間區別,將與中劑量AEE等摩爾的Asp與Eug用于試驗。
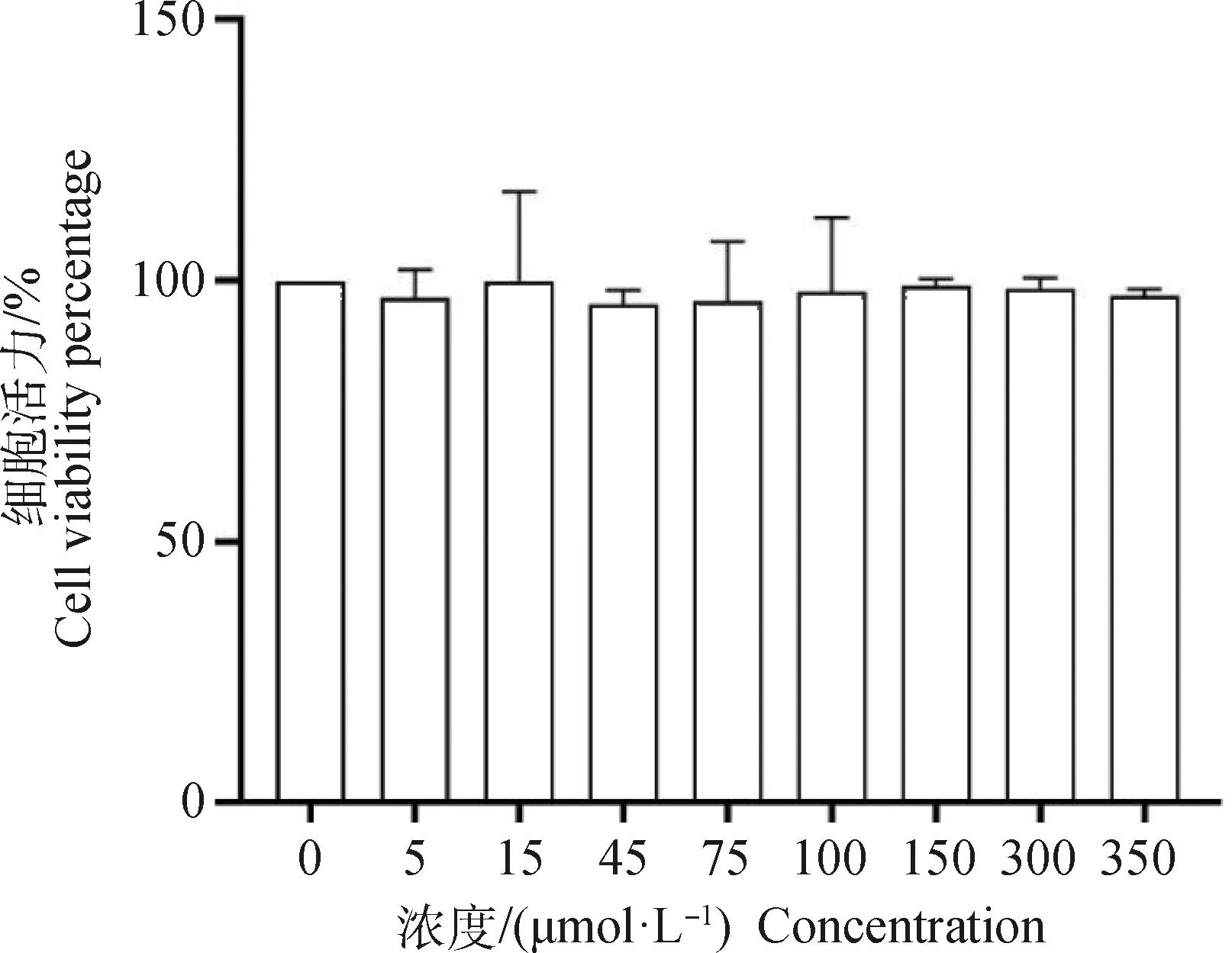
圖1 AEE 對RAW264.7細胞活力的影響
2.2 AEE對LPS誘導的炎癥細胞因子的影響
ELISA結果表明,與空白對照組比較,LPS組中炎癥因子IL-1β、IL-6、IL-8、TNF-α表達極顯著升高(P<0.01),表明炎癥模型造模成功。經不同劑量AEE處理后能極顯著降低炎癥因子IL-1β、IL-8、TNF-α表達水平(P<0.01);在炎癥因子IL-1β、IL-6、IL-8中,與Asp和Eug組比較,等摩爾的AEE與其無顯著差異(P>0.05),表明其抗炎效果相似;不同劑量的AEE在炎癥因子IL-1β、IL-6、IL-8之間差異不顯著(P>0.05),但中劑組AEE抗炎效果要優于低劑量組和高劑量組(表2)。
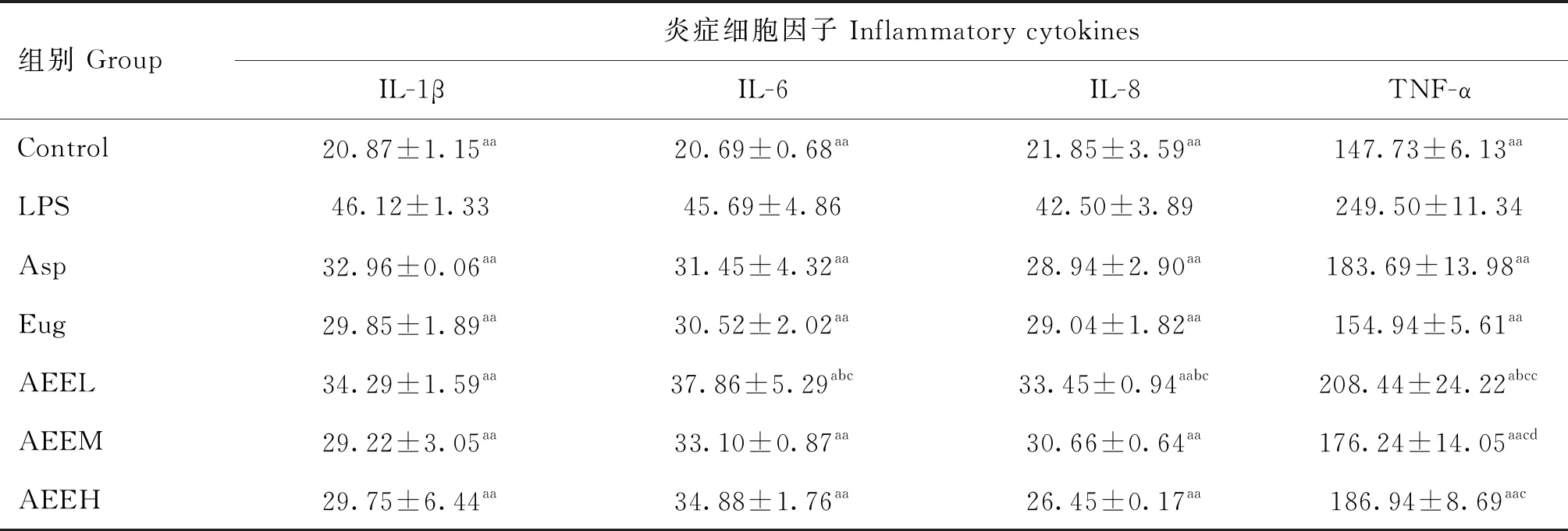
表2 AEE對LPS誘導的TNF-α、IL-8、IL-6、IL-1β的影響
2.3 RT-PCR法檢測COX-1、COX-2、5-LOX、PLA2和CYP450基因轉錄水平
β-actin為內參基因,RT-PCR檢測結果顯示(表3),與空白對照組比較,LPS組中CYP450、PLA2、COX-2、COX-1和5-LOX表達極顯著升高(P<0.01),表明炎癥模型造模成功。不同劑量的AEE處理能顯著降低AA代謝通路關鍵酶的mRNA表達量(P<0.05);與ASP和Eug組比較,等摩爾量的AEE能夠顯著降低AA代謝通路關鍵酶PLA2的表達量(P<0.05);不同劑量的AEE在COX-1、COX-2、5-LOX和CYP450關鍵酶表達量之間差異不顯著(P>0.05)。
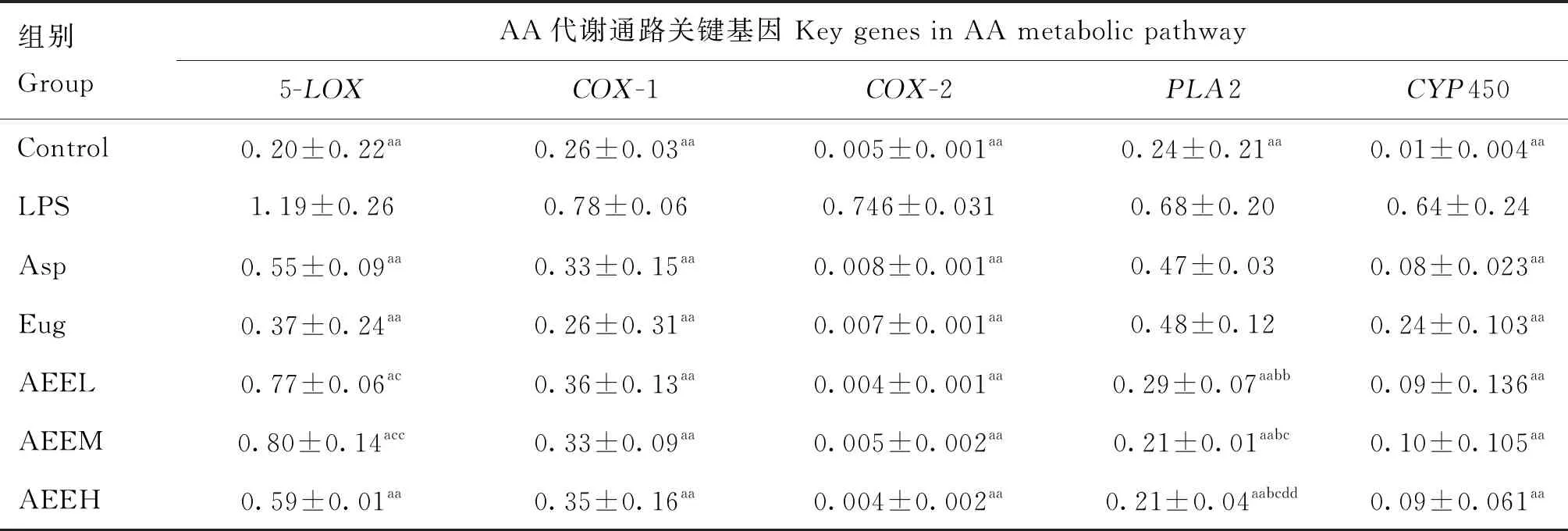
表3 AEE對LPS誘導的COX-1、COX-2、5-LOX、PLA2和CYP450的影響
2.4 分子對接研究
利用AutoDock軟件進行分子對接,AEE能與COX-1、COX-2、5-LOX、PLA2和CYP450形成結合位點,結合能分別為-39.25、-39.75、-38.87、-37.24、-32.90 kJ。所有的對接結果均小于-20.9 kJ(表4)。利用Pymol軟件對結果進行可視化處理,AEE中的羥基與COX-1蛋白中的氨基酸530 SER形成常規氫鍵,鍵長為2.1 ?。AEE中的羥基與COX-2蛋白中的氨基酸530 SER、527 ALA形成常規氫鍵,鍵長范圍1.9~2.7 ?。AEE中的羥基與5-LOX蛋白中的氨基酸370 ARG、470 TYR、549 GLN形成常規氫鍵,鍵長范圍1.9~2.5 ?。AEE中的羥基與PLA2蛋白中的氨基酸62 LYS、47 HIS、29 GLY形成常規氫鍵,鍵長范圍2.0~2.3 ?。AEE中的羥基與CYP450蛋白中的氨基酸476 PHE、214 GLN、100 PHE形成常規氫鍵,鍵長范圍1.9~2.3 ?(圖2、3)。
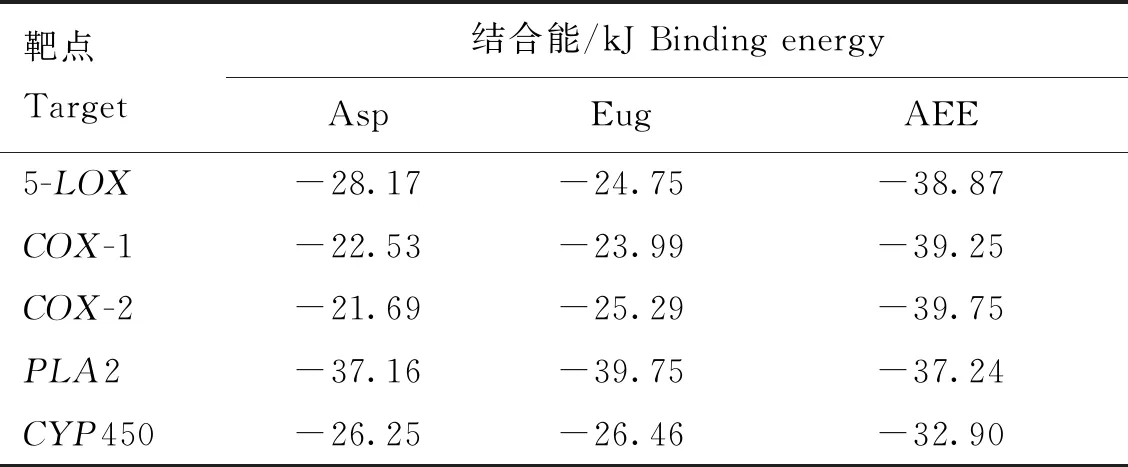
表4 AEE化合物活性成分和靶蛋白對接結果
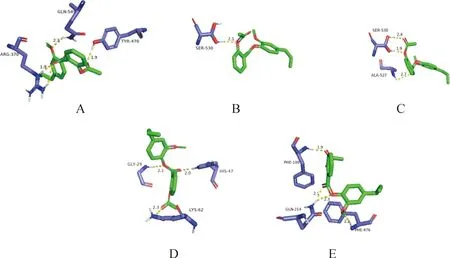
圖3 AEE與5-LOX(A),COX-1(B),COX-2(C),PLA2(D)和CYP450(E)氫鍵示意圖
3 討 論
炎癥是對健康至關重要的防御機制,是免疫系統對有害刺激的反應。通常,在炎癥反應中,細胞和分子相互作用能有效地減少損傷感染。這一過程有助于組織穩態的恢復和急性炎癥的解決。IL-1β是免疫病理中有效的促炎細胞因子,能誘導局部炎癥和中性粒細胞、單核細胞和巨噬細胞的募集和激活[20-21],TNF-α是在急性炎癥過程中產生的炎癥細胞因子,在細胞內參與多種信號活動,導致細胞壞死或凋亡。近年來,研究發現TNF-α正在成為腫瘤治療的靶點[22-23]。IL-6能誘導B細胞分化和抗體產生,誘導T細胞增殖、活化,參與機體的免疫應答,是炎性反應的促進劑。IL-8可以激活中性粒細胞并參與中性粒細胞介導的組織損傷。炎癥因子是檢測各種疾病的重要標志物,在許多炎癥疾病中,炎癥因子都會表現異常,因而降低炎癥因子的表達水平在炎癥疾病中發揮重要作用。
LPS刺激RAW264.7細胞是一種常見的細胞炎癥模型。RAW264.7細胞是一種巨噬細胞,是幾乎存在于所有組織中的重要免疫效應細胞,不僅能清除細胞碎片,還釋放多種介質,包括促炎酶、細胞因子等[24]。LPS可激活巨噬細胞并引發多種炎癥反應,包括釋放促炎介質和細胞因子,如TNF-α、IL-8和誘導型一氧化氮合酶(iNOS)[25-26]。本研究發現,1 μg·mL-1的LPS處理細胞,誘導了細胞炎癥,證明了炎癥模型造模成功。前期,Xie等[25]采用1 μg·mL-1的LPS,誘導了RAW264.7細胞的炎癥和氧化應激模型。Li等[27]采用同樣濃度的LPS誘導了RAW264.7細胞的炎癥模型。因此,本試驗炎癥模型建立成功,并且與前期研究結果相一致。
Liu等[28]研究發現,Asp治療可抑制炎癥早期LPS誘導的巨噬細胞活化。Murakami等[29]報道,Eug相關化合物可能通過抑制核因子κB(NF-κB)的激活而發揮抗氧化和抗炎作用。在對AEE的前期研究中,通過小鼠耳腫脹模型、腹腔毛細血管通透性增高模型、小鼠足跖腫脹模型及肉芽腫模型評估了AEE的抗炎作用。相關結果表明,0.18 g·kg-1的AEE具有明顯的抗炎作用,其能顯著抑制耳腫脹度,降低毛細血管通透性,抑制足跖腫脹和肉芽腫增生[30]。本研究發現,Asp、Eug、AEE也有同樣的抗炎效果。ELISA檢測AEE對LPS誘導的炎癥細胞因子水平試驗中,不同劑量的AEE處理能極顯著降低炎癥因子IL-1β、IL-6、IL-8、TNF-α表達水平;與Asp和Eug組比較,等摩爾的AEE與其無顯著差異,表明其抗炎效果相當。然而,比較平均值發現,AEE抗炎作用更強;不同劑量的AEE之間差異不顯著,但中劑量的AEE效果優于低劑量組和高劑量組。
花生四烯酸是炎癥反應的有效媒介,參與了多種疾病的發病過程,是COX、LOX和CYP450途徑產生前列腺素、白三烯和環氧二十碳三烯酸(EETs)的首選底物。這些途徑是治療炎癥、疼痛、過敏、哮喘、心血管疾病的藥物的靶點,最近還被用于抑制腫瘤相關炎癥。COX是前列腺素合成中的限速酶,其有兩種同工酶,即COX-1和COX-2。LOX酶在多種細胞中表達,它們具有多種生理功能,包括誘導炎癥、皮膚紊亂和腫瘤發生[31]。AA也是LOX產生白三烯和脂素的底物。CYP450產生兩種主要的二十碳烯類產物:由CYP環氧合酶形成的EETs和由CYP羥化酶形成的羥基二十碳四烯酸(HETE)[32]。相關研究表明,Asp是COX酶的非選擇性抑制劑,體內外對COX-1和COX-2均有很好的抑制活性。Asp通過乙酰化COX-2,將AA代謝成15(R)-羥基二十碳三烯酸,從而觸發脂氧素A4(LXA4)的產生[33]。在動脈中,LOX-5生物合成LXA4,在血小板中,LOX-12生物合成白三烯B4。炎癥期間,LXA4在血管腔和管壁內形成,使這種脂質處于調節血管功能的有利位置[34]。研究發現,酚類化合物對PLA2的表達有很好的抑制作用。Singh等[35]證實,Asp能和PLA2發生特異性的結合,對其具有一定的抑制作用。此外,Wen等[36]證實,給大鼠長期飼喂Asp,能夠增加大鼠肝線粒體的數量以及ALT和AST水平,引起CYP450的代謝活性改變;Asp具有抑制COX和LOX的作用,并能促進抗炎脂氧蛋白A4的產生[37]。近來研究顯示,20-HETE下游信號通路激活的異常AA代謝與癌癥的發生存在一定聯系,為癌癥的化學預防和治療提供了新的分子靶點[38]。本試驗RT-PCR結果表明,不同劑量的AEE處理能顯著降低花生四烯酸代謝通路關鍵酶的mRNA表達量;與Asp和Eug組比較,等摩爾量的AEE能夠顯著降低花生四烯酸代謝通路關鍵酶PLA2的表達量,AEE的抗炎作用強于Asp;不同劑量的AEE之間差異不顯著;試驗結果表明,不同劑量的AEE處理對炎癥因子和花生四烯酸代謝通路關鍵酶值都有降低作用,AEE與Asp、Eug的作用相當,同時不同劑量的AEE之間無統計學差異,但中劑量的AEE抗炎效果較好。
Balasundaram和David等[39]通過分子對接手段,研究Asp與PDE7B在神經炎癥中的分子建模及對接分析。分子對接手段是一種基于受體特性以及受體與藥物分子相互作用的設計方法,廣泛應用于藥物發現。最初,分子對接是為了幫助理解小分子和大分子之間的分子識別機制而開發的,可在分子水平上預測配體與受體的相互作用。經過不斷的發展和完善,分子對接已廣泛應用于藥物和靶蛋白相互作用的研究中,并在新藥研發領域有著重要作用。前期研究證實,分子與靶蛋白結合能越小,其結合能力越高[40]。在本研究中,通過分子對接探討Asp、Eug、AEE與AA代謝通路關鍵酶的相互作用,結果顯示,AEE與靶蛋白的結合能均低于-20.9 kJ,表明AEE與靶蛋白結合穩定且質量高。
4 結 論
本研究表明,AEE處理能夠抑制LPS誘導的RAW264.7細胞中炎癥因子IL-1β、IL-6、IL-8、TNF-α的表達水平,降低AA代謝通路關鍵酶COX-2、COX-1、PLA2、CYP450和5-LOX的mRNA表達量,且和靶蛋白結合能較低,具有良好的結合活性,推測AA代謝可能是其發揮抗炎作用的途徑。

