環狀RNA ciRS-7靶向miR-219a-5p影響微小隱孢子蟲體外增殖的機制
尹艷玲,黃 爽,姚 倩,吳江平,郭浩晨,楊 新,宋軍科*,趙光輝*
(1.西北農林科技大學動物醫學院,楊凌 712100; 2.重慶三峽職業學院,重慶 404155)
隱孢子蟲(Cryptosporidium)是一種重要的專性細胞內寄生的頂復門原蟲,主要寄生于宿主的胃腸道上皮細胞,引起腹瀉為主的胃腸道疾病[1-2]。免疫功能正常的個體感染后通常表現為自限性腹瀉,而免疫功能缺陷個體(如HIV患者和器官移植患者)感染后會出現長期慢性腹瀉和嚴重的消化不良,甚至死亡[3]。隱孢子蟲也是導致發展中國家兒童腹瀉的第二大原因,據報道,在南亞和撒哈拉以南的非洲等欠發達地區,每年兩歲以內兒童的隱孢子蟲感染人數高達470萬例[4-6]。但是,目前尚無有效防控隱孢子蟲病的疫苗,美國食品藥品監督管理局(Food and Drug Administration,FDA)批準的可用于治療隱孢子蟲病的唯一一種藥物——硝唑尼特對于免疫功能缺陷個體治療無效,且不能用于治療最易感的嬰幼兒群體(< 1歲)[7-8]。考慮到隱孢子蟲病的嚴重程度與宿主狀態密切相關,解析宿主和隱孢子蟲的相互作用對于制定有效防控隱孢子病的策略至關重要。
環狀RNA(circular RNA,circRNA)是一類無5′和3′自由末端的共價閉環非編碼RNA,對RNase R耐受,比線性RNA更為穩定[9]。circRNA具有多種功能,包括充當miRNA海綿、作為蛋白質和mRNA的調節因子以及翻譯成蛋白質等,其中,研究較多的是充當競爭性內源RNA(competitive endogenous RNA,ceRNA)發揮miRNA海綿作用[9-12]。據報道,細菌、病毒以及寄生蟲等病原感染均可導致宿主circRNA的差異表達,且circRNA在宿主應對病原感染的反應中發揮著重要的調控作用[13-15]。作者前期利用微陣列芯片技術檢測微小隱孢子蟲(C.parvum)感染的HCT-8細胞circRNAs表達譜發現,顯著上調的circRNA ciRS-7可通過海綿吸附miR-1270調節NF-κB信號通路促進C.parvum在HCT-8細胞中的增殖[16]。生物信息學分析發現,ciRS-7可能與22個miRNAs存在靶向互作關系[16]。研究表明,miR-219a-5p可通過調控炎癥和多種細胞功能(如細胞活力、細胞增殖和細胞凋亡等)在腸易激綜合征、肝病和多種癌癥中發揮重要作用[17-20]。在非小細胞肺癌(NSCLC)中,ciRS-7可通過靶向miR-219a-5p調節細胞活力、遷移和侵襲以及細胞凋亡影響NSCLC的進展[20]。基于此,本研究探討了ciRS-7與miR-219a-5p在HCT-8細胞中的靶向關系,以及ciRS-7/miR-219a-5p軸對C.parvum在HCT-8細胞中增殖的影響及其機制。
1 材料與方法
1.1 細胞和蟲株
人結腸癌HCT-8細胞由廣東省農業科學院動物衛生研究所獸醫寄生生物學研究室饋贈;C.parvum卵囊由河南農業大學動物醫學院張龍現教授團隊贈送,保存于西北農林科技大學寄生蟲學實驗室。
1.2 細胞培養
HCT-8細胞在含10%胎牛血清的1640培養基中以37 ℃和5% CO2的培養條件進行培養。
1.3 C. parvum卵囊的傳代與純化
為保證卵囊活力,卵囊需每3個月在新生犢牛體內進行擴繁傳代,擴繁得到的卵囊經氯化銫密度梯度離心純化處理后,重懸于添加100 U·mL-1青霉素、100 μg·mL-1鏈霉素和0.25 μg·mL-1兩性霉素B的1×PBS中,置4 ℃冰箱保存備用。
1.4 體外感染模型
將細胞均勻地接入細胞培養板中培養24 h。待細胞匯合度達到80%后,按照卵囊∶細胞=(2~10)∶1比例進行感染,感染時使用無血清RPMI 1640培養基,4 h后更換為含10%胎牛血清的1640培養基繼續培養[21]。
1.5 總RNA提取和反轉錄
使用Trizol試劑(艾科瑞,湖南)提取細胞總RNA,Nano-100微量分光光度計(奧盛,杭州)測定RNA的濃度。用于miRNA表達分析的模板按照Mir-X miRNA First-Strand Synthesis Kit說明書對總RNA進行反轉錄,反應體系為10 μL,包括0.25~0.80 μg cDNA、5 μL mRQ Buffer(2×)、1.25 μL mRQ Enzyme,剩余部分用DEPC水補齊;反應程序為37 ℃ 1 h,85 ℃ 5 min。
用于其它基因表達分析的模板按照Evo M-MLV反轉錄試劑盒(艾科瑞,湖南)說明書對總RNA進行反轉錄,先去除基因組DNA,反應體系為10 μL,包括1 μg cDNA、2 μL 5×gDNA Clean Buffer、1 μL gDNA Clean Reagent,剩余部分用DEPC水補齊;反應程序為42 ℃ 2 min。然后反轉錄成cDNA,向上一步反應物中加入1 μL RT Primer Mix、1 μL Evo M-MLV RTase Enzyme Mix、4 μL 5× RTase Reaction Buffer Mix I以及4 μL DEPC水;反應程序為37 ℃ 15 min,85 ℃ 5 s。
1.6 實時定量聚合酶鏈反應(qRT-PCR)
miRNA的qRT-PCR反應體系包括2 μL cDNA、12.5 μL TB Green?Premix Ex TaqTMII(Tli RNaseH Plus)、0.5 μL ROX Dye(50×)、0.5 μL miRNA-specific forward primer、0.5 μL mRQ3’primer、9 μL ddH2O;反應程序:95 ℃ 10 min;95 ℃ 15 s,退火30 s,40個循環。采用2-ΔΔCt方法進行計算miRNA的相對表達水平,以u6基因作為內參對照[22]。
其他基因的qRT-PCR反應體系包括5 μL cDNA、1 μL Primer mix、4 μL DEPC水和10 μL 2×SYBR Green Mix;反應程序:95 ℃ 10 min;95 ℃ 10 s,退火30 s,72 ℃ 32 s,40個循環。采用2-ΔΔCt方法進行計算基因的相對表達水平,以GAPDH基因作為內參對照[21]。引物信息見表1。
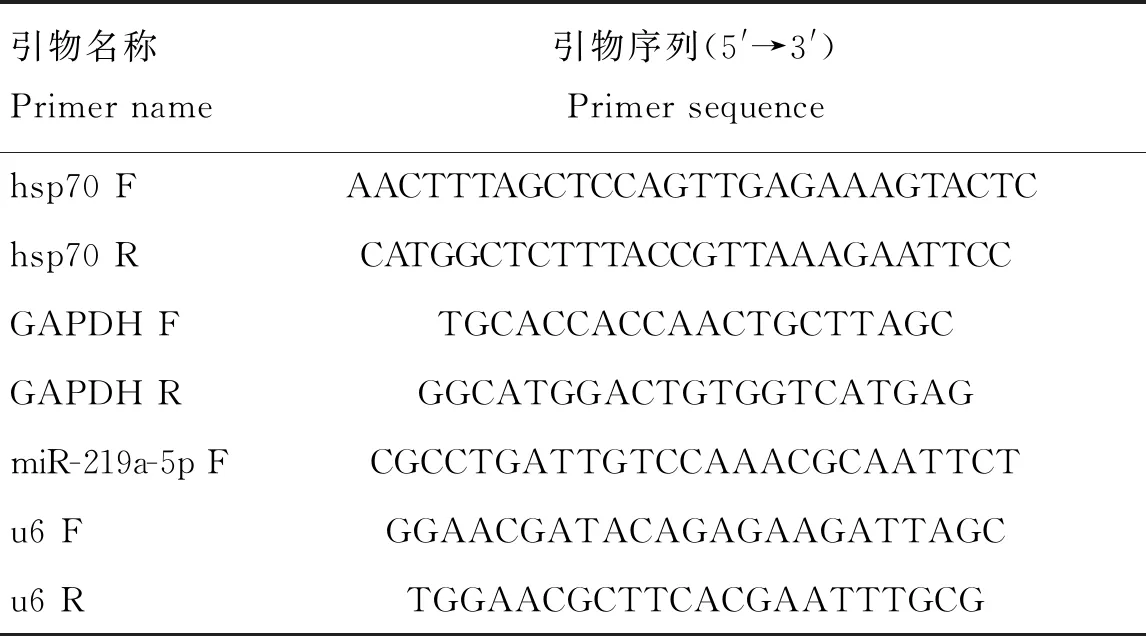
表1 qRT-PCR引物信息
1.7 細胞轉染
按照Lipofectamine 2000試劑說明書分別將pcDNA3.1(+)-ciRS7 Exon質粒(Addgene,美國)及其對照pcDNA3.1(+)質粒(實驗室保存)、ciRS-7干擾RNA(si-ciRS-7)及其對照si-control(銳博,廣州)、miR-219a-5p mimics及其對照mimics control(吉瑪,上海)、miR-219a-5p inhibitor及其對照inhibitor control(吉瑪,上海)轉染至HCT-8細胞中。
1.8 雙熒光素酶報告載體的構建
1.8.1 野生型載體的構建 通過在線工具starBase v3.0(http://starbase.sysu.edu.cn/index.php)預測到ciRS-7序列上存在的miR-219a-5p的結合位點,以此設計包含結合位點在內的ciRS-7野生型(ciRS-7-WT)片段的PCR擴增引物(表2),于引物的上下游分別添加保護堿基和SacI和SalI限制性內切酶位點;經PCR擴增得到ciRS-7-WT的擴增產物,然后將擴增產物回收純化;連接至pMDTM19-T(上海生工)載體上,16 ℃過夜連接;將pMDTM19-T-ciRS-7-WT連接產物轉化至大腸桿菌JM-109感受態細胞中;于LB固體培養基(含0.1% Amp)中,37 ℃培養箱內過夜培養后挑取菌落;以菌液為模板進行PCR擴增;對陽性菌液進行擴大培養,提取pMDTM19-T-ciRS-7-WT重組質粒;將pMDTM19-T-ciRS-7-WT質粒和pmirGLO進行雙酶切,得到線性化的pmirGLO質粒和ciRS-7-WT片段連接后按照上述操作步驟,最終得到mirGLO-ciRS-7-WT重組質粒[23];進行測序和雙酶切鑒定;將構建成功的pmirGLO-ciRS-7-WT重組質粒置于-20 ℃保存備用。

表2 包含miR-219a-5p結合位點的野生型ciRS-7的引物信息
1.8.2 突變型載體的構建 將ciRS-7和miR-219a-5p的結合位點突變后,包含ciRS-7和miR-219a-5p突變結合位點在內的ciRS-7突變序列(ciRS-7-MUT)由北京擎科生物科技有限公司合成,在突變序列的頭尾分別添加保護堿基及SacⅠ和SalⅠ限制性內切酶位點;合成的突變序列直接連接到pmirGLO質粒上;擴大培養后提取pmirGLO-ciRS-7-MUT重組質粒;進行測序和雙酶切鑒定;將構建成功的pmirGLO-ciRS-7-MUT重組質粒置于-20 ℃保存備用。
1.9 雙熒光素酶報告基因試驗
使用96孔細胞培養板培養細胞;按照Lipofectamine 2000試劑說明書將pmirGLO-ciRS-7-WT重組質粒(或pmirGLO-ciRS-7-MUT重組質粒)或pmirGLO空質粒和miRNA mimics(或mimics control)轉染至HCT-8細胞中,培養48 h[23]。培養結束后,按照高靈敏性雙熒光素酶檢測試劑盒說明書進行熒光素酶活性檢測;首先利用1×Luc-Lysis II Buffer裂解細胞;再利用Spark多功能酶標儀(Tecan,瑞士),以Fluc工作液檢測螢火蟲熒光素酶的發光值,Rluc工作液檢測海腎熒光素酶發光值;最后計算出螢火蟲熒光素酶和海腎熒光素酶的發光比值。
1.10 蛋白質免疫印跡(Western blot)
RIPA裂解液提取細胞總蛋白樣品;按照30 μg·孔-1樣品上樣量進行SDS-PAGE凝膠電泳;電泳結束后將膠上的蛋白轉印到PVDF膜上;轉膜結束后,利用5%的脫脂奶粉溶液封閉PVDF膜,室溫1 h;4 ℃過夜孵育LC3B(1∶1 000,Abways,上海)、p62(1∶1 000,Abways,上海)和GAPDH(1∶500 000,ABclonal,武漢)抗體;次日孵育HRP標記二抗(1∶5 000,生工,上海);孵育結束后進行ECL發光成像;Image-Pro Plus 6.0軟件進行蛋白灰度分析。
1.11 統計分析
利用Student’st和IBM SPSS statistics 22.0檢驗方法進行統計學差異分析,采用Graphpad Prism V 6.07作圖;*.P<0.05表示差異顯著,**.P<0.01表示差異極顯著,***.P<0.001表示差異極極顯著。
2 結 果
2.1 C. parvum感染對HCT-8細胞自噬的影響
利用Western blot檢測C.parvum感染HCT-8細胞不同時間點的自噬相關蛋白LC3B-II和p62的表達情況。結果表明,與未感染對照相比,LC3B-II和p62蛋白質的表達量在C.parvum感染HCT-8細胞8、12、24、36和48 h均顯著(P<0.05)或極顯著(P<0.01)與極極顯著(P<0.001)升高(圖1)。
A. Western bolt分析LC3B-II和p62蛋白質在C. parvum感染HCT-8細胞中的表達;B. 對A圖中LC3B-II的蛋白質相對表達水平的灰度分析結果;C. 對A圖中p62的蛋白質相對表達水平的灰度分析結果。*.P<0.05,**.P<0.01,***.P<0.001,下同
2.2 ciRS-7對C. parvum感染誘發HCT-8細胞自噬的影響
為分析ciRS-7對C.parvum感染誘發的HCT-8細胞自噬的影響,通過過表達或干擾ciRS-7的表達后,檢測C.parvum感染HCT-8細胞中LC3B-II和p62的蛋白質表達水平。結果顯示,過表達ciRS-7顯著降低了C.parvum感染HCT-8細胞中的LC3B-II的蛋白質表達水平,但增加了p62的蛋白質表達水平(圖2A、2B);而干擾ciRS-7的表達顯著促進了C.parvum感染HCT-8細胞中的LC3B-II的蛋白質表達水平,但抑制了p62的蛋白質表達水平(圖2C、2D)。

A. Western bolt分析轉染pcDNA3.1(+)-ciRS-7質粒對感染細胞中的LC3B-II和p62蛋白質表達的影響;B. 對A圖中LC3B-II和p62的蛋白質相對表達水平的灰度分析;C. Western bolt分析轉染si-ciRS-7對感染細胞中的LC3B-II和p62蛋白質表達的影響;D. 對C圖中LC3B-II和p62的蛋白質相對表達水平的灰度分析
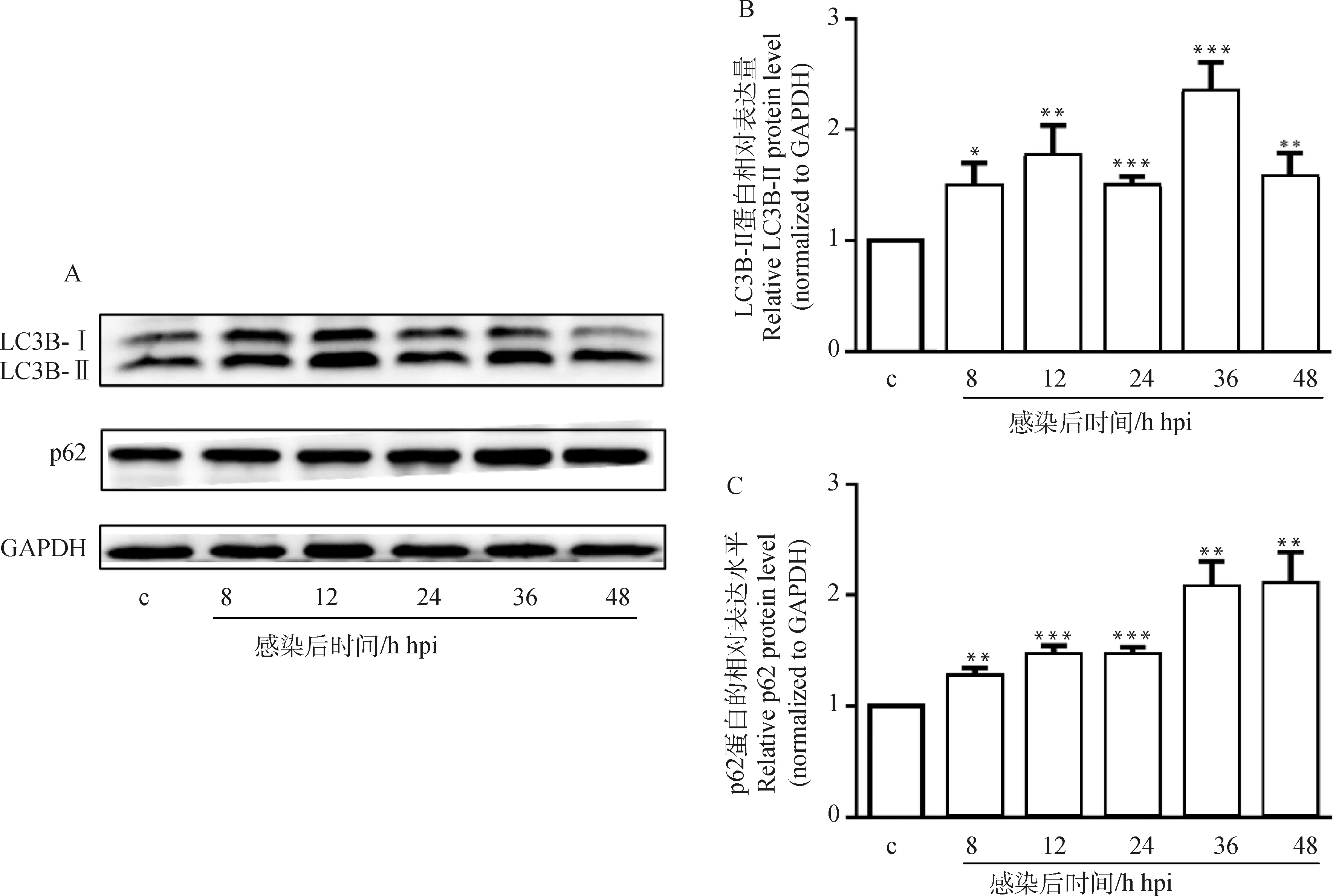
2.3 C. parvum感染HCT-8細胞中ciRS-7對miR-219-5p的靶向調節作用
利用qRT-PCR檢測到ciRS-7的靶miRNA miR-219a-5p的表達在C.parvum感染HCT-8細胞24 h時顯著下調(圖3A);過表達ciRS-7顯著抑制了C.parvum感染HCT-8細胞中miR-219a-5p的表達,而干擾ciRS-7表達的作用相反(圖3A);雙熒光素酶報告基因試驗分析發現,在HCT-8細胞中,miR-219a-5p mimics顯著降低了pmirGLO-ciRS-7-WT載體的熒光素酶活性,且不影響pmirGLO-ciRS-7-MUT載體和pmirGLO空載體的熒光素酶活性;上述結果表明,在C.parvum感染的HCT-8細胞中,ciRS-7對miR-219a-5p存在靶向調節作用(圖3B、3C)。
2.4 miR-219a-5p對C. parvum感染誘發HCT-8細胞自噬的影響
為了檢測miR-219a-5p對C.parvum感染誘發HCT-8細胞自噬的影響,通過轉染miR-219a-5p mimics或miR-219a-5p inhibitor后,檢測C.parvum感染HCT-8細胞中LC3B-II和p62的蛋白質表達水平。結果顯示,轉染miR-219a-5p mimics顯著增加了HCT-8細胞中miR-219a-5p的表達量,而轉染miR-219a-5p inhibitor顯著降低其表達量(圖4A);miR-219a-5p mimics顯著促進了C.parvum感染HCT-8細胞中的LC3B-II的蛋白質表達水平,但抑制了p62的蛋白質表達水平(圖4B、4C);而miR-219a-5p inhibitor顯著抑制了C.parvum感染HCT-8細胞中的LC3B-II的蛋白質表達水平,但促進了p62的蛋白質表達水平(圖4D、4E)。
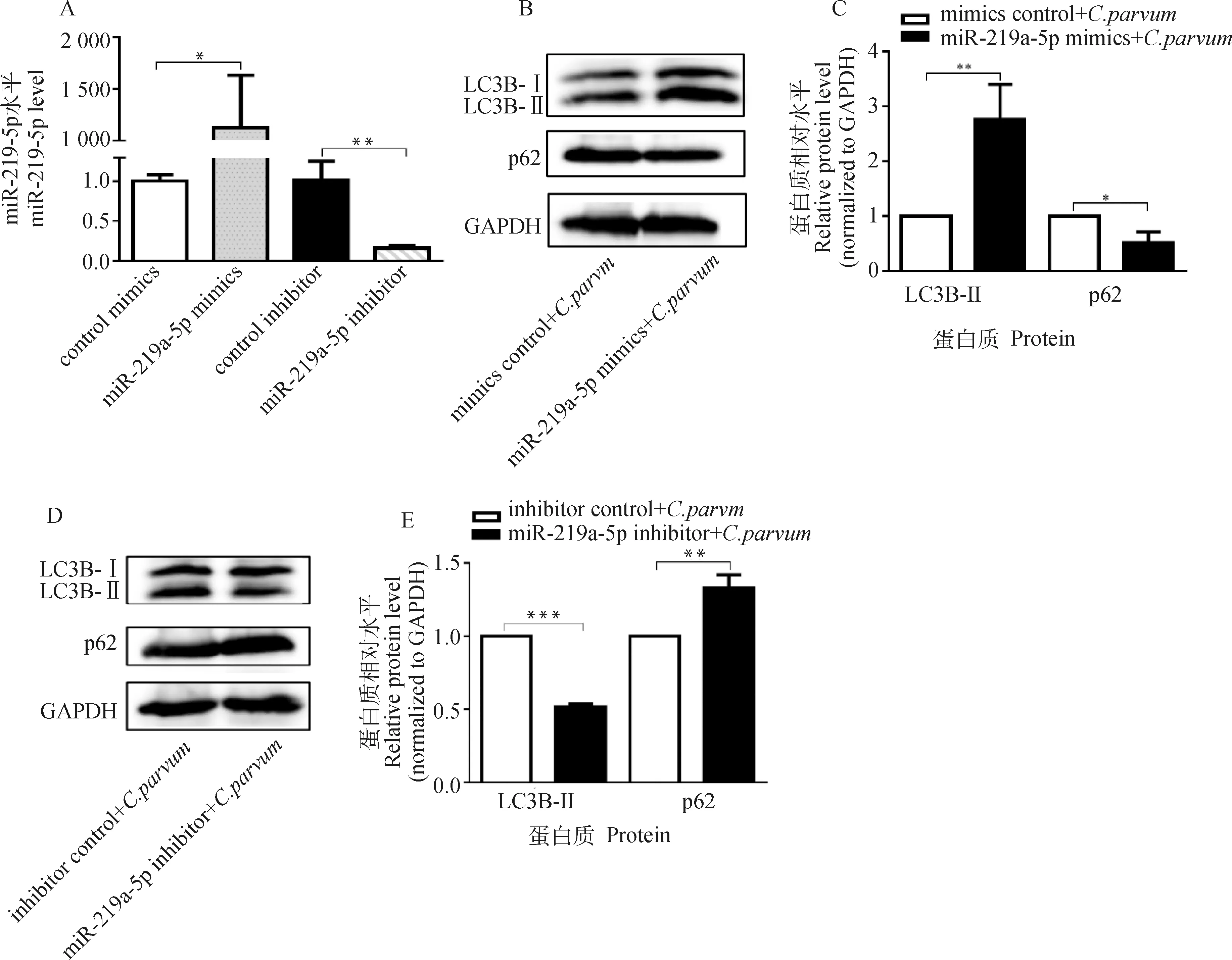
A. miR-219a-5p mimics和miR-219a-5p inhibitor的效果鑒定;B. Western bolt分析轉染miR-219a-5p mimics對感染細胞中的LC3B-II和p62蛋白質表達的影響;C. 對B圖中LC3B-II和p62的蛋白質相對表達水平的灰度分析;D. Western bolt分析轉染miR-219a-5p inhibitor對感染細胞中的LC3B-II和p62蛋白質表達的影響;E. 對D圖中LC3B-II和p62的蛋白質相對表達水平的灰度分析
2.5 ciRS-7/miR-219a-5p軸對C. parvum感染誘發HCT-8細胞自噬的影響
為確定ciRS-7是否通過靶向miR-219a-5p調節C.parvum感染誘發的HCT-8細胞自噬,通過共轉染pcDNA3.1(+)-ciRS-7質粒和miR-219a-5p mimics后,檢測C.parvum感染HCT-8細胞中LC3B-II和p62的蛋白質表達水平。結果顯示,在C.parvum感染的HCT-8細胞中,miR-219a-5p mimics逆轉了過表達ciRS-7對LC3B-II的蛋白質表達水平的抑制作用和p62的蛋白質表達水平的促進作用(圖5)。
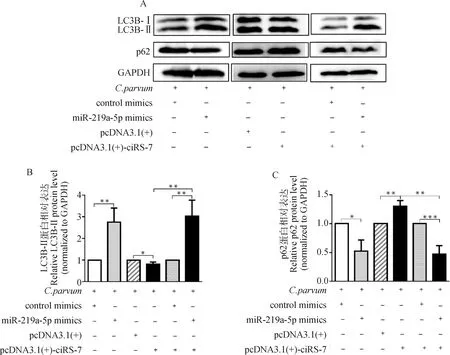
A. Western bolt分析轉染miR-219a-5p mimics或/和pcDNA3.1(+)-ciRS-7質粒對感染細胞中的LC3B-II和p62蛋白質表達的影響;B. 對A圖中LC3B-II的蛋白質相對表達水平的灰度分析;C. 對A圖中p62的蛋白質相對表達水平的灰度分析
2.6 ciRS-7/miR-219a-5p軸對C. parvum體外增殖的影響
由于自噬在清除寄生蟲感染的防御反應中發揮了重要作用,本研究利用qRT-PCR檢測了ciRS-7/miR-219a-5p軸對C.parvum在HCT-8細胞中增殖的影響。結果表明,miR-219a-5p mimics顯著降低了感染細胞中C.parvumhsp70基因的mRNA表達水平,而miR-219a-5p inhibitor顯著升高了感染細胞中C.parvumhsp70基因的mRNA表達水平(圖6)。進一步研究發現,miR-219a-5p mimics逆轉了過表達ciRS-7對感染細胞中C.parvumhsp70基因的mRNA表達水平的促進作用(圖6)。
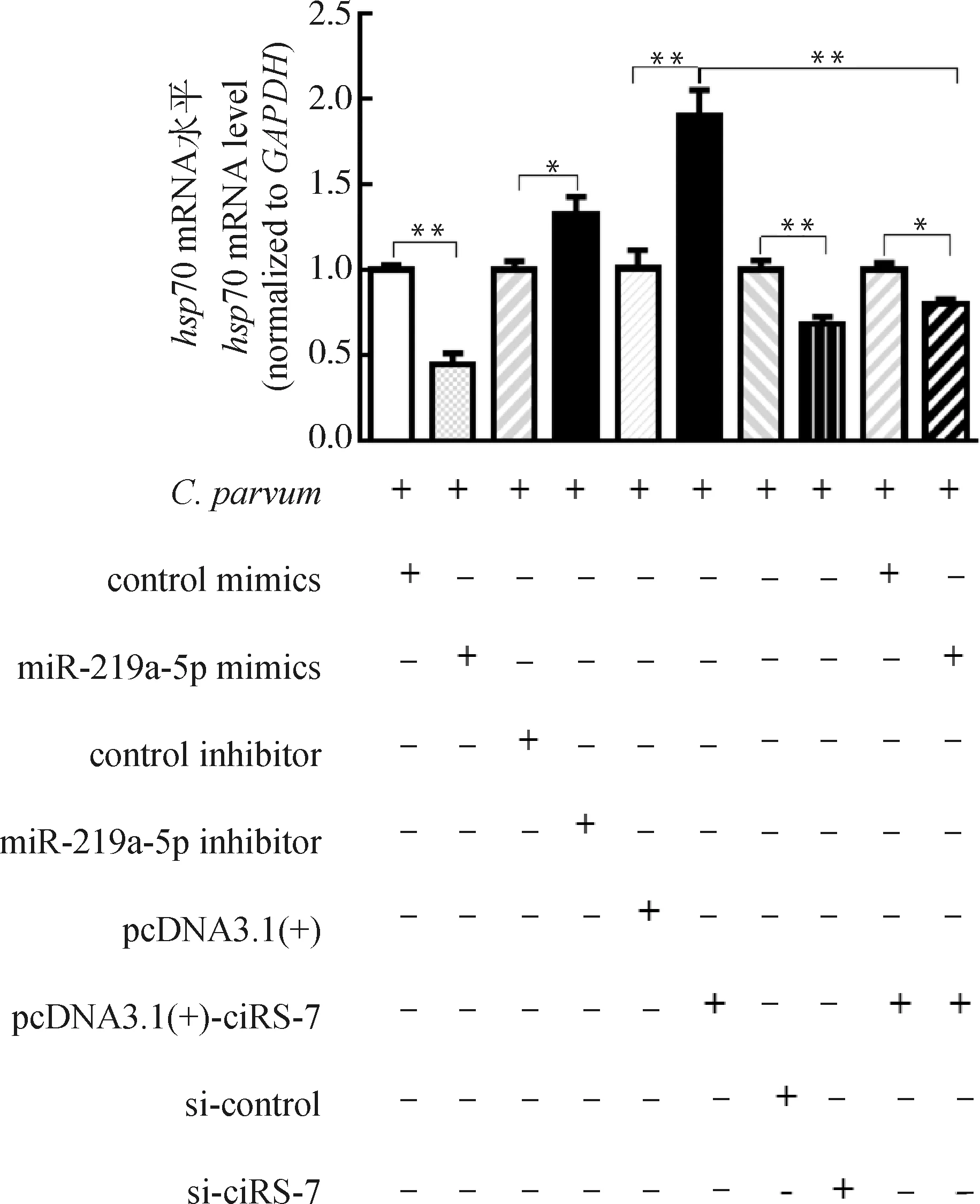
圖6 ciRS-7/miR-219a-5p軸對HCT-8細胞中C. parvum hsp70基因的mRNA表達的影響
3 討 論
細胞自噬在宿主抗寄生蟲感染的防御反應中起重要的作用。宿主通過自噬的降解作用可清除入侵細胞的寄生蟲,如細胞受到弓形蟲感染時通過啟動自噬來破壞弓形蟲的納蟲空泡膜(parasitophorous vacuole membrane,PVM),從而清除弓形蟲的速殖子[24];伯氏瘧原蟲(Plasmodiumberghei)早期感染細胞內脂化的LC3B-II直接結合在PVM上,并通過募集自噬受體p62、NBR1和NDP52以及泛素等來清除瘧原蟲[25]。寄生蟲也可通過抑制細胞自噬、誘導細胞的不完全自噬甚至利用宿主的自噬來促進自身的增殖,如弓形蟲可以通過激活EGFR/Akt通路,抑制LC3在其周圍的積累,從而逃避宿主自噬對其的清除[26];伯氏瘧原蟲的UIS3蛋白通過結合PVM上的LC3來抑制肝細胞的自噬,以促進自身的存活[27];克氏錐蟲(Trypanomacruzi)感染時可通過誘導細胞發生不完全自噬來逃避宿主的自噬清除作用[28];利什曼原蟲(Leishmaniaspp.)感染可以雙相和時間依賴性的方式抑制(感染早期)或誘導(感染后期)宿主自噬來促進自身的生長和發育[29]。蔣衡[30]研究發現C.parvum在感染12~24 h時誘導了HCT-8細胞的不完全自噬,與本研究的結果相似,作者發現C.parvum感染HCT-8細胞8~48 h均顯著誘導了細胞的不完全自噬。但與Priyamvada等[31]的研究結果存在差異,他們發現C.parvum感染24 h時可顯著誘導Caco-2細胞的完全自噬,這種差異可能是由于不同的C.parvum亞型、感染方法以及細胞模型所致。
前人研究證實,circRNA可通過調節自噬相關蛋白和自噬相關途徑來直接激活或抑制自噬,同時circRNA可通過海綿吸附miRNAs來間接調控自噬[32]。食管鱗狀細胞癌(esophageal cell squamous carcinoma,ESCC)細胞中顯著上調的ciRS-7可通過靶向miR-1299上調EGFR的表達,誘導EGFR下游Akt-mTOR通路的激活,從而抑制饑餓或雷帕霉素誘導的ESCC細胞自噬[33]。在骨關節炎(osteoarthritis,OA)中,ciRS-7/miR-7軸可調節OA引起的軟骨降解和自噬抑制過程,過表達ciRS-7或干擾miR-7的表達時可誘導OA軟骨細胞的自噬并緩解軟骨降解,反之,干擾ciRS-7或增加miR-7的表達時則會抑制OA軟骨細胞的自噬并加重軟骨降解[34]。在本研究中,過表達ciRS-7顯著抑制了C.parvum感染誘發的HCT-8細胞自噬,而干擾ciRS-7的表達顯著促進了C.parvum感染誘發的HCT-8細胞自噬,表明ciRS-7正調控C.parvum感染誘發的HCT-8細胞自噬。此外,ciRS-7的靶miRNA miR-219a-5p在C.parvum感染的HCT-8細胞中顯著下調,過表達ciRS-7顯著降低了C.parvum感染HCT-8細胞中的miR-219a-5p的表達,而干擾ciRS-7的表達顯著增加了C.parvum感染HCT-8細胞中的miR-219a-5p的表達,并且通過雙熒光素酶報告基因試驗進一步證實了ciRS-7和miR-219a-5p在HCT-8細胞中存在結合活性,表明在C.parvum感染HCT-8細胞中,ciRS-7可靶向調節miR-219a-5p。進一步研究發現,miR-219a-5p mimics可顯著促進C.parvum感染誘發的HCT-8細胞自噬,而miR-219a-5p inhibitor則顯著抑制C.parvum感染誘發的HCT-8細胞自噬,且miR-219a-5p mimics可逆轉過表達ciRS-7時對C.parvum感染誘發的細胞自噬的抑制作用。綜上表明,在C.parvum感染期間,ciRS-7可通過靶向miR-219a-5p調控C.parvum感染誘發的HCT-8細胞自噬。
目前,基于基因水平檢測C.parvum在體內和體外感染模型中荷蟲量的靶標分子主要是18S rRNA基因和hsp70基因,其中,hsp70基因已用于檢測C.parvum在腸上皮細胞中的荷蟲量,且已證實了基于hsp70基因和18S rRNA基因的qRT-PCR方法檢測C.parvum的腸上皮細胞中的荷蟲量時的趨勢一致[35-37]。蔣衡[30]利用C.parvum18S rRNA基因的mRNA表達水平代表C.parvum在HCT-8細胞中的蟲體數量,發現具有抑制自噬作用的miR-30a可顯著增加C.parvum在HCT-8細胞中的蟲體數量,而具有促自噬作用的miR-26a則顯著降低C.parvum在HCT-8細胞中的蟲體數量。在本研究中,基于C.parvumhsp70基因得到的結果與之相似,作者發現,ciRS-7通過抑制C.parvum感染誘發的細胞自噬來促進C.parvum在HCT-8細胞中的增殖,而miR-219a-5p通過促進C.parvum感染誘發的細胞自噬來抑制C.parvum在HCT-8細胞中的增殖,且ciRS-7可通過靶向miR-219a-5p抑制C.parvum感染誘發的HCT-8細胞自噬,從而促進C.parvum在HCT-8細胞中的增殖。
4 結 論
本研究揭示了C.parvum感染誘發HCT-8細胞的不完全自噬,以及宿主circRNA ciRS-7通過靶向抑制miR-219a-5p的表達來抑制C.parvum感染誘發的HCT-8細胞的自噬,以促進C.parvum在HCT-8細胞中的增殖。

