非洲豬瘟病毒誘導豬紅細胞凋亡并促進豬外周血單核細胞的吞噬作用
楊云龍,馮永智,高 琦,鄭佳琛,王 衡,張桂紅,3,龔 浪*
(1.華南農業大學獸醫學院/廣東省動物源性人獸共患病預防與控制重點實驗室,廣東 510642;2.國家非洲豬瘟區域實驗室(廣州)/華南農業大學非洲豬瘟防控技術研究中心,廣州 510642;3.嶺南現代農業科學與技術廣東省實驗室茂名分中心,茂名 525000)
非洲豬瘟是由非洲豬瘟病毒(African swine fever virus,ASFV)引起的一種急性、熱性和高度接觸性傳染病。近日,農業農村部報道,截至2022年4月7日,2022年發生的非洲豬瘟(African swine fever,ASF)疫情為野豬1 938起,家豬388起。ASFV是一種以軟蜱和豬分別作為中間宿主和終末宿主的DNA病毒[1-2]。ASF起源于非洲,并于1921年在肯尼亞首次被報道,隨后蔓延至歐洲、南美洲以及歐亞交界處等地區[3]。我國首例ASF病例于2018年8月3日被報告,在隨后幾個月內蔓延至全國。此外,ASF在亞洲迅速蔓延,包括越南、韓國、柬埔寨、緬甸等,嚴重影響豬相關產品的生產和貿易與國家的社會經濟產業[4]。2022年,ASF疫情在全球持續蔓延,進一步表明需要加強對ASF疫情的監測。除了養豬企業應對ASF實行防控外,還需要對野豬感染ASFV采取有效的防控措施,以防止疫情的進一步蔓延。
ASFV是非洲豬瘟病毒科(Asfarviridae)、非洲豬瘟病毒屬(Asfivirus)的成員,基因組長度為170~190 kb,為雙鏈DNA病毒(dsDNA)。病毒在細胞質內復制,病毒顆粒呈二十面體對稱,直徑約為200 nm,具有同心結構,編碼近200種蛋白質[5-6]。CD2v是ASFV外膜蛋白中唯一的特征性病毒蛋白,它能介導RBC與病毒產生吸附現象。CD2v由ORF EP402R基因編碼,大小約45.3 ku,與T淋巴細胞表面的黏附受體CD2相似[7]。CD2v是一種糖蛋白,由一個信號肽、一個跨膜區和兩個免疫球蛋白樣結構域組成,它具有與CD2相似的氨基酸序列[8-11]。此外,豬紅細胞(RBCs)表面有CD2受體,因此ASFV可以吸附豬RBCs。由于其他豬源病毒不能吸附RBCs,因此ASFV具有吸附RBCs的獨特特性[12]。已發現從ASFV基因組中刪除EP402R基因會降低ASFV引起的死亡率,并可以延緩病毒血癥的發生和病毒向組織的傳播,這表明CD2v介導的ASFV吸附RBCs的能力有助于病毒在宿主中的傳播[11,13]。基于此,本研究擬探討ASFV吸附RBCs后對細胞凋亡的影響,以及ASFV吸附誘導RBCs發生凋亡后對豬外周血單核細胞(PBMs)吞噬能力的影響。
在這項研究中,作者通過感染ASFV的PAMs發現了血液吸附(haemadsorption,HAD)現象。進一步研究表明,ASFV可誘導RBCs發生凋亡。還發現凋亡的RBCs可以促進PBMs的吞噬作用,表明這種現象可能是加劇宿主ASFV感染傳播的另一種方式,為ASFV的感染傳播和致病機制的研究提供理論基礎。
1 材料與方法
1.1 細胞和病毒
豬肺泡巨噬細胞(PAMs)、豬外周血單核細胞(PBMs)和豬紅細胞(RBCs)均取自4周齡的斷奶仔豬;高毒力的ASFV分離株GZ201801分離自中國廣州,為基因Ⅱ型。
1.2 主要試劑
胎牛血清(FBS)、RPMI-1640培養基、細胞培養級別青霉素和鏈霉素抗生素、0.25% EDTA-胰酶均購自Gibco公司;十八烷基羅丹明B氯化物(R18)購自Life Technologies公司;Annexin V-APC染色試劑盒,購自Keygen Biotech公司;RIPA蛋白裂解液、蛋白酶抑制劑、4×Laemmle SDS-PAGE緩沖液(含有 DL-二硫蘇糖醇)、DAPI染色液購自Beyotime公司;Trans-Blot Turbo快速轉移系統購自Bio-Rad公司;Cleaved-caspase3、α-Tublin一抗購自CST公司;IRDye?800CW二抗購自LI-COR公司;Latex beads黃綠色熒光微球懸液購自Sigma公司。
1.3 主要儀器
CO2培養箱購自Thermo公司;細胞計數儀購自Countstar公司;倒置顯微鏡購自Leica公司;流式細胞儀購自Cytoflex公司;Odyssey成像系統購自LI-COR公司;激光共聚焦顯微鏡購自Olympus公司。
1.4 方法
1.4.1 病毒感染 將ASFV分別接種在PAMs和RBCs細胞中,并補充10%胎牛血清、2 mmol·L-1L-谷氨酰胺、100 U·mL-1青霉素、100 U·mL-1鏈霉素和0.4 mmol·L-1非必需氨基酸的培養基,并將細胞放置于5% CO2的37 ℃培養箱中培養。
1.4.2 病毒HAD50測定 參照Zhao等[14]的方法,將原代PAMs培養在96孔板中,并將病毒液進行10倍被比稀釋為8個梯度,感染于96孔板中接種的PAMs,在含有5% CO2的37 ℃細胞培養箱中孵育1 h后,棄掉上清液后換成10%胎牛血清的RPMI-1640培養基,同時添加含有1%的豬RBCs,在7 d內觀察HAD現象,并使用Reed和Muench方法計算ASFV的HAD50[15]。
1.4.3 病毒侵染檢測試驗 將ASFV接種PAMs和豬RBCs,并采用流式細胞術來檢測ASFV是否入侵豬RBCs。十八烷基羅丹明B(R18)是一種不溶于磷脂的親脂性探針,可插入病毒包膜[16]。當R18插入脂質膜后,R18的熒光會自猝滅,當病毒囊膜與細胞膜融合時,探針逐漸被稀釋并釋放熒光信號(Ex/Em=560/590 nm),采用流式細胞儀通過檢測熒光信號可以判斷病毒對細胞的入侵[17]。本研究將5 mL ASFV (HAD50=10-5·0.1 mL-1)的病毒液與5 μL R18染料(3 μmol·L-1)混合并在37 ℃細胞培養箱中避光孵育20 min。隨后,將混合物接種至分別鋪有1×105細胞數的原代PAMs或豬RBCs的24孔板中,將其置于4 ℃冰箱中孵育1 h以使病毒黏附到細胞表面。接下來,將板轉移到37 ℃細胞培養箱中培養1 h以使病毒進入細胞。此外,將5 mL RPMI-1640培養基和5 μL R18混合并接種細胞作為陰性對照。孵育后,收集PAMs和RBCs并使用流式細胞儀檢測入侵病毒的百分率。
1.4.4 細胞凋亡檢測 使用Annexin Ⅴ-APC細胞凋亡檢測試劑盒測定RBC凋亡情況,通過Cytoflex流式細胞儀和Cyexpert軟件進行檢測和結果分析。作者在1、3、5和7 d的4個時間點檢測感染0.1、1、3 MOI ASFV的RBC凋亡情況。將接種5×105RBCs的12孔細胞培養板中上清液棄掉,用1 mL PBS沖洗后接種ASFV,4 ℃冰箱放置1 h后轉移至5% CO2的37 ℃細胞培養箱中,孵育1 h后更換含有10% FBS的RPMI-1640培養基;隨后,將細胞置于37 ℃細胞培養箱中進行培養。在接種ASFV后的1、3、5和7 d收集紅細胞并使用Annexin V-APC細胞凋亡檢測試劑盒處理細胞,通過流式細胞術檢測RBCs凋亡情況。
1.4.5 Western blot試驗 將處理并收集的細胞在添加有蛋白酶抑制劑的RIPA蛋白裂解液中裂解,并添加4×Laemmle SDS-PAGE緩沖液(含有 DL-二硫蘇糖醇)在100 ℃下加熱15 min變性。然后根據說明書在 SDS-PAGE凝膠上分離蛋白質并使用Trans-Blot Turbo快速轉移系統將蛋白轉移到硝酸纖維素(NC)膜上。使用5%脫脂牛奶(溶解在 Tris 緩沖鹽水中)在 37 ℃下封閉NC膜1 h,然后與兔源Cleaved-Caspase3單克隆抗體室溫下孵育1 h或在4 ℃下孵育過夜。使用洗滌緩沖液(含0.1% Tween20的TBS)將膜洗滌3次(每次15 min),并與 IRDye?800CW紅外山羊抗兔源二抗在37 ℃下孵育1 h。將NC膜在洗滌緩沖液中洗滌3次,并使用Odyssey成像系統成像以顯示蛋白質條帶。α-Tublin蛋白用作蛋白上樣內參。
1.4.6 PBMs吞噬能力檢測 分別將接種1 MOI ASFV 1、2、3、4、5、6和7 d的5×105RBCs與10 μL 黃綠色熒光微球懸浮液一起添加到接種有5×105PBMs的12孔細胞培養板中,12 h后棄掉細胞上清液,并在孔板中加入1 mL PBS后放在室溫搖床上進行洗滌,共洗3次,每次15 min,以將未被吞入的黃綠色熒光微球充分清洗掉,使用DAPI對PBMs進行細胞核染色,5 min后用PBS在室溫搖床上洗滌3次,每次5 min,隨后通過激光共聚焦顯微鏡觀察PBMs細胞對各組黃綠色熒光微球的吞噬數量。
2 結 果
2.1 ASFV誘導RBCs發生凋亡
為探討ASFV吸附RBCs后對RBCs的影響,本研究檢測了接種ASFV的RBCs的凋亡情況。參照Zhao等[14]的方法測得ASFV的HAD50結果為10-6.875·mL-1。使用0.1 MOI ASFV接種1、3、5和7 d后,RBCs的凋亡百分率分別為1.27%、3.23%、7.39%和8.56%。使用1 MOI ASFV接種1、3、5、7 d后細胞的凋亡百分率分別為1.54%、3.73%、8.46%和10.74%。使用3 MOI ASFV接種1、3、5和7 d后,細胞的凋亡百分率分別為2.65%、5.01%、12.44%和18.61%(圖1A)。接種0.1、1、3 MOI ASFV的1、3、5、7 d后,檢測RBCs中Cleaved-caspase3蛋白表達水平,發現隨著接種劑量和時間的增加,細胞凋亡Cleaved-caspase3蛋白的表達水平顯著上調(圖1B)。以上結果表明,ASFV以劑量和時間依賴性誘導RBCs發生凋亡。
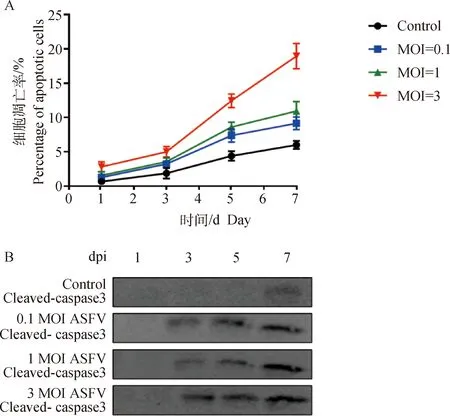
A.將RBCs分別接種0.1、1、3 MOI ASFV的1、3、5、7 d后,通過流式細胞術檢測RBCs凋亡情況;B.檢測凋亡蛋白Cleaved-Caspase3的表達水平
2.2 感染ASFV的PAMs產生HAD現象
在接種GZ201801-ASFV后,即使在接種了100倍稀釋病毒的孔中PAMs也顯示出明顯的HAD現象(圖2)。證實基因Ⅱ型ASFV具有吸附RBCs的能力。
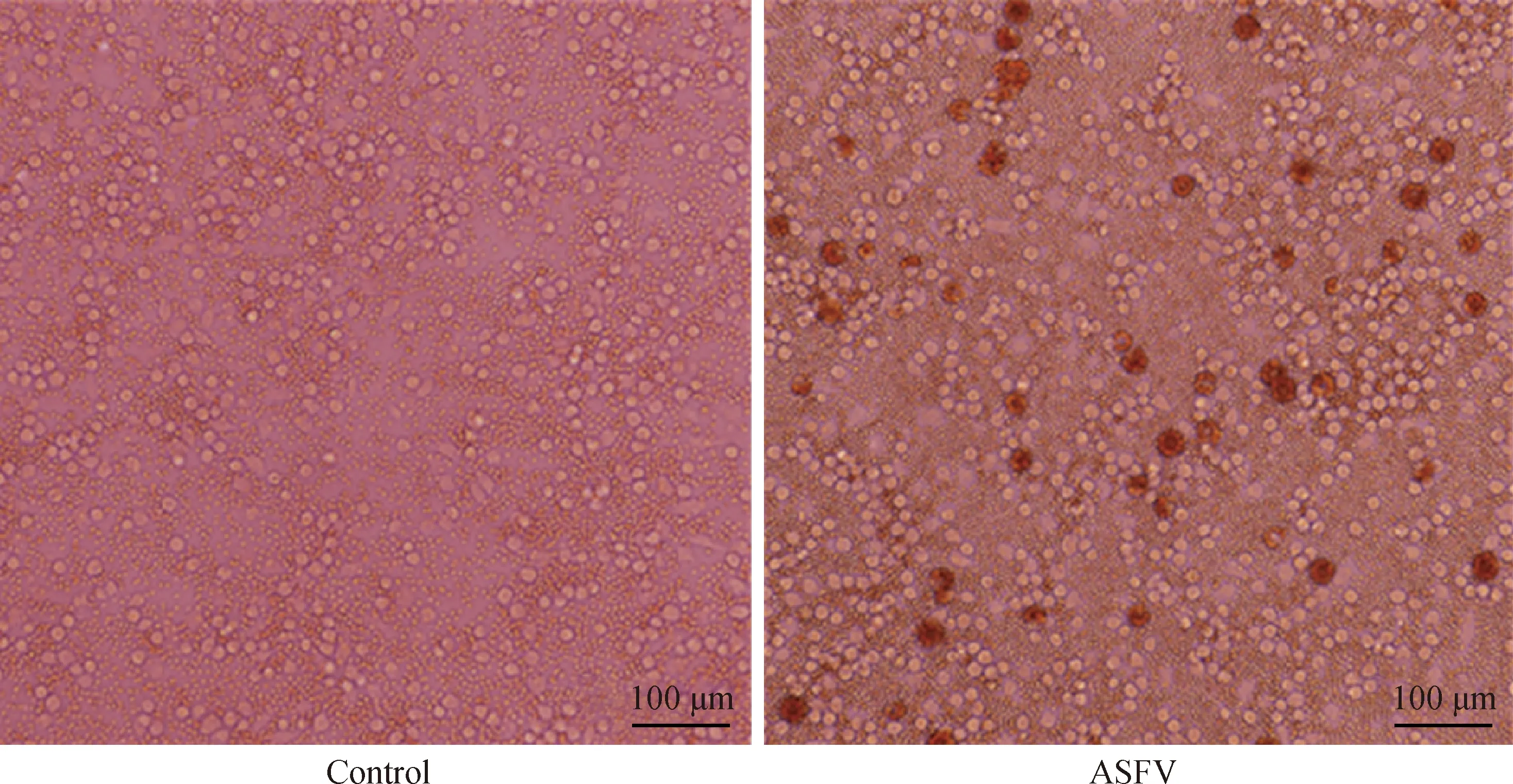
圖2 ASFV感染PAMs產生HAD現象
2.3 ASFV侵染PAMs而非RBCs
本研究以ASFV易感PAMs為陽性對照,通過檢測ASFV病毒囊膜和細胞膜的融合來判斷ASFV是否侵入RBCs。通過流式細胞儀檢測R18在細胞膜表面的熒光,結果顯示,ASFV感染的PAMs中具42.14%的細胞檢測到熒光,表明ASFV可以有效侵入PAMs;而ASFV處理的RBCs中未檢測到有熒光的細胞(0.2%在儀器誤差范圍內),表明ASFV不具有侵染RBCs的能力(圖3)。
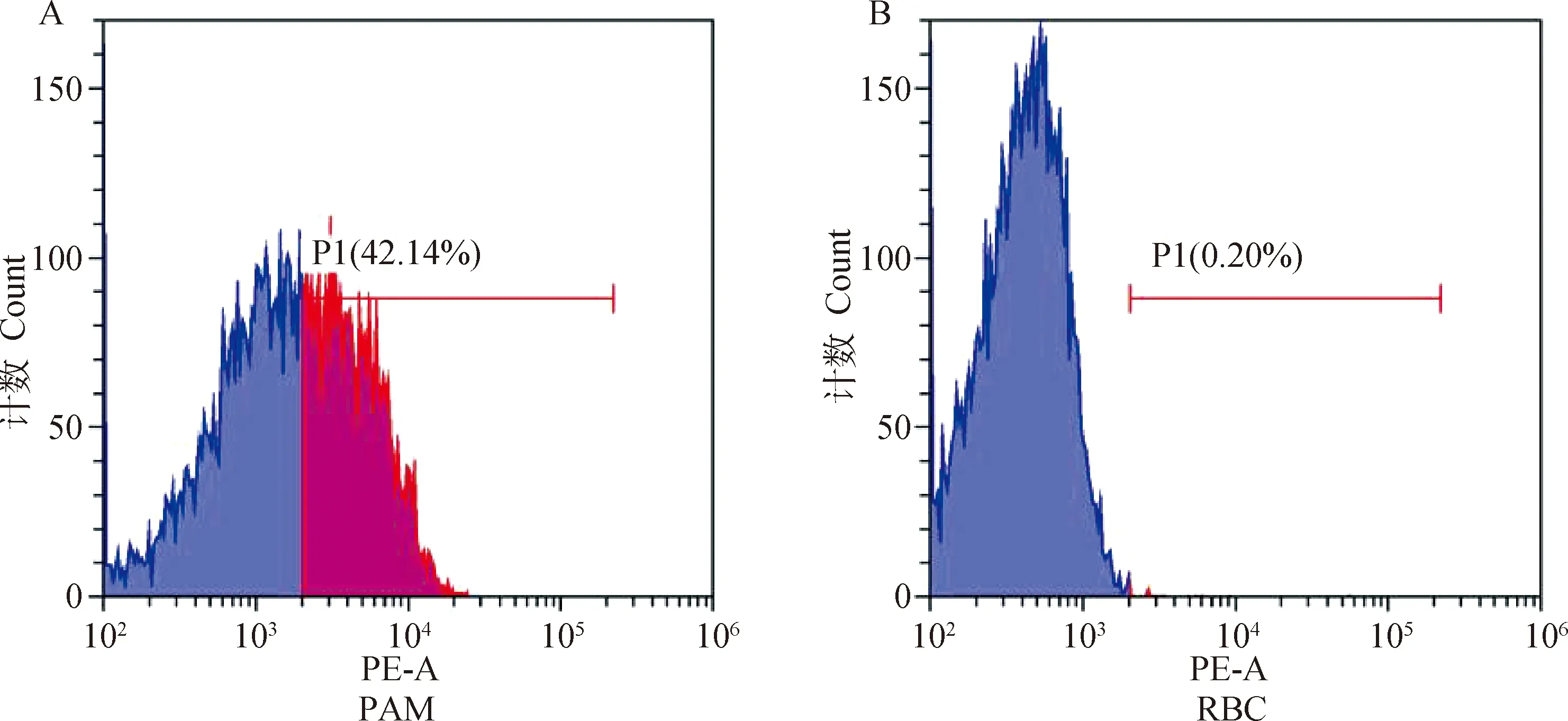
A. ASFV侵染PAMs的百分比;B. ASFV侵染RBCs的百分比
2.4 凋亡RBCs促進PBMs的吞噬作用
為確定凋亡的RBCs是否影響PBMs的吞噬能力,使用黃綠色熒光微球浮液來檢測PBMs吞噬能力的變化。用1 MOI ASFV處理RBCs 1、2、3、4、5、6和7 d后收集RBCs,并將處理的RBCs與黃綠色熒光微球懸浮液一起添加到PBMs中。12 h后,通過激光共聚焦顯微鏡觀察PBMs對黃綠色熒光微球的吞噬數量。結果顯示,隨著ASFV對RBCs處理的時間增加,被PBMs吞噬的黃綠色熒光微球數逐漸增加(圖4),藍色為細胞核,綠色為熒光微球。通過對接種ASFV的RBCs和PBMs進行吉姆薩染色,紅色箭頭為加入培養PBMs中的RBCs,發現隨著ASFV處理RBCs時間的增加,PBMs吞噬RBCs數逐漸增加(圖5)。結果表明,隨著ASFV誘導RBCs凋亡數的增加,PBMs的吞噬能力也顯著增強。
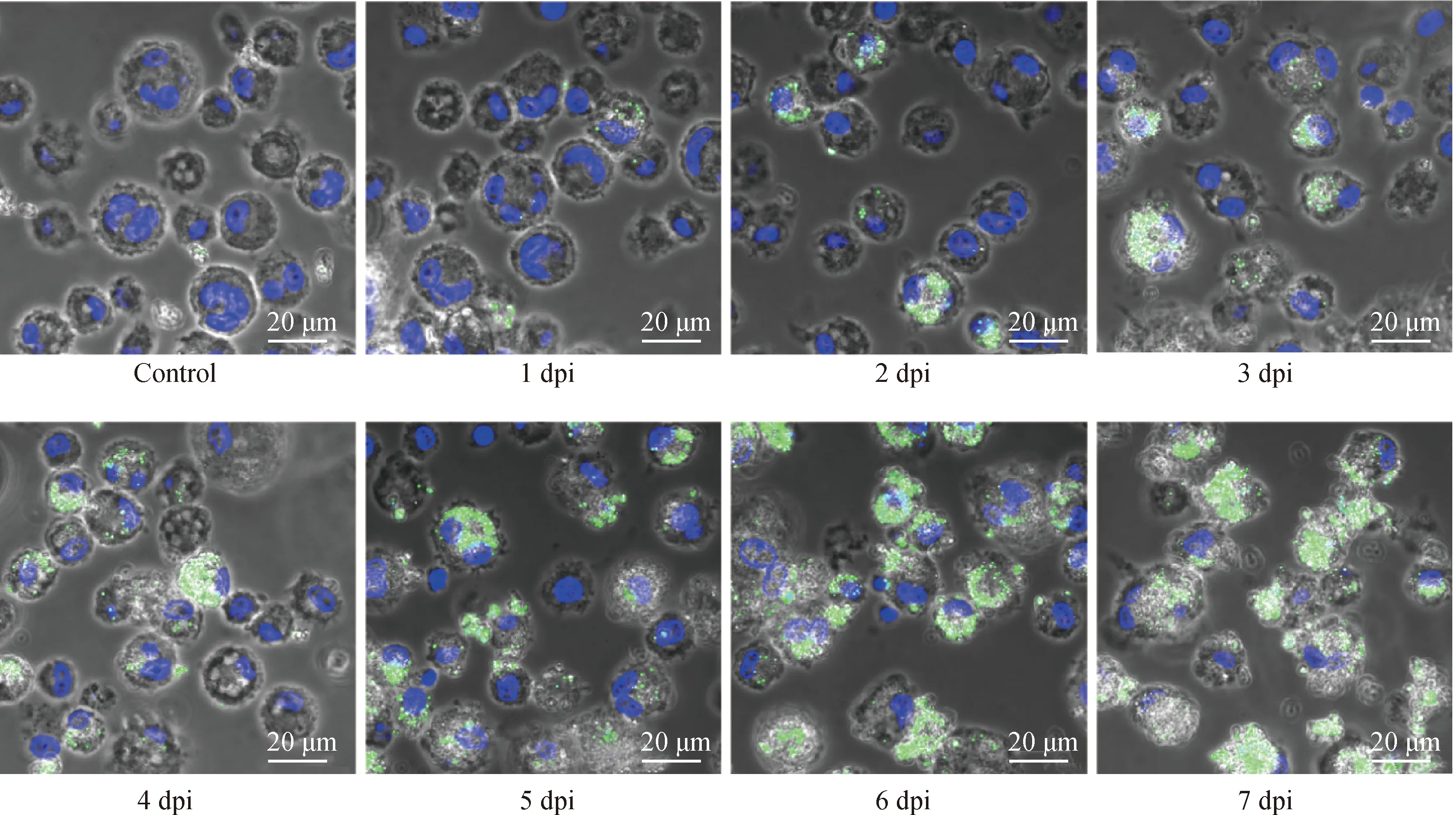
圖4 通過熒光微球觀察ASFV處理RBCs的Control和1、2、3、4、5、6、7 dpi組的PBMs吞噬紅細胞的能力
3 討 論
RBCs是血液中最豐富的血細胞類型,它們也是無脊椎動物通過血液運輸氧氣的最重要介質,并且具有重要的免疫功能。RBCs程序性死亡的正常生理過程受多種內外因素影響,如氧化應激、滲透性休克、病原體感染、供能不足等。這些內在或外在因素對RBCs造成一定程度的損傷后,機體會加速受損RBCs程序性死亡,避免受損細胞破裂溶血,進一步引發炎癥反應。本研究發現ASFV可誘導RBCs發生凋亡,凋亡的RBCs能促進PBMs的吞噬作用。因此,研究ASFV誘導RBCs凋亡的機制,將有助于更深入地了解ASFV的致病機制。紅細胞膜由雙層磷脂組成,內層含有磷脂酰絲氨酸(PS),細胞發生凋亡后,PS外翻到細胞膜外并被攜帶PS受體的巨噬細胞迅速識別,從而吞噬凋亡的RBCs[18]。RBCs暴露于Ca2+離子載體離子霉素后誘導細胞皺縮、細胞膜起泡形成凋亡小體和PS外翻,隨后在細胞表面暴露PS,發生細胞凋亡,PS暴露在細胞膜外表面會刺激吞噬細胞吞噬凋亡的RBCs[19],迅速將凋亡的RBCs從血液循環中清除,從而避免血液循環中存在有害的RBCs發生溶血和血紅蛋白(Hb)釋放[20]。PBMs是ASFV的靶細胞,當ASFV侵染豬體內后病毒進入血液感染PBMs,ASFV能誘導血液中RBCs發生凋亡并促進PBMs的吞噬功能,導致PBMs吞噬和感染病毒的數量增加。因此猜測ASFV誘導RBCs發生凋亡并促進單核細胞的吞噬功能是ASFV感染靶細胞的另一種方式。當ASFV感染PBMs時,受感染的PBMs會失去吞噬血液中凋亡RBCs的能力[21],這種現象可能與ASFV感染引起的溶血性貧血癥狀有關。此外,PS外翻后會增加紅細胞之間的黏附程度,增大了紅細胞與血管壁之間的摩擦力,并增加了細胞凋亡誘導的RBCs細胞膜的通透性,從而導致細胞質釋放的Ca2+激活纖維蛋白和血小板,活化血小板產生纖維蛋白[22],這導致細胞黏附和聚集成明顯的絲狀發射狀態,從而增加全血的黏度導致血管阻塞和血栓形成。
綜上所述,雖然ASFV在感染豬后會吸附于RBCs,加速病毒在全身的傳播,但ASFV不能侵染RBCs。說明RBCs不能成為潛在的ASFV靶細胞,然而ASFV可誘導RBCs發生凋亡并提升PBMs的吞噬能力。因此,阻止ASFV吸附RBCs可能會下調ASFV引起的RBCs凋亡水平,從而降低ASF感染引發的自身免疫性溶血性貧血的發生率。深入研究ASFV誘導RBCs細胞膜的脂質代謝、離子通道的激活等,可為ASF的防治提供更全面的理論依據。盡管針對ASF的疫苗正處于研發階段,但仍需要對ASFV的致病機制進行深入研究。因此,通過闡明ASFV與宿主細胞的相互作用,可以對ASF實施更有效的預防、控制和治療措施,以降低ASF對養豬業和國民經濟造成的危害。
4 結 論
本試驗檢測ASFV對RBCs的作用,發現ASFV不能入侵RBCs,但以時間和劑量依賴性方式誘導RBCs發生凋亡。同時,通過吉姆薩染色試驗和綠色熒光微球的處理發現,凋亡的RBCs可以增加PBMs的吞噬功能,ASFV誘導RBCs凋亡的百分比越高,PBMs的吞噬能力越強,表明這種現象是加劇宿主ASFV感染傳播的另一種方式。本研究為ASFV的感染傳播和致病機制的研究提供理論基礎。

