西門塔爾牛胰腺間充質干細胞原代培養及其多向分化潛能研究
王育南,吳 月,宋哈楠,張 濤,關偉軍*
(1.佳木斯大學基礎醫學院,佳木斯 154007; 2.中國農業科學院北京畜牧獸醫研究所,北京 100193)
根據世界衛生組織的數據,全世界有超過3.47億人患有糖尿病。糖尿病已成為僅次于癌癥和心腦血管疾病的第三大殺手。1900年,美國登記地區的糖尿病死亡率為10萬,1915年則為18萬。在波士頓的同一時期,這一數字從14萬上升到了26萬[1]。胰腺是人體第二大腺體,由內分泌部和外分泌部組成[2]。外分泌胰島形成一個重要的消化系統,產生消化酶,包括糜蛋白酶、淀粉酶和脂肪酶,用于消化蛋白質、降解碳水化合物和脂肪。內分泌胰島是幾種激素的來源,包括胰島素和胰高血糖素[3-4]。胰島素由胰腺中的β細胞分泌,是控制血糖最重要的代謝激素。所有形式的糖尿病其主要原因是胰島素的喪失,包括胰島β細胞產生/分泌的胰島素數量不足[5]。胰島移植曾被認為是一種很有前途的糖尿病治療方法。然而,研究表明只有十分之一的受試者在移植后5年內保持胰島素獨立。當誘導慢性免疫抑制以延長胰島移植物存活時間時,會導致許多疾病的發生。
近年來人們不斷探索新的治療方法,目前發現可以用干細胞移植治療來改善與胰島素分泌減少和胰島素敏感性降低相關的癥狀[6-7]。在胚胎中, 最早的胰腺來自背側和腹側前腸內胚層Pdx1陽性細胞群[8]。隨著研究的不斷深入,Scharfmann等[9]發現,胎兒胰腺中可能存在多種祖細胞,而在成體中是否存在多能的胰腺干細胞還未明確。近年有研究表明,從羊胚胎中分離得到的胰腺間充質干細胞可分化為β細胞,并改善了1型糖尿病小鼠的血糖[10]。胰腺間充質干細胞比其他間充質干細胞更容易分化為β細胞[11-12],且PMSCs在血管發育、趨化性和傷口愈合過程中高度富集[13]。然而,器官供體的缺乏限制了這些細胞在體外的分離和分化。鑒于此,本試驗對西門塔爾牛胰腺間充質干細胞進行分離培養鑒定,并研究其生物學特性及多向誘導分化潛能,為基礎獸醫和臨床糖尿病治療提供理論參考。
1 材料與方法
1.1 材料
1.1.1 試驗動物 3月齡健康雄性西門塔爾牛胚胎由中國農業科學院北京畜牧獸醫研究所昌平試驗基地提供。
1.1.2 試驗材料 胰蛋白酶(Tripsin)、胎牛血清(FBS)、DMEM/F12基礎培養基、L-DMEM基礎培養基、磷酸鹽緩沖液(PBS)均購自Gibco公司;膠原酶Ⅳ購自Sigma公司;封閉用山羊血清、FITC標記山羊抗兔二抗購自北京博奧森生物技術有限公司;CD29、CD44、CD73、CD90、CD34、CD45一抗購自美國Abcam公司;RNA逆轉錄試劑盒購自TaKaRa公司;胰島素生長因子-1 (IGF-1)、堿性成纖維生長因子(bFGF)、胰島素轉鐵蛋白(ITS)均購自英國Perotech公司;吉姆薩染液、油紅O染液、阿利新藍染液、糖原染液、茜素紅染液均購自索萊寶公司。激光共聚焦顯微鏡(Nikon公司),TH4-200倒置顯微鏡(Olympus公司),CO2培養箱(Heraeus公司),離心機(Eppendorf公司)。
1.2 方法
1.2.1 PMSCs的分離培養 在無菌條件下從3月齡西門塔爾牛胚胎中獲取胰腺組織,PBS洗滌3遍,切除腸系膜并將胰腺切成小塊(1 mm×1 mm×1 mm),膠原酶消化法:在37 ℃下用0.1%的膠原酶Ⅳ消化10~20 min。可見大量細胞從組織塊脫落,再用含10% FBS的DMEM/F12完全培養基中和消化反應。所得懸浮液經100目篩網過濾,并以1 200 r·min-1離心6 min。接種于細胞培養皿,培養2 d后,PBS清洗細胞,以去除非粘附細胞。組織塊貼壁法:將1 mm×1 mm×1 mm的小塊胰腺組織PBS洗3遍,貼于細胞培養皿,待組織塊牢固加DMEM/F12完全培養基(DEME/F12+10% FBS+10 ng·mL-1bFGF),在37 ℃,50 mL·L-1CO2的培養箱中培養。接種數天后,可見大量細胞從組織塊周圍爬出,匯合度達80%時傳代,進行后續培養。
1.2.2 PMSCs生長曲線及群體倍增時間檢測 將第3代、第9代和第15代細胞以1×104細胞·孔-1接種到24孔板中。自接種時起每24 h隨機選取3個孔分別收集細胞懸浮液進行細胞計數,連續計數8 d。根據平均值繪制生長曲線,計算群倍增時間(PDT)。PDT=(t-t0)lg2/(lgNt-lgN0),其中t0是培養開始時間,t是培養終止時間,N0是培養初始細胞數,Nt是培養最終細胞數。
1.2.3 PMSCs克隆形成能力檢測 將第3代、第9代、第15代的PMSCs細胞以100細胞·孔-1接種在6孔板中培養,2周后可見單個PMSCs形成較大克隆團,40 g·L-1多聚甲醛固定30 min,PBS洗2次,吉姆薩工作液染色20 min。顯微鏡下拍照觀察克隆形態并計算克隆形成率,克隆形成率=克隆形成數/接種細胞數×100%,試驗重復3次以計算平均值。
1.2.4 染色體核型檢測 用0.25%的胰蛋白酶消化貼壁細胞,顯微鏡下觀察多數細胞變圓發亮,且大部分細胞單個存在,添加秋水仙素0.2 μg·mL-1,于 37 ℃,50 mL·L-1CO2培養箱中繼續培養24 h,消化收集細胞,2 000 r·min-1離心10 min,棄上清,37 ℃低滲處理30 min, 1 mL固定液輕吹混勻,室溫靜置30 min,重復固定1次,后吸取細胞懸液在預冷的載玻片上方1.5 m處均勻滴下細胞懸液,室溫干燥,吉姆薩工作液染色20 min。自然風干,生物顯微鏡下觀察并拍照。
1.2.5 PMSCs表面標志物檢測 將PMSCs接種到六孔板中。在70%匯合時,PBS清洗細胞,40 g·L-1多聚甲醛固定30 min,0.25% Triton X-100通透10 min。山羊血清室溫下封閉30 min,分別加入CD29、CD44、CD73、CD90抗體稀釋液4 ℃孵育過夜。棄去一抗,PBS洗2次,加入FITC標記二抗,孵育1 h;PBS洗3次,DAPI孵育20 min,PBS清洗后,激光共聚焦顯微鏡下觀察并拍照。
1.2.6 多能性相關基因表達鑒定 使用Trizol法從細胞中提取RNA,PCR試劑盒(Takara)合成cDNA。用Primer Premier 5.0 軟件進行特異性引物設計(表1),擴增cDNA。PCR在含有2.0 μL 10× RT緩沖液、13.4 μL蒸餾水、0.2 μL Ex-Taq、1.0 μL正向和反向引物、1.0 μL模板cDNA和1.4 μL dNTP(2.5 mmol·L-1)的20 μL溶液中進行。反應條件嚴格按照說明書設置。PCR產物通過瓊脂糖凝膠電泳在140 V下持續30 min,觀察多能性相關基因表達情況。
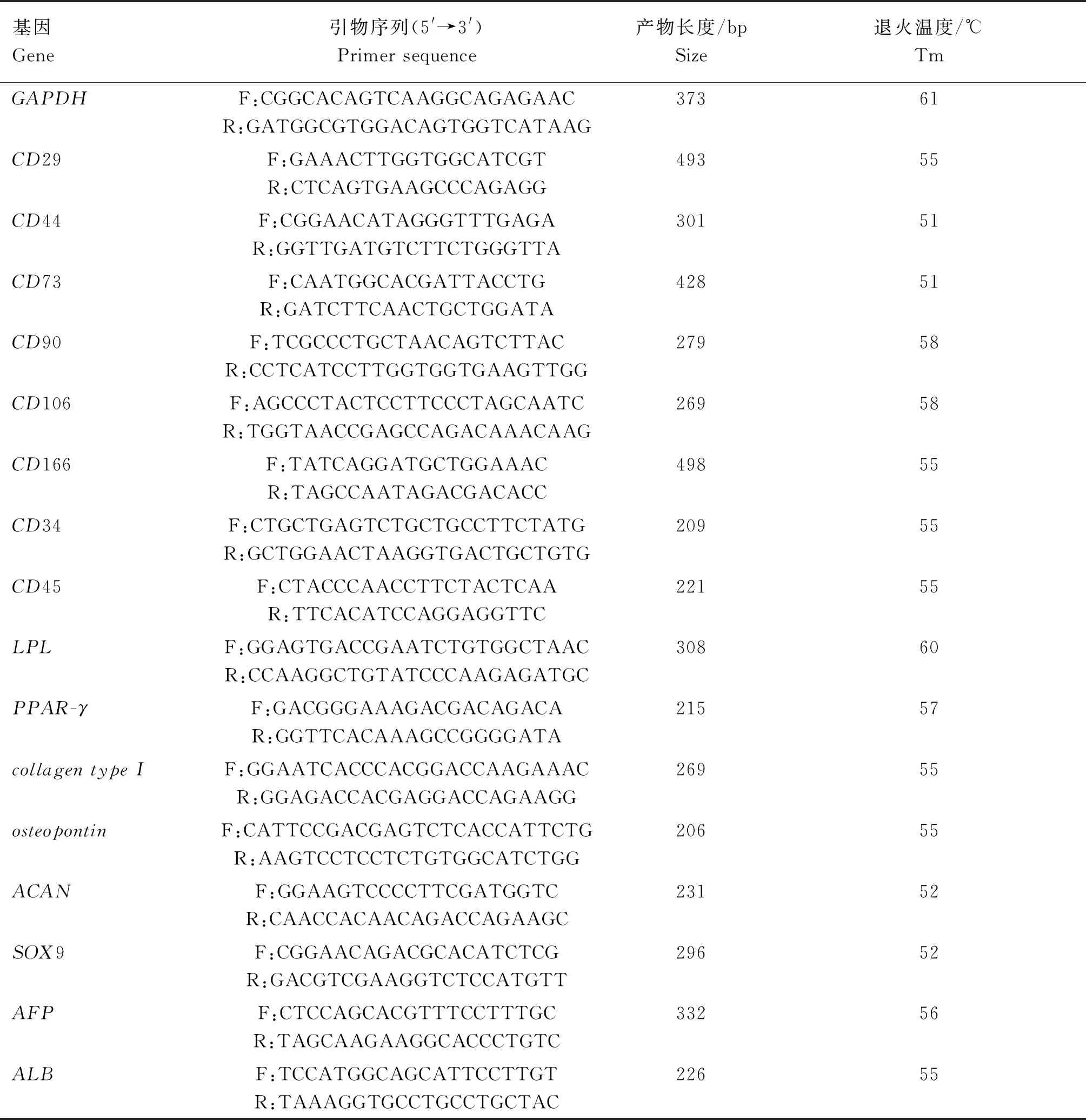
表1 引物信息表
1.2.7 誘導分化能力鑒定 成骨誘導液由DMEM/F12、10% FBS、0.1 mmol·L-1地塞米松、10 mmol·L-1β-甘油磷酸和50 mg· L-1維生素C組成;成脂誘導液由DMEM/F-12、10% FBS、10-7mol·L-1地塞米松、8 μg·mL-1胰島素、70 μmol·L-1吲哚美辛、0.5 mmol·L-1IBMX組成。成軟骨誘導液由L-DMEM、2.5% FBS、1% ITS、50 μg·mL-1脯氨酸、0.1 μmol·L-1地塞米松、0.5 mmol·L-1丙酮酸鈉、50 μg·mL-1維生素C、10 ng·mL-1TGF-β3、10 mg·L-1IGF-1組成;成肝樣誘導液由DMEM/F12、5% FBS、20 ng·mL-1FGF-4、20 ng·mL-1HGF、1% ITS組成。當細胞生長至60%匯合度時,PBS洗2次,加入誘導液,誘導液每2 d更換1次。連續培養,直到觀察到細胞有誘導標志性變化。分別用茜素紅、油紅O、阿利新蘭和糖原染色,并通過RT-PCR分析成骨特異性基因膠原蛋白-Ⅰ(collogen-Ⅰ)和骨橋蛋白(OPN)的表達;成脂特異性基因過氧化物酶體增殖物激活受體-γ(PPAR-γ)和脂蛋白脂肪酶(LPL)的表達;成軟骨特異性基因ACAN和SOX9的表達;成肝樣特異性基因白蛋白(ALB)和甲胎蛋白(AFP)的表達。
1.3 數據處理
數據處理使用SPSS25.0軟件進行單因素方差分析及鄧肯氏多重比較,用“平均值±標準差”表示,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結 果
2.1 PMSCs的分離培養
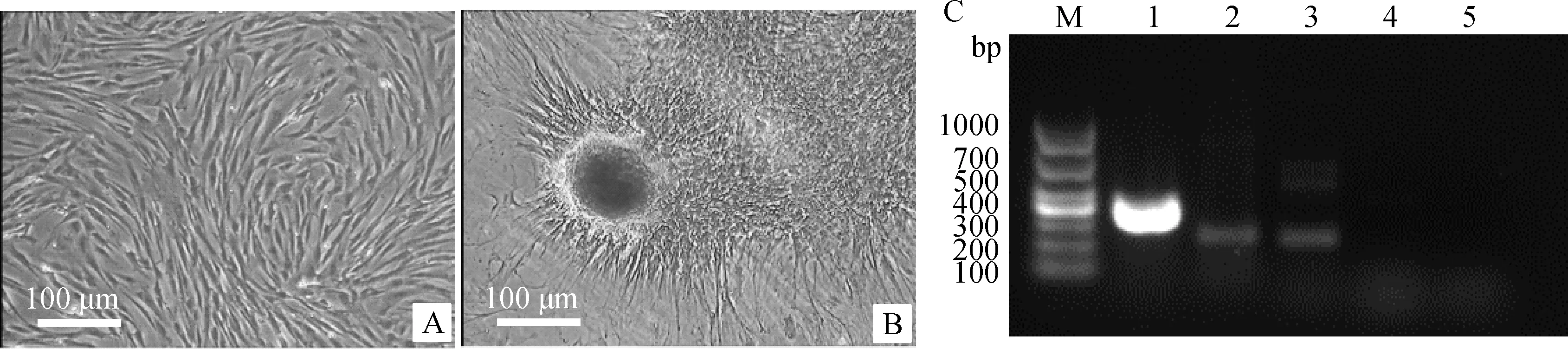
通過膠原酶消化法和組織塊貼壁法均可獲得PMSCs,兩種方法分離的細胞在傳至第3代時,細胞形態均一為長梭形,成漩渦樣生長,無明顯差異(圖1)。

A~D.膠原酶消化法原代、第3代、第9代、第15代(P0、P3、P9、P15)細胞形態;E~H.組織塊貼壁法原代、第3代、第9代、第15代(P0、P3、P9、P15)細胞形態
2.2 PMSCs體外增殖能力檢測
對第3代、第9代、第15代的PMSCs進行細胞計數,繪制細胞生長曲線。三代細胞增殖過程均經歷潛伏期、對數生長期、平臺期和衰退期,呈典型“S”型(圖2A)。計算得出第3代細胞的群體倍增時間為31.13 h,第9代細胞的群體倍增時間為33.75 h,第15代細胞的群體倍增時間為35.76 h。隨著傳代次數的增加群體倍增時間也逐漸增加,并且第9代細胞群體倍增時間顯著低于第15代而高于第3代(P<0.01,圖2B)。
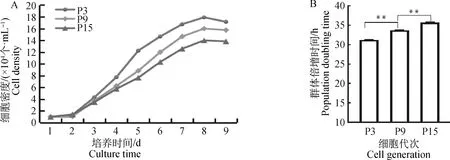
A.PMSCs第3代、第9代、第15代(P3、P9、P15)的生長曲線;B.PMSCs第3代、第9代、第15代(P3、P9、P15)的群體倍增時間。**.P<0.01
2.3 PMSCs克隆形成能力檢測
第3代、第9代、第15代的PMSCs均能夠在低密度條件下形成單克隆團(圖3A)。克隆形成率分別是(49±4.58)%、(34±6.08)%、(18.33±4.61)%,西門塔爾牛PMSCs隨著傳代次數的升高,細胞的克隆形成能力逐漸減弱。通過SPSS軟件計算表明第3代、第9代、第15代的PMSCs克隆形成率具有顯著差異(P<0.05,圖3B)。
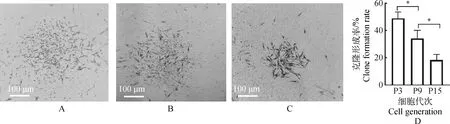
A~C.西門塔爾牛PMSCs 第3代、第9代、第15代(P3、P9、P15)的克隆團形態;D.柱狀圖顯示了不同代次細胞的克隆形成率。*.P<0.05
2.4 核型分析
取第9代PMSCs進行核型分析,染色體數目為2n=60,其中包括一對性染色體XY。染色體形態無畸變,表明此次體外培養的PMSCs保持了正常的染色體數目及形態(圖4)。
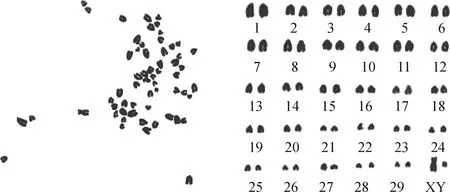
圖4 西門塔爾牛PMSCs染色體核型分析
2.5 免疫熒光表型分析
第7代PMSCs細胞做免疫熒光檢測結果顯示,間充質干細胞表面標志物CD29、CD44、CD73和CD90均呈陽性表達,CD45、CD34呈陰性表達(圖5)。
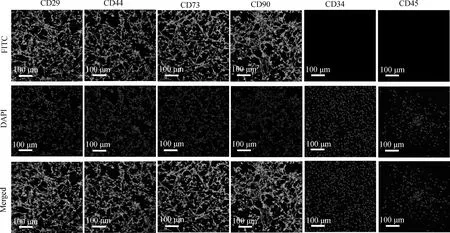
圖5 免疫熒光檢測西門塔爾牛PMSCs表面標志物
2.6 多能性相關基因表達鑒定
Primer Premier 5.0 軟件設計CD29、CD44、CD73、CD90、CD106、CD166和CD34、CD45標記基因擴增引物,以GAPDH為內參基因,結果顯示間充質干細胞特異性標記基因CD29、CD44、CD73、CD90、CD106、CD166呈陽性表達;造血干細胞特異性標記基因CD34、CD45呈陰性表達(圖6)。
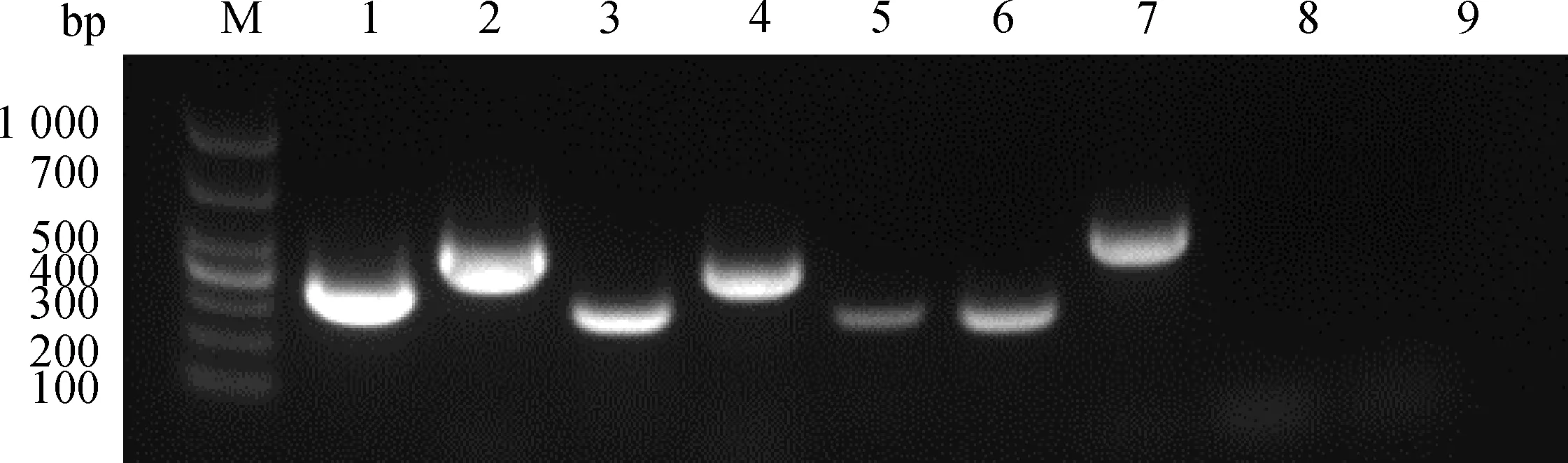
M. DL1000 DNA相對分子質量標準;1. GAPDH;2. CD29;3. CD44;4. CD73;5. CD90;6. CD106;7. CD166;8. CD34;9. CD45
2.7 PMSCs多向分化能力鑒定
2.7.1 成脂誘導分化能力鑒定 成脂誘導6 d后進行油紅O染色,誘導后細胞胞漿可見大量橘紅色油滴,并進行RT-PCR檢測,結果表明成脂誘導后的PMSCs表達脂肪細胞相關基因脂蛋白脂肪酶(LPL)和過氧化物酶體增殖激活受體γ(PPAR-γ),而對照組LPL和PPAR-γ呈陰性表達(圖7)。
A.對照組油紅O染色;B.誘導組油紅O染色;C:M. DL1000 DNA相對分子質量標準;1. GAPDH; 2.誘導組LPL;3.誘導組PPAR-γ;4.對照組LPL;5.對照組PPAR-γ
2.7.2 成骨誘導分化能力的鑒定 成骨誘導15 d后進行茜素紅染色,誘導后可見沉積的鈣鹽被染成紅色,RT-PCR結果顯示成骨誘導后的PMSCs表達Ⅰ型膠原蛋白(CollagetypeⅠ)和骨橋蛋白(osteopontin)基因,而對照組未檢測到CollagetypeⅠ和osteopontin表達(圖8)。

A.對照組茜素紅染色;B.誘導組茜素紅染色;C: M. DL1000 DNA相對分子質量標準;1. GAPDH;2.誘導組collagen type I;3.誘導組osteopontin;4.對照組collagen type I;對照組osteopontin
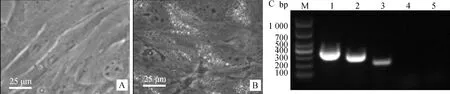
2.7.3 成軟骨誘導分化能力的鑒定 成軟骨誘導15 d后進行阿利新蘭染色,誘導組可見含酸性黏多糖的軟骨結節被染成藍色,RT-PCR結果顯示成軟骨誘導后的PMSCs表達ACAN和SOX9基因,而對照組未檢測到ACAN和SOX9基因表達(圖9)。
A.對照組阿利新蘭染色;B.誘導組阿利新藍染色;C: M. DL1000 DNA 相對分子質量標準;1. GAPDH;2.誘導組ACAN;3.誘導組SOX9;4.對照組ACAN;5.對照組SOX9
2.7.4 成肝樣誘導分化能力的鑒定 成肝樣誘導15 d后進行糖原染色,誘導組可見胞質內儲存的糖原被染為紫紅色,RT-PCR結果顯示成肝樣誘導后的PMSCs表達白蛋白(ALB)和甲胎蛋白(AFP)基因,而對照組ALB和AFP基因呈陰性表達(圖10)。

A.對照組糖原染色;B.誘導組糖原染色;C:M.DL1000 DNA 相對分子質量標準;1.GAPDH;2.誘導組AFP;3.誘導組ALB;4.對照組AFP;5.對照組ALB
3 討 論
間充質干細胞具有免疫調節作用,有助于從組織損傷中恢復和抑制炎癥。許多研究調查了基于MSCs對糖尿病治療的可行性、安全性和有效性[14-16]。然而,臨床使用的最佳來源還沒有被證實。因此,相同組織來源或胚胎發育過程中同源區域組織類型來源的干細胞可能提供新的治療策略[17]。PMSCs除了對糖尿病具有治療潛力,Thirlwell等[18]通過對PMSCs和骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)分化潛能和免疫調節能力的比較表明PMSCs在治療移植物抗宿主病方面也具有優勢。
通過酶消法和貼壁法均可從西門塔爾牛胚胎中獲得生長狀態良好的PMSCs,細胞形態為長梭形且傳代時間一致。隨著傳代次數的增加群體倍增時間逐漸增加,克隆形成率逐漸降低。說明隨著細胞傳代次數的增加細胞逐漸衰老。二倍體核型和穩定的染色體數目、形狀和結構是細胞生長和功能的先決條件。核型分析是區分正常細胞和變異細胞的一種簡單實用的方法[19-20]。西門塔爾牛有30對染色體,包括性染色體X和Y[21-22]。本研究培養的西門塔爾牛PMSCs均為正常二倍體(2n=60,XY)。這些發現可能對理解染色體融合的分子機制、基因進化具有重要意義。
西門塔爾牛PMSCs的識別通常基于MSCs特異性標記 CD29、CD44、CD73、CD90[23]。CD44是一種細胞表面糖蛋白,參與細胞間相互作用、遷移和粘附,參與淋巴細胞激活、再循環和歸巢等多種細胞功能[24]。CD73主要分布在細胞表面,并通過糖基磷脂酰肌醇(GPI)與細胞膜結合[25]。血管細胞黏附分子-1(CD106 或VCAM-1)是一種細胞因子誘導的細胞表面蛋白,能夠介導粘附[26]。目前,間充質干細胞鑒定除了根據細胞形態學、生長特征、多種免疫表型外,另外一項重要的特征是其在體外具有多向分化潛能。細胞在體外必須能夠分化成骨細胞、脂肪細胞、軟骨細胞等[27]。研究表明,魯西黃牛PMSCs在體外可分化為中胚層脂肪細胞和骨細胞[27]。本試驗將生長狀態良好的PMSCs在不同誘導條件下分化為中胚層骨細胞、脂肪細胞、軟骨細胞,并跨胚層誘導分化成肝樣細胞,進一步驗證了西門塔爾牛PMSCs具有良好的體外分化潛能。骨細胞相關標記基因的表達包括CollagetypeⅠ和OPN,OPN是成骨分化和成熟的早期標記[28-29],脂肪細胞相關標記基因的表達包括LPL和PPAR-γ,PPAR-γ屬于配體激活轉錄因子的核激素受體超家族,已知可作為脂肪細胞分化的主要轉錄調節因子,并抑制成骨細胞分化[30]。軟骨細胞標記基因包括ACAN和SOX9。由ACAN基因編碼的蛋白聚糖是細胞外軟骨基質中的主要蛋白多糖成分[31]。SOX9是一種主轉錄因子,通過階段特異性調控一系列下游因子參與軟骨形成的序列事件[32]。本研究發現,在進行成骨和成軟骨誘導時細胞匯合度應選取50%左右,但在成脂誘導時細胞匯合度應選取80%左右為宜。這主要是因為在成脂誘導過程中細胞不再增殖,啟動了凋亡程序[33]。西門塔爾牛PMSCs分化為肝樣細胞15 d后可表達ALB和AFP,并在胞質儲存糖原。由于ALB和AFP是肝細胞存在和代謝活性的特異性標志基因,只有肝細胞才能產生和儲存糖原,提示此時PMSCs在體外已經成功向肝樣細胞分化[34]。但是由于缺少體內微環境的調節,在體外誘導成的肝樣細胞會受到誘導條件影響而產生不同成熟度的肝樣細胞,因此本試驗中誘導分化獲得的肝樣細胞尚需更詳盡的方案來評價其多方面的肝細胞功能。
4 結 論
本研究成功從3月齡西門塔爾牛胚胎胰腺組織中分離到PMSCs,細胞形態均一,呈長梭形,并保持了較高的自我更新能力;西門塔爾牛PMSCs表達MSCs相關的表面標記基因CD29、CD44、CD73、CD90、CD106、CD166,不表達CD34、CD45;西門塔爾牛PMSCs在體外可向成脂、成骨、成軟骨、成肝樣細胞分化,具有較高的分化潛能。有望在細胞治療方面發揮潛力,為組織工程學提供新的種子細胞。

