終末期腎臟病患者肝纖維化的發生及影響因素分析
謝書樂,張 瑾,張 培,吳永貴
終末期腎臟病(end-stage renal disease,ESRD)作為各種慢性腎臟疾病不可逆轉的終末階段,可造成全身多臟器系統的損傷,其中,肝纖維化是常見的臟器損傷之一。肝纖維化是多種慢性肝損傷引起的異常修復反應,主要的病理機制為來自于肝星狀細胞的彌漫性細胞外基質的過度沉積,其激活并轉化為肌成纖維細胞的機制是肝纖維化發生發展的中心環節[1]。ESRD患者相較于普通人群,有更高的發生慢性肝病的風險[2]。對于慢性腎臟病患者,早期診斷肝纖維化并及時干預治療,是降低肝硬化發生率、減少死亡風險的有效手段。該研究將通過采用瞬時彈性成像技術來評估ESRD患者肝纖維化程度,了解ESRD患者中肝纖維化的發生情況,并結合臨床資料探討ESRD患者肝纖維化發生的影響因素,為在臨床工作中早期發現并診斷肝纖維化提供思路。
1 材料與方法
1.1 病例資料選取2021年1—10月于安徽醫科大學第一附屬醫院住院的83例ESRD患者作為研究對象。根據有無肝纖維化的發生分為肝纖維化組(n=46)與非肝纖維化組(n=37)。收集研究對象的年齡、性別、體質指數(body mass index,BMI)、既往史等病歷資料。
1.2 納入與排除標準納入標準:① 符合美國腎臟病基金會K/DOQ I分級CKD5期診斷標準,腎小球濾過率(estimated glomerular filtration rate, eGFR)<15 ml/(min·1.73 m2),持續至少>3個月,eGFR采用腎臟病飲食改良公式(MDRD)計算:eGFR=186×血清肌酐-1.154×年齡-0.203×0.742(女性),結果采用ml/(min·1.73 m2)表示;② 年齡18~65歲;③ 3周內均未曾服用激素、細胞毒類、他汀類藥物;④ 腹膜透析患者需滿足規律透析時間>6個月,未變更透析方式。排除標準:① 伴隨感染、創傷或其他急性應激狀態;② 伴隨系統性紅斑狼瘡、類風濕性關節等免疫系統疾病;③ 伴隨肝炎病毒感染(乙型病毒性肝炎、丙型病毒性肝炎等)的血清學證據;④ 存在藥物性或酒精性肝炎。本研究由安徽醫科大學第一附屬醫院倫理委員會批準(審批號:PJ2018-13-10),所有研究對象均簽署知情同意書。
1.3 實驗室指標檢測方法所有患者的血樣均在入院后24 h內清晨空腹靜息狀態下采集。血清補體測定采用免疫比濁法,采用貝克曼庫爾特公司的補體測定試劑盒,在Beckman Coulter AU5800分析儀上完成。血常規結果使用日本Sysmex公司的XE-5000血細胞分析儀進行處理,肝腎功能、血脂、電解質等生化指標采用全自動生化分析儀檢測。
1.4 肝纖維化的檢查與診斷
1.4.1肝纖維化的檢查 肝臟纖維化程度采用瞬時彈性掃描儀FibroTouch檢測。FibroTouch機器為無錫海斯凱爾醫學技術有限公司制造。測量前囑患者禁食2 h以上,如為腹膜透析患者,需要求患者放空腹透液,空腹進行檢測。測量時患者充分暴露肝右葉區的肋間隙,于肋間隙選定測量位置, 要求避開肝臟邊緣及大血管結構,進行連續檢測并獲得測量值,要求操作成功率≥60%且四分位數間距/中位數≤0.3,以10次成功測定值的中位數即為最終測定值,以肝臟硬度值(liver stiffness measurement,LSM)表示。本研究所有肝纖維化檢查均由同一位醫師完成,以減少檢測偏倚。
1.4.2肝纖維化的診斷 根據瞬時彈性成像技術在肝纖維化無創診斷中的應用[3]:肝臟硬度值≥7.3 kPa即認為存在肝纖維化。肝臟硬度值與組織病理學分期的對照參考標準:LSM≤7.3 kPa為F0期,7.3

2 結果
2.1 ESRD患者肝纖維化發生情況本研究共納入83例ESRD患者,其中男性41例(49.40%),女性42例(50.60%),年齡18~63(47.29 ± 10.01)歲;行腹膜透析治療患者42例,未行腹膜透析患者41例。83例患者中有46例(55.42%)合并有肝纖維化,37例(44.58%)未合并有肝纖維化。F0期37例(44.58%),≥F1期24例(28.91%),≥F2期13例(15.66%),≥F3期9例(10.84%),F4期0例。
2.2 ESRD患者肝纖維化組與非肝纖維化組臨床資料比較兩組之間進行比較,肝纖維化組患者白細胞相對較低(t=3.423,P=0.001),補體C3、補體C4水平較低(t=3.283,P=0.002;t=3.396,P=0.001),紅細胞沉降率水平較低(Z=2.396,P=0.017)。兩組患者在丙氨酸氨轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)等指標上差異無統計學意義。見表1。

表1 ESRD患者肝纖維化組與非肝纖維化組臨床資料比較[M(P25,P75)]
2.3 ESRD患者不同肝纖維化分期臨床資料比較在不同肝纖維化分期中,白細胞、乳酸脫氫酶(lactate dehydrogenase,LDH)、補體C3、補體C4、紅細胞沉降率差異有統計學意義,其余指標差異無統計學意義。見表2。
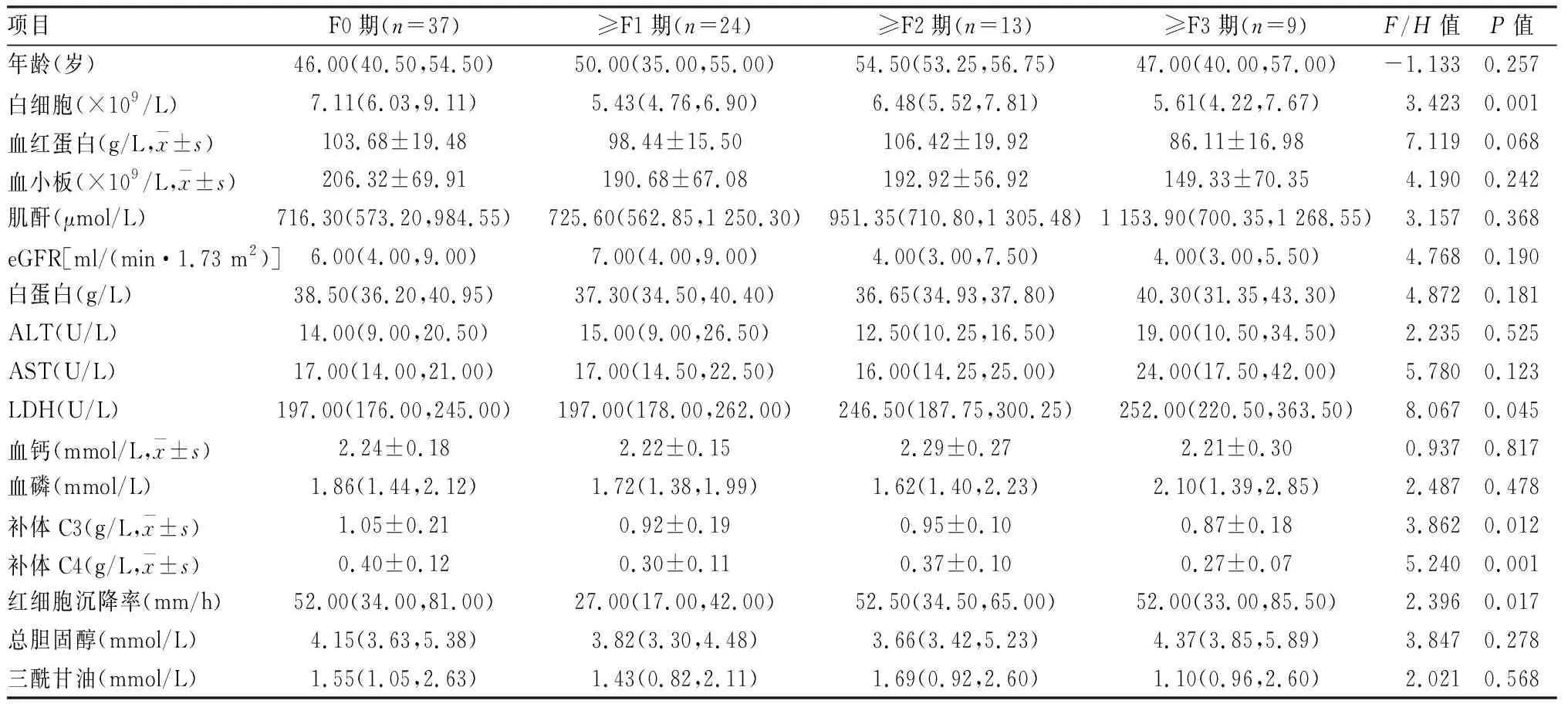
表2 ESRD患者不同肝纖維化分期臨床資料比較[M(P25,P75)]
2.4 ESRD患者發生肝纖維化的單因素Logistics分析單因素Logistics回歸分析后顯示,白細胞、LDH、補體C3、補體C4、紅細胞沉降率與肝纖維化的發生相關(P<0.05),與其他指標無相關性(P>0.05),見表3。
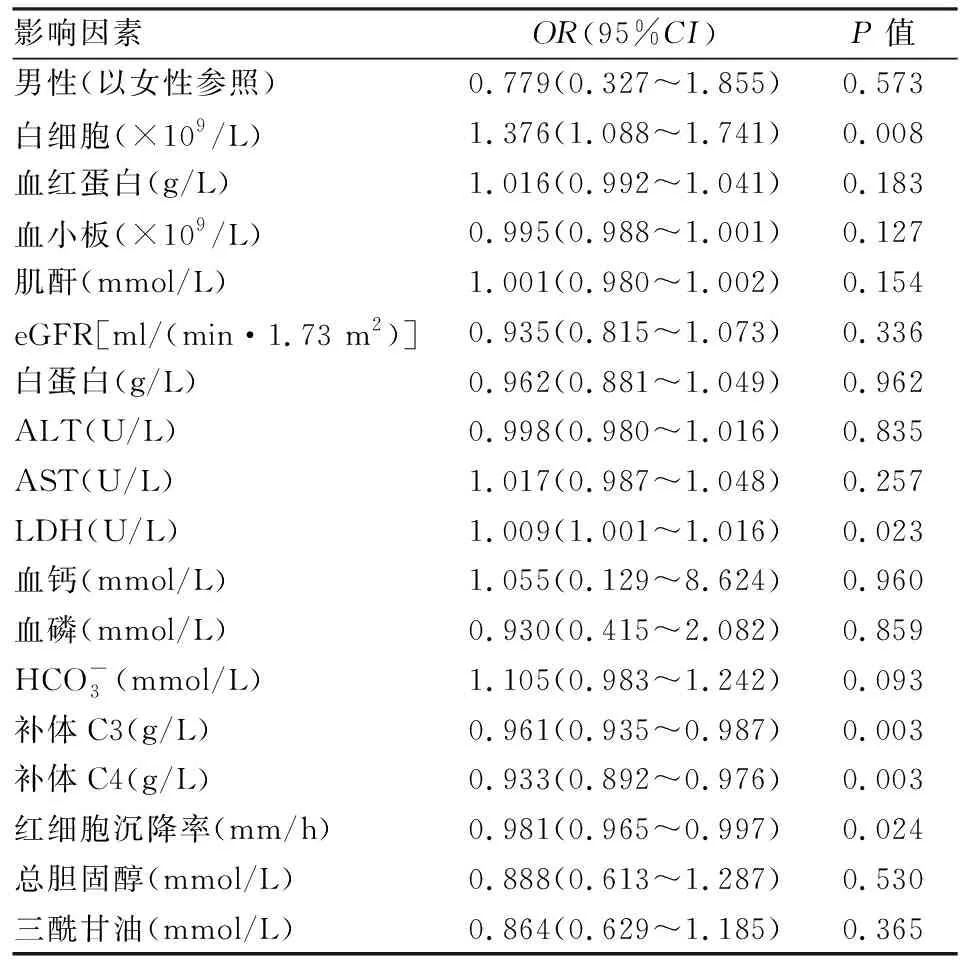
表3 ESRD患者發生肝纖維化的單因素Logistics分析
2.5 ESRD患者發生肝纖維化的多因素Logistics逐步分析以有無肝纖維化發生為因變量,將單因素回歸分析有差異的因素納入模型,多因素二元Logistics分析結果顯示,補體C4、LDH是ESRD患者肝纖維化發生的相關因素(OR=0.930,95%CI:0.872~0.992,P=0.028;OR=1.016,95%CI:1.005~1.027,P=0.004)。見表4。
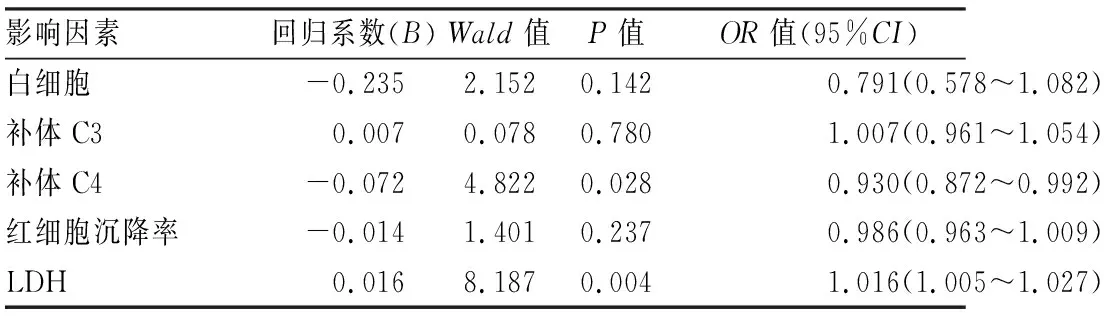
表4 ESRD患者發生肝纖維化的多因素逐步Logistics分析
3 討論
研究[4]認為,肝纖維化是進展為肝硬化、甚至肝癌的第一步表現,早期發現并治療是預防肝纖維化的有效手段。而與一般人群相對比,ESRD患者具有更高的肝纖維化發生率[5];在本研究中,ESRD患者肝纖維化的患病率為55.42%,以早期肝纖維化為主,且補體C4、LDH是肝纖維化發生的相關影響因素。
研究[6]表明,腹膜透析治療帶來的高葡萄糖負荷量及機械損傷是肝纖維化發生的重要危險因素。但在本研究中,盡管腹膜透析患者的肝纖維化發生率高于ESRD非腹膜透析患者的(61.90%vs48.78%),但組間比較差異無統計學意義(χ2=1.446,P=0.229),尚不能肯定腹膜透析患者發生肝纖維化的風險更高。由于本研究只納入了83例ESRD患者,可能與樣本量不足相關,故有待于大樣本試驗的進一步研究。
多項研究表明,ESRD患者血清補體水平往往表現為補體C3的降低和補體C4的升高[7],而肝纖維化的發生則伴隨C3、C4水平的降低[8]。本研究顯示,在未發生肝纖維化時,ESRD患者C4水平偏高,這可能與原發腎臟病造成的全身慢性炎癥導致C4合成增加有關[9]。多因素回歸分析表明C4是ESRD患者肝纖維化發生的獨立危險因素,并且ESRD患者在發生不同程度的肝纖維化時,其血清C4水平同樣存在差異。C4水平在≥F1期出現一定的下降之后,在≥F2期表現為一過性的升高,隨著肝纖維化程度逐漸加重,在≥F3期,C4水平出現顯著的降低,呈現出非線性改變,但整體仍表現為下降趨勢,這與郭飛波[10]的研究結果一致。補體C4水平的降低反映出補體系統的過度激活,導致最終膜攻擊復合物及全身炎癥因子的生成增加,同時,C4在激活的過程中,增加了纖維連接蛋白、絲氨酸蛋白酶等因子的產生[11],與其裂解產物C4a共同沉積在肝臟中,直接造成了肝細胞的損傷,進一步促進了肝纖維化的發生。而此時肝臟尚處于早期肝纖維化狀態,仍具有強大的儲備及代償能力,使補體C4在一定的消耗后產生代償性的增加,但隨著肝纖維化程度的加重,肝臟開始逐漸失去代償能力,最終表現為補體C4水平的顯著下降。
LDH作為臨床反映肝功能的指標之一,本研究提示肝纖維化組具有更高的LDH水平,并且LDH升高是肝纖維化發生的獨立危險因素。F0期與≥F1期LDH水平未見明顯差異,在≥F2期、≥F3期出現顯著升高,提示高水平的LDH可能與更嚴重的肝纖維化程度相關。這可能與LDH升高導致厭氧糖酵解途徑中的乳酸產生增加,帶來的細胞外低pH值環境使肝細胞損傷相關[12],同時,LDH與乏氧誘導因子的表達顯著相關[13],異常激活的乏氧誘導因子不但可以通過介導Kupffer細胞和巨噬細胞產生高水平的分泌生長因子,還可以直接驅動促炎細胞因子的生成,這些都將促使肝星狀細胞轉化為肌成纖維細胞,誘導肝纖維化的發生[14]。
綜上所述,ESRD患者肝纖維化發生率較高,以輕度肝纖維化為主,并且血清補體C4、LDH是肝纖維化發生的影響因素。對于ESRD患者合并有低水平補體C4、高水平LDH時,具有更高的發生肝纖維化的風險。因此,建議對于ESRD患者進行肝纖維化的常規篩查,以便盡早診斷并干預治療,減少肝纖維化疾病進展的風險。同時,該研究為小樣本、橫斷面研究,沒有對入組患者肝纖維化程度及補體C4、LDH水平進行長期動態隨訪,仍有待大樣本、縱向性研究進一步證實。

