ABCA1通過激活EGFR/STAT3信號通路對胃癌上皮間質轉化的影響
金 泳,杜 洪,夏 英,項婷婷,韋四喜,孫 銘,黃 海
胃癌(gastric cancer, GC)是世界范圍內高發病率、高病死率的腫瘤之一[1],在我國,國家癌癥中心發布2020年預計胃癌發病率達24.30/10萬[2]。胃癌早期起病較為隱匿,因此大部分患者就診時病程已經進入中晚期,腫瘤細胞已擴散轉移[3],而胃癌發生發展的病理分子機制尚未闡明也為腫瘤的診療帶來困難,因此,探究胃癌致病及遠處轉移機理將有助于改善胃癌的診斷和治療。ATP結合盒亞家族A成員1(ATP binding cassette subfamily A member 1,ABCA1)是三磷酸結合盒轉運體超家族的重要成員之一,研究[4]表明ABCA1主要參與膽固醇逆向轉運及膽固醇代謝,但近年來有研究報道ABCA1在腫瘤的進展中扮演重要角色,參與腫瘤細胞增殖、轉移及腫瘤血管生成等生物學現象[5],與腫瘤患者預后不良相關[6]。然而,ABCA1在胃癌中的作用及其相關分子機制卻鮮有報道。該研究探討ABCA1在胃癌發生發展過程中可能的分子機制,以期尋找胃癌治療靶點或分子生物學標記,為胃癌的診斷和治療提供理論基礎。
1 材料與方法
1.1 材料
1.1.1胃癌組織及細胞來源 GC細胞系AGS、MKN45、HGC-27及胃黏膜細胞系GES-1購自中國科學院細胞庫;293T細胞系由蘭州大學金衛林教授實驗室惠贈。收取2020—2022年貴州醫科大學附屬醫院胃腸外科25例手術前未經過化療、放療和免疫治療的胃腺癌患者胃癌組織,同時取相鄰癌組織間隔5 cm以上癌旁組織作為對照; 組織標本均有唯一識別標記,留存于液氮中;本研究所用組織樣本均通過貴州醫科大學附屬醫院醫學倫理委員會審查(審批號:2020倫審第106號)。
1.1.2shRNA和引物 shABCA1-1序列: 5′-GCGACTCCACATAGAAGAC-3′; shABCA1-2序列:5′-GACGTATGTGCAGATCATA-3′,ABCA1的 shRNA質粒購于廣州艾基生物技術有限公司。ABCA1 PCR引物序列:上游5′-ACATCCTGAAGCCAATCCTGA-3′,下游5′-CTCCTGTCGCATGTCACTCC-3′;β-actin PCR引物序列:上游5′-ATTGGCAATGAGCGGTTCCG-3′,下游5′-CTGTGTTGGCGTACAGGTCT-3′,以上引物序列均由本課題組設計,由上海生工生物工程股份有限公司合成。
1.1.3主要試劑和儀器 RPMI-1640培養基及TRIzol Reagent購于美國Invitrogen公司;總RNA抽提試劑盒購于上海生工生物工程股份有限公司;逆轉錄試劑盒及SYBR Premix Ex TaqⅡ 購于日本Takara公司;Matrigel購于美國Corning公司;ABCA1鼠源性單克隆抗體購于美國Abcam公司;表皮生長因子受體(epidermal growth factor receptor,EGFR)及p-EGFR、信號傳導及轉錄激活蛋白3(signal transducer and activator of transcription 3,STAT3)及p-STAT3兔源性多克隆抗體購于杭州華安生物技術有限公司;β-actin鼠源性單克隆抗體購于武漢三鷹生物技術有限公司;辣根過氧化物酶標記的羊抗兔IgG二抗購于杭州聯科生物技術股份有限公司;RIPA裂解液及BCA蛋白濃度測定試劑盒購于北京索萊寶科技有限公司;Immobilon ECL Ultra Western HRP底物化學發光液購于美國Millipore公司;Bio-Rad凝膠成像分析系統(ChemiDoc XRS+)由美國Bio-Rad公司生產;實時熒光定量PCR儀(Roche LightCycler480)由瑞士Roche公司生產。
1.2 方法
1.2.1生物信息學分析
1.2.1.1TIMER數據庫 通過腫瘤免疫評價數據庫(tumor immune estimation resource,TIMER,https://cistrome.shinyapps.io/timer/)分析ABCA1在不同腫瘤中的表達。該數據庫Diff Exp模塊可分析腫瘤中某個基因在腫瘤和相鄰正常組織之間的差異表達,使用Wilcoxon檢驗評估差異表達的統計顯著性。分析流程如下:①Version: TIMER2.0;②diff Exp模塊;③ Gene Symbol: ABCA1。
1.2.1.2UALCAN數據庫 亞拉巴馬大學癌癥數據庫(University of Alabama Cancer Database,UALCAN,http://ualcan.path.uab.edu)可以用來分析基于TCGA數據庫中靶基因在腫瘤與正常組織中的表達及其與相關臨床參數的關系。篩選條件如下:①Gene symbol: ABCA1;②TCGA dataset: Stomach adenocarcinoma。
1.2.1.3Kaplan-Meier Plotter數據庫 Kaplan-Meier Plotter數據庫(https://kmplot.com)可根據目的基因的各種分位數表達將患者樣本分為兩組,比較兩組患者隊列并計算95%CI的風險比和P值,分析患者生存期。篩選條件如下:①Cancer: gastric cancer;②Gene symbol: ABCA1;③ Survival: OS;④Split patients by: auto select best cutoff;根據表達水平中位數分為高、低表達組,繪制 Kaplan-Meier 生存曲線。
1.2.2細胞培養 胃癌細胞復蘇后,培養于含有10%胎牛血清(FBS)和100 U/ml青鏈霉素的RPMI-1640培養液中,將細胞置于37 ℃、5%CO2的恒溫恒濕培養箱中培養,待細胞融合85%左右時,按1 ∶3 消化傳代。
1.2.3shRNA與慢病毒感染 ABCA1的短發夾RNA(short hairpin RNA, shRNA)質粒購于廣州艾基生物技術有限公司。將HEK293T細胞與pLKO.1 shRNA、psPAX2和pMD2.G質粒共轉染,轉染后48 h,將含有病毒的上清液與聚凝胺(8 μg/ml) 混合,加入靶細胞中孵育培養24 h。然后使用嘌呤霉素(2 μg/ml)篩選轉導細胞。
1.2.4RNA提取及實時熒光定量PCR 采用上海生工生物總RNA抽提試劑盒提取細胞總RNA,按照Takara逆轉錄試劑盒說明將總RNA逆轉錄為cDNA。以cDNA為模板,按SYBR Premix Ex TaqⅡ試劑說明進行PCR擴增。以β-actin為內參,采用2-ΔΔCt法計算基因相對表達量。
1.2.5細胞劃痕實驗 以5×105個/ml細胞接種于6孔板中,常規培養至90%匯合后,使用無血清培養基饑餓培養24 h,用10 μl無菌移液器吸頭在細胞培養板底部劃痕,用PBS清洗去懸浮細胞,將培養基更換為含有0.1% FBS的RPMI-1640繼續培養,采集第0、24、48 h劃痕圖片,使用Image J軟件分析劃痕面積并計算劃痕愈合率。
1.2.6Transwell實驗
1.2.6.1Transwell細胞遷移實驗 收集細胞,用無血清培養基培養液重懸,計數,調整細胞濃度為2×105個/ml,取200 μl細胞接種到8 μm孔徑的Transwell小室中,下室中加入600 μl的10%FBS培養基,培養24 h后取出小室。用棉簽去除上室細胞,將遷移到下孔的細胞用甲醇固定,0.1%結晶紫染色,PBS漂洗,在200倍顯微鏡下觀察。采集并計算3個隨機選擇的區域中的細胞數。
1.2.6.2Transwell細胞侵襲實驗 將基質膠用無血清培養液按1 ∶8稀釋,加入Transwell小室上室并放入培養箱中凝固過夜。收集細胞,用無血清培養基培養液重懸,計數,調整細胞濃度為2×105個/ml,每個小室內加入細胞懸液200 μl,下室中加含20% FBS培養基600 μl。培養48 h后取出小室,用棉簽去除上室細胞,將侵襲到下室的細胞用甲醇固定,0.1%結晶紫染色,PBS漂洗,在200倍顯微鏡下觀察,計算3個隨機選擇的區域中的細胞數。
1.2.7Western blot實驗 采用RIPA裂解液裂解細胞,提取細胞總蛋白,經BCA法測定蛋白濃度。加入5×SDS蛋白上樣緩沖液充分煮沸變性。取變性蛋白30 μg經10% SDS-PAGE電泳,利用濕轉法將蛋白電泳產物轉印至PVDF膜上。5% BSA室溫封閉1 h,4 ℃孵育一抗過夜。次日,TBST洗膜3次,每次10 min,加入辣根過氧化物酶標記二抗,室溫孵育1 h。TBST洗膜3次,每次10 min。最后,通過Immobilon ECL Ultra Western HRP底物化學發光液發光、顯影,Bio-Rad凝膠成像分析系統拍照,Image J軟件分析各蛋白電泳條帶灰度值。

2 結果
2.1 生物信息學分析ABCA1在胃癌中的表達及其對胃癌患者生存預后的影響通過TIMER數據庫分析ABCA1在不同腫瘤類型中的表達情況,結果顯示ABCA1在胃癌中過表達(P<0.001,圖1A);基于UALCAN數據庫分析ABCA1在胃癌組織和正常組織中的表達及其在胃癌不同分期分級中的表達情況,結果顯示,ABCA1在胃癌組織中表達上調(P<0.001,圖1B),且其表達與胃癌分期、分級相關(圖1C、D,P<0.001);為進一步探究ABCA1表達與胃癌患者預后關系,利用Kaplan-Meier plotter數據庫進行分析顯示,ABCA1高表達胃癌患者總生存率(overall survival,OS)低與非高表達者(圖1E,風險比HR=1.96,95%CI:1.62~2.37,P<0.000 1)。這些結果提示,ABCA1在胃癌發生發展中可能發揮著重要作用。
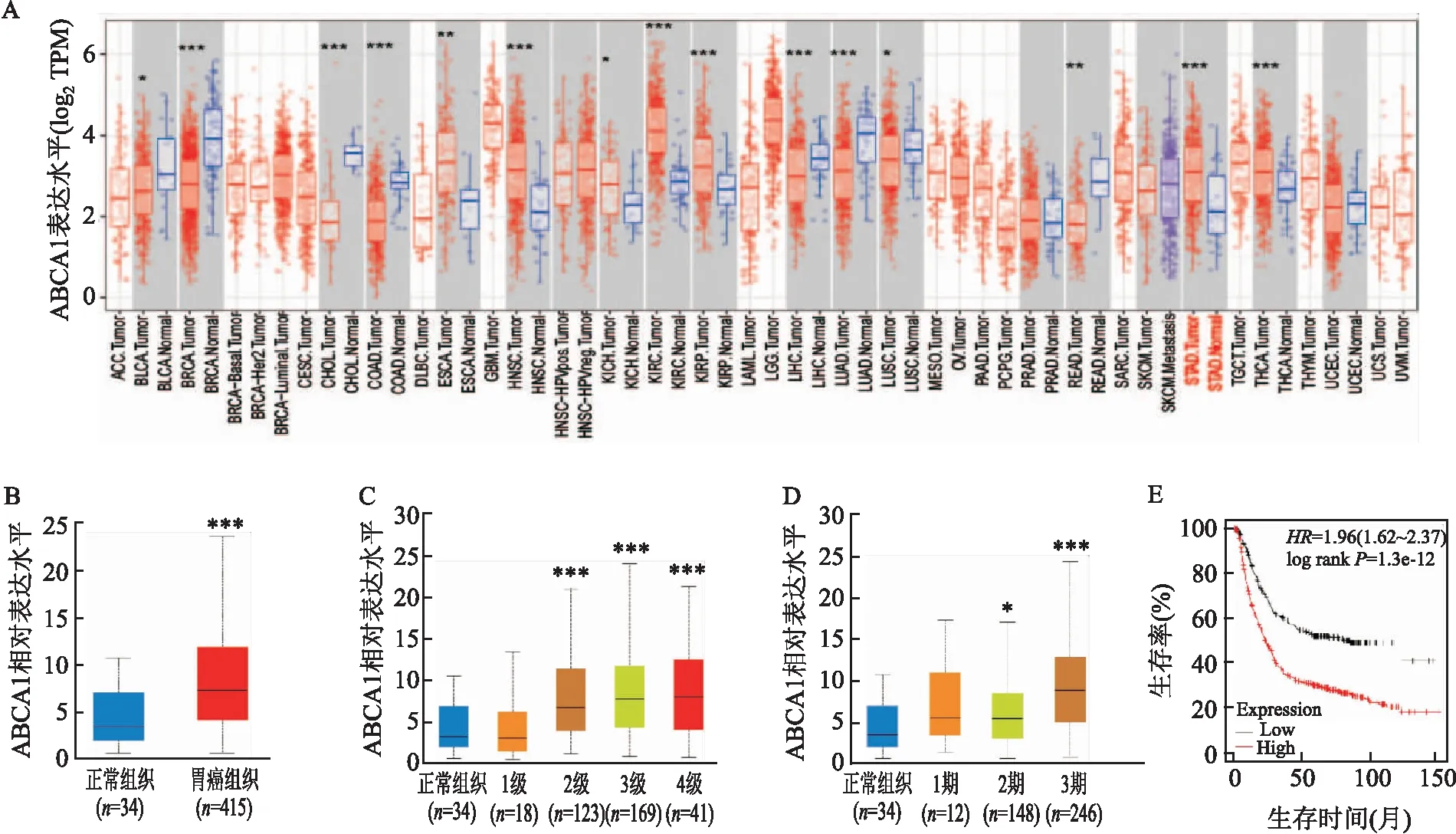
圖1 生物信息學分析胃癌中ABCA1的表達A:ABCA1在不同腫瘤中的表達;B:ABCA1在胃癌中的表達;C:ABCA1在正常胃組織及不同胃癌分級中的表達;D:ABCA1在正常胃組織及不同胃癌分期中的表達;E:ABCA1的表達水平與胃癌患者生存率的相關性;與正常組織比較:*P<0.05,**P<0.01,***P<0.001
2.2 ABCA1在胃癌組織和細胞系中的表達情況采用RT-qPCR檢測25對臨床胃癌組織樣本中ABCA1的表達情況。如圖2A所示,相比于癌旁組織,ABCA1在胃癌組織中表達上調,差異有統計學意義(t=3.936,P=0.000 6)。此外,RT-qPCR法檢測不同胃癌細胞系中ABCA1的表達,如圖2B所示,與胃黏膜細胞GES-1相比,ABCA1在胃癌細胞系HGC-27中高表達(F=101.6,P<0.001)。Western blot結果與RT-qPCR趨勢一致(圖2C)。
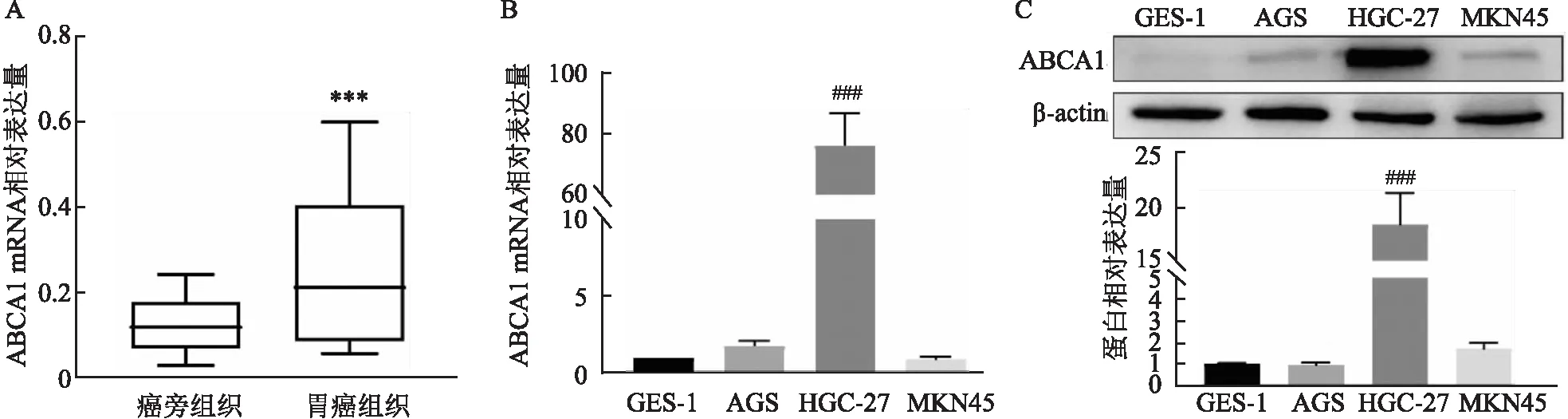
圖2 ABCA1在胃癌組織和胃癌細胞系中的表達A:RT-qPCR檢測25例胃癌及其對應的癌旁組織中ABCA1的表達;B、C:RT-qPCR及Western blot檢測不同胃癌細胞系中ABCA1的表達水平;與癌旁組織比較:***P<0.001;與胃黏膜細胞系GES-1比較:###P<0.001
2.3 ABCA1對胃癌細胞侵襲、遷移及EMT的影響
2.3.1ABCA1穩定敲低胃癌細胞系的構建 選擇ABCA1高表達的胃癌HGC-27細胞系,利用慢病毒介導的shRNA干擾技術敲低ABCA1,通過RT-qPCR及Western blot驗證ABCA1敲低效率(圖3),與sh-NC組相比,shABCA1組ABCA1的表達量顯著減少,表明敲減成功(P<0.001)。
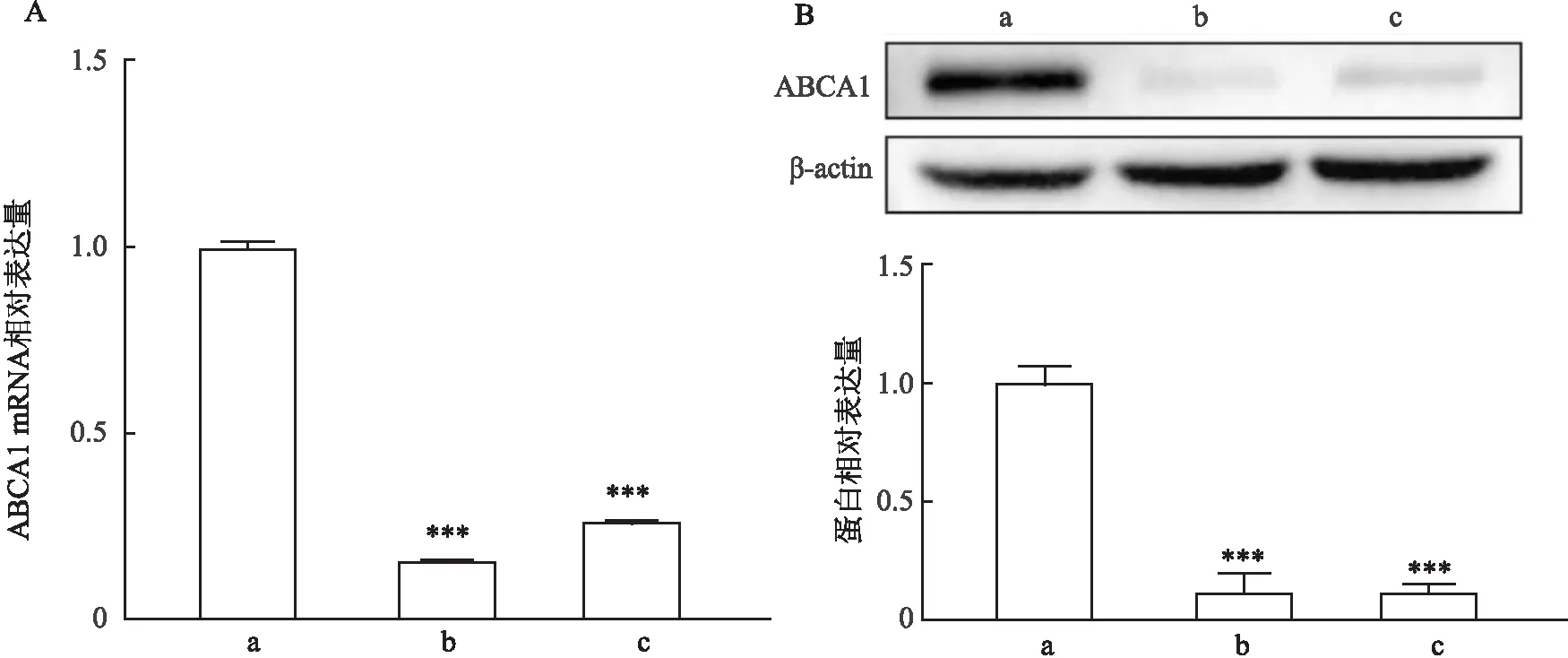
圖3 RT-qPCR及Western blot驗證ABCA1敲減效率A、B:RT-qPCR及Western blot實驗驗證ABCA1敲低效率;a:sh-NC組;b:shABCA1-1組;c:shABCA1-2組;與sh-NC組比較:***P<0.001
2.3.2細胞劃痕實驗、Transwell實驗觀察敲低ABCA1對胃癌細胞HGC-27遷移、侵襲能力的影響 細胞劃痕實驗結果顯示,24 h及48 h后shABCA1組劃痕愈合率均低于sh-NC組,差異有統計學意義(P<0.01,圖4A)。此外,Transwell實驗結果顯示(圖4B),相較于sh-NC組,shABCA1組經遷移穿過Transwell小室的細胞減少(F=130,P<0.001),侵襲細胞數也減少(F=185,P<0.001),差異具有統計學意義。即敲低ABCA1使得胃癌細胞HGC-27遷移、侵襲能力受到抑制。
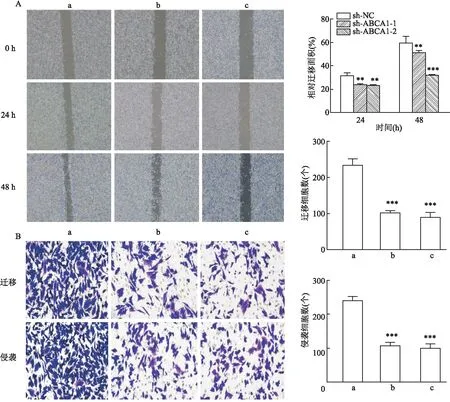
圖4 ABCA1對胃癌細胞的遷移和侵襲的影響A:細胞劃痕實驗檢測細胞遷移能力 ×40;B:Transwell實驗檢測遷移及侵襲穿孔細胞數 ×200;a:sh-NC組;b:shABCA1-1組;c:shABCA1-2組;與sh-NC組比較:**P<0.01,***P<0.001
2.3.3Western blot檢測ABCA1敲減后EMT相關蛋白的表達 為了探究ABCA1是否與胃癌EMT相關,通過Western blot檢測ABCA1敲減后EMT相關蛋白的表達,如圖5所示,與sh-NC組比較,shABCA1組的上皮細胞標志蛋白E-鈣黏蛋白(E-cadherin)表達上調(F=10.2,P<0.01),而間充質細胞標志蛋白N-鈣黏蛋白(N-cadherin)(F=22.76,P<0.01)和波形蛋白(Vimentin)表達下調(F=14.04,P<0.01);相較于sh-NC組,shABCA1組EMT相關轉錄因子Snail、Zeb1、Twist表達量受到抑制(FSnail=12.08,FZeb1=11.38,FTwist=12.21,P<0.01)。綜上,敲低ABCA1抑制胃癌細胞EMT進展。
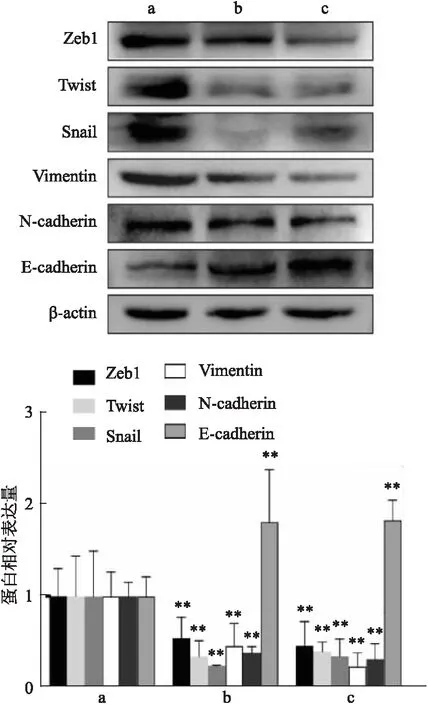
圖5 ABCA1對胃癌細胞EMT的影響A:sh-NC組;b:shABCA1-1組;c:shABCA1-2組;與sh-NC組比較:**P<0.01
2.4 ABCA1對EGFR/STAT3信號通路的影響Western blot實驗結果顯示,與sh-NC組相比,shABCA1組EGFR磷酸化水平下調(F=33.84,P<0.01);相較于sh-NC組,shABCA1組STAT3的總表達量及磷酸化水平均降低(F=804.1,P<0.01)。見圖6。
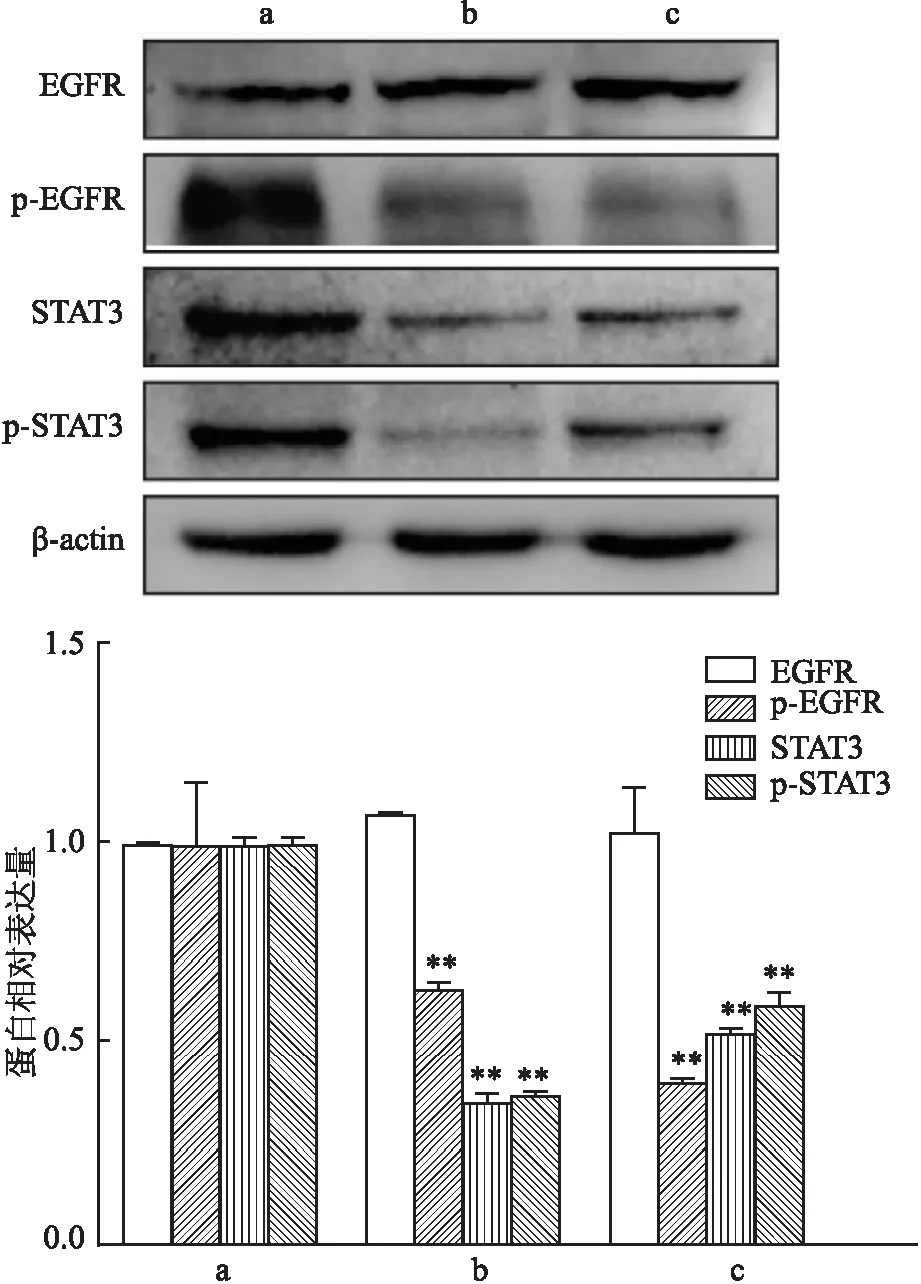
圖6 ABCA1對EGFR/STAT3信號通路相關標志分子的影響A:sh-NC組;b:shABCA1-1組;c:shABCA1-2組;與sh-NC組比較:**P<0.01
3 討論
胃癌是消化系統最常見的惡性腫瘤之一,我國是胃癌高發國家,盡管早期篩查和手術及放化療提高了總體生存率,但胃癌的預后仍不樂觀[7-8]。腫瘤的遠處轉移是胃癌患者高復發率和高病死率的重要原因之一[9],EMT促進癌細胞的運動表型,在腫瘤的侵襲和轉移中發揮著極其重要的作用[10]。因此,闡明胃癌侵襲轉移的分子機制,尋找治療新靶點或分子生物學標記,為胃癌的發現及靶向治療提供理論依據,是提高胃癌患者生存率亟待解決的關鍵問題。
ABC 轉運蛋白家族是一個高度保守的蛋白質家族,研究顯示其主要參與細胞脂質轉運,調節細胞膽固醇水平[11]。ABCA1是ABC轉運蛋白家族的重要成員之一,被報道參與細胞膽固醇轉運,調節脂質代謝[4]。膽固醇是細胞質膜的重要成分,影響胞膜的流動性,對細胞穩態維持必不可少,此外,膽固醇還富含脂筏,在細胞內信號轉導中起著關鍵作用[12]。近年來,研究[13]顯示膽固醇代謝可能在腫瘤的發生發展中發揮重要作用,影響腫瘤細胞轉移及EMT等生物學行為,ABCA1作為參與膽固醇代謝的重要成員,也被發現在三陰性乳腺癌組織中異常高表達[5],在結直腸癌中過表達并通過促進腫瘤生長、EMT和caveolin-1 依賴性侵襲惡化結直腸癌預后[6],發揮著促癌功能。然而,有研究顯示ABCA1具有抗腫瘤活性,上調 ABCA1 表達將抑制癌細胞增殖[14],促進癌細胞中線粒體介導細胞色素 C釋放以導致細胞死亡[15]。由于目前ABCA1在腫瘤中的功能尚不十分明確, ABCA1在胃癌中的作用亦鮮有報道,因此,其在胃癌發展中的作用及機制值得探索。
在本研究中,首先通過生物信息學對胃癌中ABCA1的表達及其與胃癌患者生存預后等的相關性進行分析,提示ABCA1 在胃癌中表達上調,進一步敲低ABCA1進行相關細胞表型實驗,表明ABCA1有促進胃癌侵襲、遷移及EMT等生物學行為。ABCA1通過介導膽固醇轉運來調節細胞膽固醇含量及膽固醇脂筏水平,影響細胞動力學及細胞內信號轉導從而影響細胞行為;此外,ABCA1部分錨定于細胞質膜,質膜是胞外信號傳導的必經之路,故推測ABCA1在胞外信號傳導至胞內過程中產生影響。本研究表明ABCA1可能通過調節EGFR/STAT3信號通路促進胃癌細胞侵襲、遷移及EMT,但ABCA1在胃癌中發揮促癌作用的具體機制還有待進一步探究。以上研究表明,ABCA1在胃癌中發揮著促癌功能,靶向 ABCA1可能作為胃癌診斷和治療的潛在靶標。

