克唑替尼治療c-MET擴增合并ALK融合肺黏液腺癌1例
桂再歡,冷哲楓,戴元榮
溫州醫科大學附屬第二醫院育英兒童醫院 呼吸與危重癥醫學科,浙江 溫州 325027
肺癌是世界上發病率和病死率最高的腫瘤之一,肺癌中有80%~90%為非小細胞肺癌(non-small cell lung cancer, NSCLC)[1],而肺黏液腺癌則是一種少見的特殊類型的肺腺癌,其年輕患者更為罕見。由于肺腺癌對化療敏感性較差以及化療所帶來的不良反應眾多,使得人們不斷探索更多肺癌治療的可能方法。自2004 年以來,研究者發現分子靶向治療作為驅動基因指導下的治療,具有“個體化”和“精準化”的優點,相比于傳統化療藥物有較好的療效。細胞間質上皮轉化因子(cellarmesenchymal epithelial transition factor, c-MET)是肝細胞生長因子的酪氨酸激酶受體,位于人染色體7q21-q31,由α亞基和β亞基以二硫鍵形式連接[2]。c-MET通路異常激活主要包括MET14 外顯子跳躍突變、MET擴增和MET蛋白過表達3 種類型,此三種突變均可導致腫瘤的發生。研究發現存在c-MET擴增的NSCLC可能對以間變性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、ROS1為主要靶點的酪氨酸激酶抑制劑克唑替尼敏感[3-5]。查閱PubMed、Web of Science、中國知網等文獻數據庫后,我們發現國內關于克唑替尼治療c-MET擴增和ALK融合的黏液腺癌患者的報道很少。現筆者報告l例c-MET基因擴增陽性合并ALK融合陽性的局部晚期肺黏液腺癌患者,經克唑替尼治療1個月后,肺部病灶完全緩解。
1 病例資料
患者,女,26歲,因“體檢發現左肺部占位1 d”于2019年9月18日入院。胸部CT提示:左肺上葉占位性病變,大小為4.7 cm×3.5 cm,無咳嗽咳痰、胸痛咯血等不適。入院后于左肺下舌段行經支氣管鏡肺活檢術,病理見少許游離黏膜上皮及纖維結締組織伴炎細胞散在,未見惡性腫瘤細胞;同日行肺穿刺活檢,病理報告:黏液腺癌。2019年9月25日PET/CT示左肺上葉后段不規則軟組織腫塊影,氟代脫氧葡萄糖(fludeoxyglucose, FDG)代謝增高。余器官FDG代謝未見異常。診斷為“左肺黏液腺癌”,術前分期T2bN0M0,IIA期。2019年10月8日于我院胸外科行“胸腔鏡下左肺上葉切除+淋巴結清掃術”(見圖1)。術中見腫瘤大小為5.2 cm×3.8 cm×4.0 cm,術后病理報告:左肺上葉周圍型低分化黏液腺癌,癌組織侵及胸膜。支氣管淋巴結(0/4),左第5組淋巴結(0/2),左第6組淋巴結(0/2),左第7組淋巴結(2/7)癌轉移,左第10組淋巴結(0/1),左第11組淋巴結(0/1)。免疫組化結果顯示:CD31(-)、CD56(-)、CDX-2(-)、CK20(-)、CK7(+)、D2-40(-)、Ki-67(5%~10%+)、Musin-2(-)、NapsinA(+)、p40(-)、p63(-)、S-100(-)、TTF-1(+)、Villin(-)。術后分期為sT3N2M0,IIIB期。腫瘤組織基因檢測結果顯示:ALK(Exon19)-EML4(Exon21),突變豐度9.98%。

圖1 患者術前和術后胸部CT圖像
患者為局部晚期肺癌,因經濟問題,拒絕靶向治療,2019年10月23日開始予含鉑雙藥術后輔助化療,化療期間消化道反應明顯,輔助化療4周期完成后繼續隨訪3個月,2020年5月于當地醫院復查胸部CT提示縱隔淋巴結腫大,為求進一步評估,2020年5月28日再次行PET/CT提示縱隔雙側多發淋巴結轉移,縱隔淋巴結較前增大,提示疾病進展。由于消化道反應明顯,患者拒絕繼續化療,考慮基因檢測為ALK融合突變,予阿來替尼600 mg 2次/d。2021年8月復查CT示:右肺散在慢性感染及多發結節,縱隔淋巴結腫大,于我科住院抗感染治療5 d,并行超聲內鏡引導下的經支氣管針吸活檢(endobronchial ultrasound-guided transbronchial needle aspiration, EBUS-TBNA),7組及4R組淋巴結細胞蠟塊見NSCLC細胞,2021年9月8日復查胸部CT提示兩肺感染,多發結節,較2021年8月有所進展,轉移可能,縱隔淋巴結腫大、融合。2021年9月15再次行CT引導下肺穿刺活檢,病理報告為中-低分化肺腺癌;免疫組化:CK7(+)、TTF-1(+)、NapsinA(弱+)、CK5/6(-)、p40(-)、Ki-67(約80%+)。腫瘤組織基因檢測提示MET擴增,拷貝數3.09,ALK(Exon20)-EML4(Exon20),突變頻率2.97%,ALK(Exon19)-EML4(Exon21),突變頻率9.95%,靶向治療療效評價為疾病進展。患者ALK融合突變及c-MET基因擴增,根據美國國家綜合癌癥網絡(National Comprehensive Cancer Network, NCCN)指南,予克唑替尼250 mg,每天2次,口服,用藥1個月后于2021年11月23日行胸部CT提示較2021 年9 月8 日兩肺結節及縱隔、肺門淋巴結腫大基本吸收(見圖2)。隨訪至2022年2月19日,未復發及轉移。
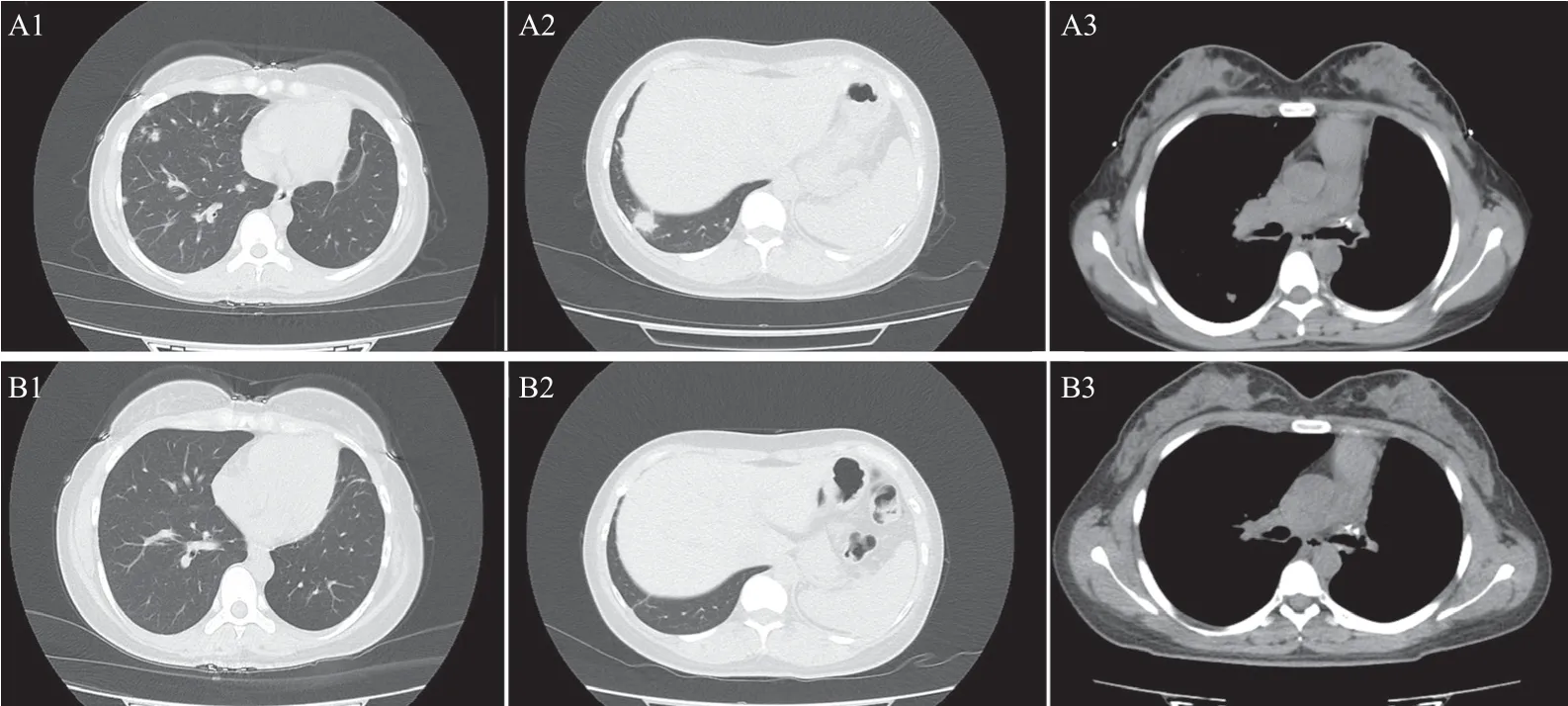
圖2 克唑替尼治療前后兩肺及縱隔轉移灶CT圖像比較
2 討論
近年來肺癌的靶向治療領域取得重大突破,靶向治療使得有相應基因突變的肺癌患者生存期顯著延長,大大提高患者的生存質量。克唑替尼是一種小分子酪氨酸激酶抑制劑,于2011 年8 月26日獲得美國食品藥品監督管理局(Food and Drug Administration, FDA)批準使用[3-5]。目前已有研究證實對于ALK融合及ROS1 陽性的晚期NSCLC患者而言,克唑替尼有良好的有效性及安全性。
針對MET14外顯子跳躍突變晚期NSCLC,有相關研究表明卡馬替尼和特泊替尼有一定的有效性及安全性[6-7],FDA批準其用于局部晚期或轉移性MET14跳躍突變的NSCLC患者。但對于c-MET擴增,各國指南尚無統一推薦藥物。有研究顯示克唑替尼治療c-MET原發擴增和繼發擴增的客觀緩解率分別為75.0%和50%,并且發現c-MET基因拷貝數≥9.0的肺癌患者經克唑替尼治療后無進展生存期更長[8]。相似地,蔣濤等[9]發現c-MET擴增程度或影響克唑替尼的療效:在高度擴增即c-MET/CEP7 比值>5 的患者中,口服克唑替尼250 mg每天2次,其有效率高達67%,顯著高于中、低度擴增的0%和17%的有效率。這提示克唑替尼可能是中、高度c-MET擴增晚期NSCLC人群的潛在選擇。2022 年最新NCCN指南推薦克唑替尼、卡馬替尼及替泊替尼用于高水平的MET擴增。
本病例的特點之一:病理類型為肺黏液腺癌,是一種少見的特殊類型的肺腺癌,國外有文獻報道其約占肺癌所有病理類型的0.25%[10-11]。兩項回顧性研究總結了肺黏液腺癌的基因突變類型特點,認為KRAS突變最為常見,其突變率分別為76%和71%[12-13]。有研究發現,ALK重排的患者占總原發性肺黏液腺癌患者的34.2%;而對于一般的NSCLC患者來說,ALK重排僅占3%~8%;在肺腺癌患者中,其比例為13%。這說明了ALK重排現象在原發性肺黏液腺癌較一般肺腺癌更為常見[14]。本例患者術后第一次基因檢測為少見的ALK融合突變,但患者因經濟問題而選擇術后輔助化療,疾病進展后選擇阿來替尼治療,治療過程中規律隨訪至2021年8月出現兩肺及縱隔淋巴結轉移,再次基因檢測提示ALK融合合并c-MET擴增。盡管某些腫瘤患者最初對于TKI敏感,但最終會產生耐藥性。ALK-TKI耐藥機制包括ALK依賴性耐藥和非ALK依賴性耐藥,其中非ALK依賴性耐藥機制最常見的為替代或旁路信號通路的激活,目前已知的旁路機制包括MET、EGFR、SRC和IGF1R的激活,在大約一半的病例中,對第二代ALK-TKI的耐藥性是由于ALK激酶結構域中的繼發性突變引起的[15]。此前已報道5%~20% EGFR-TKI耐藥病例出現MET擴增,但MET擴增對于ALK-TKI耐藥的作用機制尚未完全明確,基礎研究表明在ALK陽性細胞系中表達ST7-MET可誘導對ALK-TKI的耐藥,這種耐藥又可被ALK/MET的雙重抑制劑所逆轉[16]。CHEN等[17]研究發現,在一小部分晚期NSCLC患者中,c-MET過度表達與ALK重排共存。以上研究提示獲得性MET突變的患者可能從同時針對ALK/MET的靶向治療中獲益。
本例患者為青年女性,局部晚期肺黏液腺癌,4個周期含鉑雙藥化療失敗且不良反應明顯,腫塊穿刺活檢,NGS提示ALK(Exon19)-EML4(Exon21),予阿來替尼靶向治療2個月后出現縱隔淋巴結及兩肺轉移,提示耐藥,后再次行轉移灶穿刺送檢NGS提示MET擴增,合并ALK融合,予克唑替尼治療,1個月后兩肺轉移病灶及縱隔腫大淋巴結基本完全吸收,療效評價為完全緩解,用藥期間未出現明顯不良反應。
從上述病例及相關文獻中我們發現,對于肺腺癌伴ALK陽性和c-MET擴增NSCLC患者,克唑替尼靶向治療可能有效。當NSCLC經過一線靶向治療后出現獲得性c-MET擴增,仍可能從其他靶向藥物治療中獲益。目前還需要更多研究來證實并探索其中可能存在的機制。

