慢性阻塞性肺疾病患者INOS、HIF-1α及PPAR-γ的表達及與氣流阻塞的相關性研究
王紀偉 孫曉麗 景小麗
鄭州陽城醫院呼吸內科,河南省登封市 452470
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是由于氣道炎癥的存在,導致呼吸系統產生病理生理改變,能進一步發展為肺心病和呼吸衰竭的慢性疾病[1]。炎癥細胞分泌高濃度蛋白酶和氧化產物引起的氧化應激是COPD的主要發病機制,由于氣道分泌物增多,慢性咳嗽、咳痰、氣短和呼吸困難成為本癥典型癥狀[2]。
過氧化物酶增殖物激活受體(Peroxisome proliferactor-activited receptors,PPARs)是核激素受體家族中的配體激活受體,目前已發現包括PPAR-α、PPAR-β/δ、PPAR-γ在內的三個亞型[3]。PPAR-γ是重要的細胞分化轉錄因子,在人體的脂肪組織、血管平滑肌組織、心肌組織中均有表達[4]。其中氣道上皮組織中的PPAR-γ可對細胞活素介導的誘生型一氧化氮合酶(Inducible nitric oxide synthase,INOS)的表達產生抑制作用,而INOS作為一種同工酶,當其表達受到抑制時,其在免疫系統對抗病原體的能力也得到削弱[5]。此外,低氧誘導因子(Hypoxia-inducible,HIF-1)是一種調節氧穩態的核心轉錄因子,由HIF-1α及HIF-1β兩個亞基組成[6]。近年來有研究發現,在伴有不同程度缺氧的COPD患者中HIF-1出現異常表達,推測其與氣道炎癥、重塑及肺動脈高壓等病理改變有密切關系[7]。目前關于INOS、HIF-1α及PPAR-γ在COPD患者中的表達及臨床意義存在諸多爭議,本研究通過研究COPD患者血清和肺組織中INOS、HIF-1α及PPAR-γ的表達和變化,并分析其與氣流阻塞之間的關系,現報道如下。
1 資料與方法
1.1 一般資料 回顧性分析我院2018年9月—2019年9月因肺部占位性病變行支氣管鏡檢查的217例患者臨床資料,根據吸煙史、有無COPD史及肺功能檢查將受試者分為三組:A組(72例COPD患者)、B組(70例吸煙肺功能正常者)及C組(75例不吸煙肺功能正常者),三組性別、年齡、體質指數比較無顯著差異(P>0.05),A組、B組吸煙指數比較無顯著差異(P>0.05),見表1。
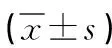
表1 三組一般資料比較
A組納入標準:滿足COPD診療標準[8]者;臨床資料完整者;無支氣管哮喘病史。排除標準:合并嚴重重要器臟疾患者;合并除COPD以外的其他肺部疾病者;入組前3個月內有呼吸、消化系統感染者。B、C組近2個月均無呼吸系統疾病史,且體格檢查、胸部X線攝片及肺通氣功能測定均未見異常。
1.2 研究方法 收集所有研究對象臨床資料,比較不同人群一般資料、肺功能指標、INOS、HIF-1α及PPAR-γ表達的水平,并分析其與氣流阻塞程度的相關性。其中,通氣指標[第1秒用力呼氣容積(FEV1)、用力肺活量(FVC)及FEV1/FVC]以70%為界,分為≥70%和<70%, 而<70%部分又以依次遞減10%再分級, 以此表達氣流阻塞的嚴重程度。
1.3 檢測方法
1.3.1 標本收集:所有研究對象術前于空腹狀態下抽取靜脈血5ml,離心(3 000r/min,15min)后取血清,并保存在-20℃冰柜中。術前霧化吸入2%利多卡因麻醉氣道,取仰臥位,給予鼻塞吸氧和心電監護,支氣管鏡經鼻腔進入氣道,活檢部位選擇肺占位病變的對側葉支氣管間脊,鉗取組織置于多聚甲醛中固定、梯度酒精脫水、透明后石蠟包埋,做2μm厚切片以備免疫組織化學抗體染色用。
1.3.2 試劑:鼠抗人PPAP-γ一抗及兔抗人INOS、HIF-1α均購自Santa cruze公司,即用型SP試劑盒、DAB染色試劑及蘇木素盒購自北京中杉金橋有限公司。
1.3.3 免疫組化肺組織INOS、HIF-1α及PPAR-γ的表達:制備聚賴氨酸防脫切片,常規脫蠟、抗原修復及山羊血清封閉。嚴格按照試劑盒檢查步驟,并進行DAB染色、蘇木素復染,然后脫水封片。在顯微鏡400倍下用全自動圖像分析系統對陽性染色進行分析,測定三者的平均吸光度值,隨機檢測4個高倍視野后計算平均值,作為該切片的代表值。
1.3.4 肺功能測定:COPD患者于早起時吸入支氣管擴張劑后用肺功能儀檢測肺功能,反復檢測3次,取最高值,記錄FEV1、FVC及FEV1/FVC。
2 結果
2.1 三組肺功能比較 A組FEV1、FVC及FEV1/FVC較B組、C組低,差異有統計學意義(P<0.05),而B、C組FEV1、FVC及FEV1/FVC比較無顯著差異(P>0.05),見表2。
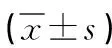
表2 三組肺功能指標比較
2.2 INOS、HIF-1α及PPAR-γ免疫組織化學平均吸光度值比較 A組和B組間INOS、HIF-1α及PPAR-γ表達比較無顯著差異(P>0.05);C組INOS、HIF-1α表達水平較A組、B組低,PPAR-γ表達水平較A組、B組高,差異有統計學意義(P<0.05),見表3。

表3 三組INOS、HIF-1α及PPAR-γ免疫組織化學平均吸光度值比較
2.3 INOS、HIF-1α及PPAR-γ表達與肺功能相關性 PPAR-γ與FEV1、FVC及FEV1/FVC呈正相關(P<0.05),INOS、HIF-1α與FEV1、FVC及FEV1/FVC呈負相關(P<0.05),見表4。

表4 INOS、HIF-1α及PPAR-γ表達與肺功能相關性分析
3 討論
COPD是一種常見的、治療耗資較高的可預防性慢性呼吸系統疾病,可對人們日常生活能力造成嚴重影響。在COPD的影響下,呼吸道中多個器官組織的結構被破壞,可出現相應的病理生理學改變[9]。其中持續的氣道阻塞是本病的主要特點,隨著COPD的進展,長期慢性缺氧可導致肺血管功能異常,造成肺循環的結構重組[10]。因此對參與COPD氣道阻塞發生和發展的相關指標水平進行研究,對評估患者疾病嚴重程度等方面有重要意義。
3.1 INOS與COPD 一氧化氮合酶為一種重要的同工酶,在內皮細胞、巨噬細胞、神經吞噬細胞及神經細胞等中都有著廣泛的分布。INOS是一氧化氮合酶的亞型之一,其生物活性、調節方式等有一定的特性[11]。由于INOS為非鈣離子依賴型,在靜息細胞中無表達,而當細胞受到炎癥因子或免疫微生物刺激時則會催化合成大量一氧化氮[12]。而一氧化氮可參與機體氧化還原過程,并產生一氧化氮分子使血管擴張,當機體內一氧化氮濃度高于生理濃度時,可造成嚴重的氧化損傷。此外,一氧化氮的代謝產物可活化基質金屬蛋白酶,降解肺實質的組分細胞外基質,導致肺氣腫等的發生,且此種作用機制在COPD的發展中發揮著關鍵作用[13]。楊加鵬等[14]研究發現,肺癌患者INOS表達升高,認為肺部無機物的賦存及INOS參與的相關信號通路的激活促進了肺部病變的發生。另外在鼠實驗[15]中也發現,注入高劑量羥基紅花黃色素A的大鼠INOS水平顯著升高。本研究結果顯示,A組和B組患者INOS的表達均較C組強,通過相關性分析亦發現INOS與FEV1、FVC及FEV1/FVC呈負相關(P<0.05)。由此可證實,COPD患者支氣管黏膜中可分泌高濃度INOS,而INOS及其代謝物可使肺組織脂質過氧化,高濃度下可加重肺功能損傷,形成一個惡性循環。值得注意的是,吸煙能導致人體血漿中脂質過氧化物的增加,加速COPD的形成。
3.2 HIF-1α與COPD HIF-1α為具有轉錄活性的核蛋白,具有相當廣泛的靶基因譜,包括炎癥發展、缺氧適應及腫瘤生成等相關的靶基因[16]。當其與相關的靶基因結合后,通過轉錄和轉錄后調控可產生一系列相應的反應,通常會給機體帶來病理性損害。近年來,關于COPD病理改變與HIF-1α的關系引起人們重視。由于HIF-1α可促進趨化因子釋放介導氣道炎癥及起到重塑,改變氣道內纖維功能,導致黏膜黏液的高分泌。鞠鑫鵬等[17]研究發現COPD合并肺部癌變組織HIF-1α呈強陽性表達,經相關性分析發現肺組織勻漿HIF-1α與肺功能指標負相關,并推測其與肺功能的異常改變有關。本研究結果顯示,HIF-1α在A組和B組的支氣管黏膜上皮細胞、肺泡巨噬細胞的胞漿中表達增強,免疫組織化學平均吸光度值也高于C組(P<0.05);進一步通過相關性分析,發現HIF-1α與FEV1、FVC及FEV1/FVC呈負相關(P<0.05),提示HIF-1α表達與COPD患者氣道阻塞關系密切。
3.3 PPAR-γ與COPD PPARs是一類配體依賴的轉錄調節因子,具有N端區、居中高保守DNA結合區和C端的激素結合區。其配體通常為脂溶性分子,當其與各自的配體結合后可引起機體的變化,促進或抑制靶基因的表達。PPAR-γ作為其主要的亞型之一,與多種炎性細胞的活性和表達關系密切。其在原位支氣管氣道上皮細胞中有表達,可抑制此類細胞的活性,并激活內源性PPAR-γ,拮抗炎性反應。Raoufy等[18]認為PPAR-γ具有改變巨噬細胞的轉運,增加巨噬細胞吞噬功能等作用,可促進實用性免疫反應的發生,減輕包括COPD在內的多種疾病狀態。而李巧榮[19]發現吸煙可導致COPD患者及肺功能正常患者支氣管黏膜組織PPAR-γ表達增強,認為其可能與煙草導致肺功能下降有關。而這基本與本研究關于PPAR-γ的結果一致,進一步提示其表達可反映COPD患者氣道阻塞程度。
綜上所述,COPD患者INOS、HIF-1α表達增強,而PPAR-γ表達減弱;INOS、HIF-1α及PPAR-γ與氣道阻塞有顯著的相關性,在誘導機體PPAR-γ的表達或提高其活性,對緩解COPD患者肺功能下降有一定作用,可作為臨床治療的新思路。

