羚牛骨髓間充質干細胞的分離培養與鑒定
賈 佳,郭含星,王娟娟,羅偉強,耿陽陽,高夢溪,王君建,潘廣林,賈康勝,嚴興榮
(1. 西北大學 生命科學學院 西部資源生物與現代生物技術教育部重點實驗室,西安 710068;2. 陜西省野生動物保育重點實驗室,西安 710068;3. 陜西省珍稀野生動物搶救飼養研究中心,西安 710402)
間充質干細胞(Mesenchymal stem cells,MSCs)是一種具有自我更新與多向分化能力的基質細胞,可分化為中胚層細胞,如脂肪細胞、骨細胞、軟骨細胞以及其他胚胎譜系的細胞。MSCs可從多種器官組織中分離得到,如臍帶、子宮內膜息肉、月經血、骨髓及脂肪組織[1]。來源于骨髓的MSCs(Bone-marrow-derived MSCs,BM-MSCs)通過與免疫細胞的相互作用可實現效應功能的調節[2]。近年來的多項研究結果表明,MSCs具有的多能性使其成為臨床醫療應用上極具吸引力的選擇,如細胞治療、再生醫學和組織修復等[3]。此外,MSCs在野生動物保護方面發揮重要作用。目前,已有研究實現恒河猴、大熊貓、棕熊和小熊貓MSCs的分離鑒定[4]。研究表明,瀕危野生動物MSCs的超低溫保存可作為就地保護和遷地保護的有效補充措施,最大限度保存種群的遺傳多樣性[5]。
羚牛(Budorcastaxicolor),屬偶蹄目,牛科,主要分布在中國西北、西南高海拔地區以及印度、不丹等地[6-9]。受過度捕獵和棲息地喪失等因素影響,羚牛被世界自然保護聯盟(International Union for Conservation of Nature,IUCN)紅色名單列為易危物種[10],是國家一級重點保護動物。為保護和改善羚牛及其他野生動物的宜居環境,中國已實施包括退耕還林工程和天然林保護工程在內的多項保護計劃[11-12]。然而,就地保護策略難以維持羚牛這類小種群的繁殖和足夠的遺傳多樣性,因此,亟需開發更加可行的保護途徑以應對羚牛種群規模的不斷減少[13]。近年來,集中在行為生態學領域的研究使得羚牛種群數量有所上升[14-16];線粒體全基因組等分子水平的測定與分析為羚牛遺傳多樣性的保護提供了資料[17-19]。但是,細胞治療與體細胞克隆等技術作為瀕危物種保護的重要措施[20],圍繞其開展的羚牛保護學研究較少。BM-MSCs具有的易獲取、易培養、低免疫等特性可能作為羚牛干細胞疾病臨床治療與胚胎克隆的有效載體。因此,本研究從羚牛骨髓中分離BM-MSCs,在細胞水平上進行鑒定,為羚牛生物多樣性保護以及間充質干細胞在野生瀕危物種中的應用研究提供依據。
1 材料與方法
1.1 試驗材料
1.1.1 動物材料 動物樣品采自樓觀臺珍稀野生動物搶救飼養研究中心(陜西省西安市周至縣)12歲正常死亡6 h后的雄性羚牛。將無菌分離的羚牛股骨用含青霉素-鏈霉素的磷酸緩沖液洗滌3次,4 ℃保存,備用。本研究涉及的所有動物試驗程序均已獲得西北大學實驗動物倫理委員會批準[許可證號:SYXK(陜)2021-004]。
1.1.2 試劑與儀器 試劑:胎牛血清(Fetal bovine serum,FBS)、高糖培養基(Dulbecco’s modifified Eagle medium,DMEM)、胰島素-轉鐵蛋白-硒(Insulin-Transferrin-Selenium,ITS)、胰島素(Insulin,IS)、胰蛋白酶(Gibco);乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)、吉姆薩染液(Giemsa stain solution)、3-異丁基-1-甲基黃嘌呤(3-Isobutyl-1-methylxanthine,IBMX)、地塞米松(Dexamethasone,DM)、吲哚美辛(Indometacin,ID)、抗壞血酸(Ascorbic acid,AA)、秋水仙素(北京索萊寶科技有限公司);轉化生長因子β3(Transforming growth factor-β3,TGF-β3)、β-甘油磷酸酯(β-Glycerophosphate,β-GP)、油紅(Oil Red O)、茜素紅(Alizarin Red S)、阿利新藍(Alcian blue)、胰蛋白酶(Sigma Aldrich);多聚甲醛(PFA)、氯化鉀、無水乙醇、甲醇、冰醋酸(上海阿拉丁生化科技股份有限公司)。
儀器:超凈工作臺(北京昊諾斯科技有限公司ECO 0.9),高溫高壓滅菌鍋(上海賽默生物科技發展公司SX-300),體視顯微鏡(上海舜宇恒平科學儀器有限公司S10),二氧化碳培養箱(恒生實驗設備有限公司CHP-80Q),倒置熒光顯微鏡(Nikon),醫用冷藏箱(廈門藍冰生物科技有限公司QBLL0812),-20 ℃冰箱(海爾DW-25L256),-80 ℃冰箱(賽默飛世爾科技公司ULTS1490),流式細胞儀(BD Biosciences FACSAriaTM III),高速離心機(賽默飛世爾科技公司H1850)。
1.2 試驗方法
1.2.1 羚牛骨髓間充質干細胞的分離與培養 無菌條件下分離死亡羚牛股骨,去除附著在骨頭上的所有結締組織,用套管針連接10 mL注射器抽吸骨髓。抽吸后將骨髓置于直徑10 cm培養皿中,加入10 mL的含20% FBS的DMEM培養基,在37 ℃,5% CO2,飽和濕度條件下培養7 d,期間2 d更換1次培養基。原代細胞生長至80%左右時傳代。用0.25%胰蛋白酶和0.04% EDTA消化,含10% FBS的DMEM中和,1 000 r/min離心3 min后棄上清,加入新鮮培養基制成單細胞懸液。將1 mL濃度為1×106mL-1的細胞懸液置于直徑10 cm的培養皿中,加入9 mL DMEM和10% FBS培養至80%融合度時冷凍保存,凍存時間不超過3代[21]。
1.2.2 染色體組型分析 用0.3 μg/mL的秋水仙素處理羚牛骨髓間充質干細胞6 h。細胞經胰蛋白酶(0.25%胰蛋白酶,0.04% EDTA)消化后,加入低滲溶液(0.075 mol/L KCl)重懸,37 ℃處理30 min后離心去上清。加入固定液(甲醇∶冰醋酸=3∶1,體積比)固定細胞3次,制成細胞懸液。將細胞懸液滴至高度大于10 cm的 -20 ℃預冷載玻片上,風干后用染色液(Giemsa∶PBS=1∶9)染色[22]。顯微鏡下觀察染色體形態并進行組型分析。
1.2.3 細胞表面抗原鑒定 采用流式細胞技術對骨髓間充質干細胞表面抗原進行鑒定[23]。 0.25%胰蛋白酶消化細胞,10% FBS中和培養基,PBS洗滌3次。用移液器反復吹打,獲得均勻細胞懸液。將細胞稀釋至濃度為0.5~1×106mL-1后用2% PFA固定細胞20 min,PBS洗滌3次,采用以下抗體進行流式細胞免疫反應:CD14-FITC(Fluorescein isothiocyanate),CD19-FITC,CD34-FITC,CD45-FITC,HLA-DR-FITC,CD105-PE(phycoerythrin),CD166-PE,CD44-PE,CD73-PE,CD90-PE(表1)。使用安裝FACSComp軟件的FACSCalibur流式細胞儀進行分析。

表1 流式細胞免疫反應使用抗體Table 1 Antibodies for flow cytometry
1.2.4 骨髓間充質干細胞的定向分化培養 細胞的成脂分化培養[24]:將P3代間充質干細胞消化處理制成單細胞懸液。將8×104個細胞接種于直徑3.5 cm的培養皿中培養24 h。隨后將培養基替換為成脂分化培養基(含10% FBS的DMEM ,500 μmol/L IBMX,1 μmol/L DM,10 μmol/L IS,200 μmol/L ID)進行定向誘導培養,期間每周更換2次培養基。21 d后,PBS沖洗2次,4% PFA固定10 min。用染色液(0.3% Oil Red O溶于60%異丙醇)處理細胞20 min后,60%乙醇漂洗2次,在倒置熒光顯微鏡下觀察細胞分化情況。
細胞的成骨分化培養[25]:P3代細胞消化處理后,將5×104個細胞接種于直徑3.5 cm的培養皿中培養24 h。用成骨分化培養基(含10% FBS的DMEM,0.1 μmol/L DM,300 μmol/L AA,10 mmol/L β-GP)進行定向誘導培養21 d。經固定處理后的細胞用Alizarin Red S染色30 min,漂洗后觀察細胞狀態。
細胞的成軟骨分化培養[26]:P3代細胞消化處理后,將2×105個細胞接種于直徑3.5 cm的培養皿中培養24 h。用成軟骨分化培養基(含10% FBS的DMEM,0.1 μmol/L DM,300 μmol/L AA,10 ng/mL TGF-β3,1% 100×ITS)進行定向誘導培養21 d。經固定處理后的細胞染色30 min(1% Alcian blue溶于3%乙酸),在倒置顯微鏡下觀察細胞的定向分化狀態。
1.2.5 數據處理 所有試驗至少獨立進行3次。數據以“平均數±標準差” 的形式表示。
2 結果與分析
2.1 羚牛骨髓間充質干細胞的分離培養與核型分析
光鏡下可見成纖維細胞狀的羚牛BM-MSCs貼壁生長,中間密度大,隨著代數增加逐漸向外擴散(圖1-A)。傳代培養至P5時,細胞仍維持正常形態(圖1-B)。觀察統計50 個分散較好的中期細胞,發現從羚牛骨髓分離出的MSCs染色體數目正常(2n=52)(圖1-C)。常染色體中有4對近中著絲點染色體和21對端著絲點染色體;在性染色體中,X染色體為端著絲點染色體,Y染色體長度最小,為近中著絲點染色體(表2)。
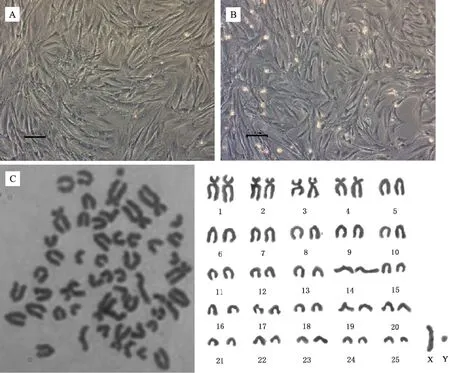
A. P1代 BM-MSCs 形態; B. P5 代 BM-MSCs 形態; C. 染色體組型分析。 標尺為100 μmA. Cell morphologies at P1; B.Cell morphologies at P5; C. Karyotype analysis of takin BM-MSCs. Bar=100 μm圖1 羚牛骨髓間充質干細胞形態與染色體組型分析Fig.1 Morphological and karyotype analysis of takin BM-MSCs
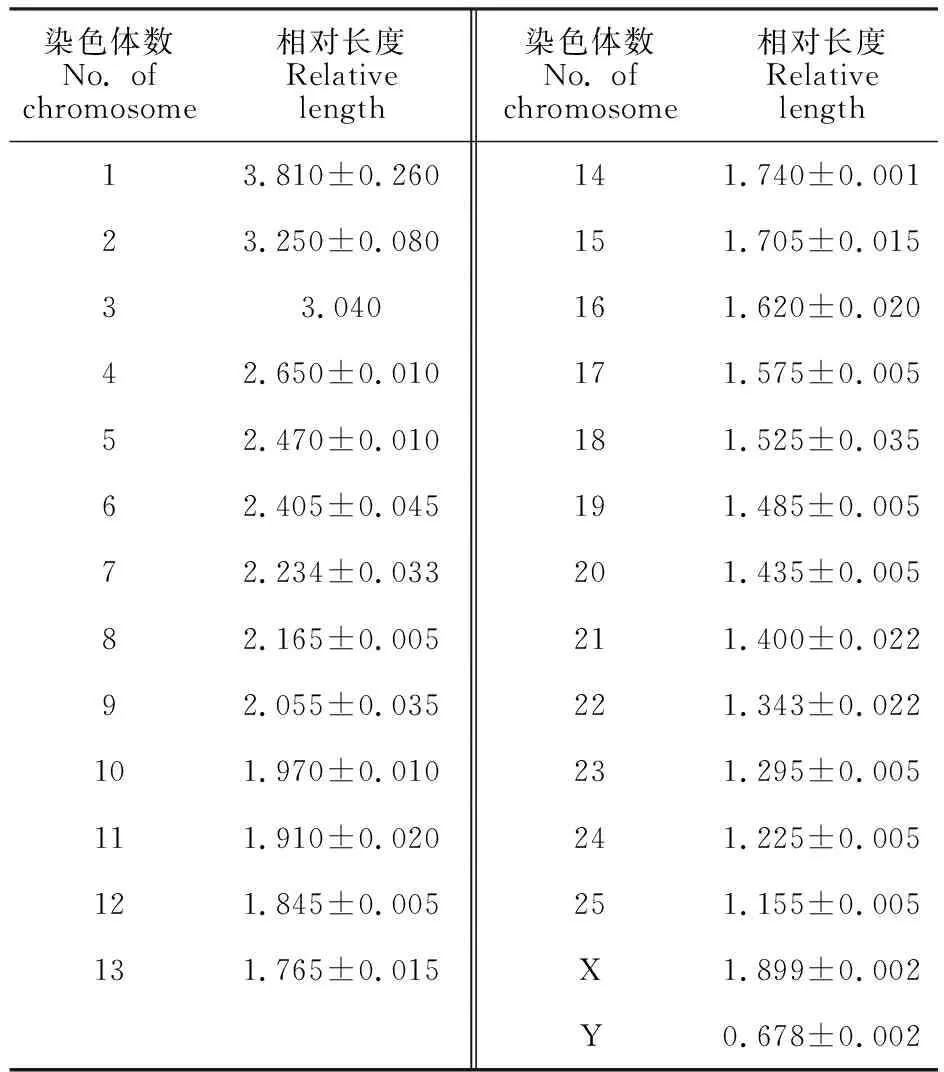
表2 羚牛染色體相對長度Table 2 Relative length of chromosomes in takin
2.2 羚牛骨髓間充質干細胞表面抗原分析
采用流式細胞術檢測細胞表面抗原CD105、CD166、CD44、CD73、CD90、CD14、CD19、CD34、CD45和HLA-DR。羚牛BM-MSCs對特異性表面標記CD105(97.1%)、CD73(95.9%)和CD90(97.6%)呈陽性,對CD14(單核細胞和巨噬細胞標記,3.1%)、CD19(b細胞標記,2.4%)、CD34(造血干細胞標記,1.4%)、CD45(泛白細胞標記,1.8%)和HLA-DR(3.7%)呈陰性。此外,羚牛BM-MSCs對CD166(94.7%)和CD44(97.2%)均呈陽性。同型對照顯示非特異性熒光(圖2)。
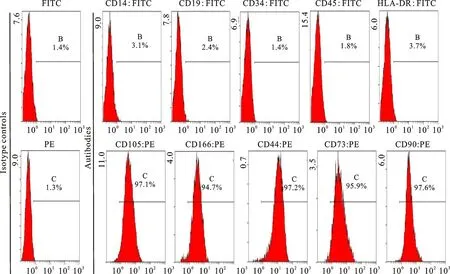
圖2 羚牛骨髓間充質干細胞表面特異性抗原的鑒定Fig.2 Identification of surface specific antigens of takin BM-MSCs
2.3 羚牛骨髓間充質干細胞分化潛能的檢測
為了鑒定羚牛BM-MSCs的分化潛能,將細胞分別置于成脂、成骨與成軟骨分化培養基中進行誘導分化。
細胞的成脂分化:與對照組細胞相比,分化誘導培養后的細胞生長速度逐漸下降并停止。分化前細胞呈正常梭形(圖3-A),分化誘導21 d后細胞形態發生改變(圖3-B)。Oil Red O染色呈陽性,可見橘紅色的空泡狀脂滴(圖3-E)。結果表明,羚牛BM-MSCs在體外具有向脂肪細胞分化的潛力。
細胞的成骨分化:置于分化培養基中的細胞與對照組細胞(圖3-A)相比,生長逐漸放緩,最終停止生長。細胞經成骨誘導培養21 d后呈方形或五角形(圖3-C)。Alizarin Red染色可觀察到骨細胞外基質沉積(圖3-F),這表明細胞具有成骨分化潛能。
細胞的成軟骨分化:BM-MSCs經誘導分化后可見形態均一,呈三角形、不規則多邊形或鋪路石樣的軟骨細胞(圖3-D)。誘導21 d后軟骨基質增多,經Alcian blue染色后呈現藍色(圖3-G);未誘導組細胞呈梭形生長(圖3-A)。上述結果顯示羚牛BM-MSCs具有成軟骨分化潛能。
3 討 論
MSCs已在小鼠[27]、大鼠[28]、兔子[29]、狗[30]、貓[31]、馬[32]、牛[33]、山羊[34]、綿羊[35]等實驗動物 或家畜中實現分離與體外培養。然而,包括羚牛在內的瀕危野生動物MSCs的相關研究較少。本研究成功分離的羚牛MSCs具有以下特性:維持正常核型的MSCs表現出貼附塑料表面生長的特性,細胞表面存在特異性抗原表達,具有多向分化潛能。上述研究結果均符合國際細胞治療學會(the International Society for Cellular Therapy,ISCT)宣布的MSC定義最低標準[36],這表明本研究從正常死亡羚牛骨髓中分離的細胞系確為MSCs。
MSCs可以從多種器官或組織中獲得,包括胎兒肝臟、骨髓、血液和羊水、出生時的臍帶組織和臍血、青年時發育中的牙齒、成年時的骨髓組織和脂肪組織[1]。研究顯示,來源于同一物種的不同組織或器官的MSCs在增殖能力、分化能力和/或其他生物學特性方面表現出不同的特征[37]。從瀕危動物分離的MSC活細胞冷凍保存技術是目前野生動物遺傳資源保護的有效策略之一[5]。因此,本研究成功分離鑒定的羚牛BM-MSCs可作為種質資源保護的種子細胞,實現羚牛遺傳資源的長期保存。然而,已有研究表明,來自臍帶的MSCs比骨髓等其他組織來源的MSCs具有更強的分化能力,易獲取且無傷害性,更加適合瀕危物種體外試驗與細胞治療相關研究[37-38]。因此,未來筆者將進一步嘗試提取臍帶組織以及其他來源的MSCs,為開展細胞水平的野生瀕危動物保護研究提供更多有效資源。
MSCs具有成脂、成骨與成軟骨多向分化潛能。研究表明,不同因子影響MSCs的多向分化。目前已有報道稱,DM,IS,ID和IBMX或4 種試劑聯合使用時可促進MSCs向脂肪細胞的分化[39]。DM、TGF、AA等因子對于MSCs的成骨分化以及成軟骨分化存在一定的影響[40]。TGF-β1是目前調控MSCs分化的首選生長因子之一。不同濃度的TGF-β1對MSCs分化的誘導效率不同,適宜濃度時可有效促進MSCs向成骨細胞的分化;而TGF-β2和TGF-β3則在促進MSCs的軟骨分化上強于TGF-β1,主要表現在促進葡糖胺聚糖和Ⅱ型膠原聚集方面[41]。作為TGF-β超家族成員之一的骨形成蛋白對于MSCs的誘導效應具有特異性[42-44]和劑量依賴性[45-46]。此外,普遍存在于多種器官組織中的成纖維細胞生長因子持續釋放時可增強軟骨分化。研究顯示,用含成纖維細胞生長因子(10 ng/mL)的培養基MSCs時可提高細胞增殖速率[47]。因此,為了促進羚牛MSCs的增殖和多向分化,可以考慮將適宜濃度的生長因子作為細胞培養的常規組成部分,以充分發揮MSCs的分化再造潛能。
體細胞核移植技術目前已成為多個物種繁殖和保護的重要途徑,在多種馴化物種和非繁殖或死亡的動物中成功實施[48]。利用體細胞核移植技術融合產生新個體的相關研究表明,該項技術可能成為保護瀕危野生物種的一種有效工具[5]。成纖維細胞在生物體中的數量較多,它們的分離和培養也比其他細胞類型更容易。基于上述原因,成纖維細胞在生物醫學研究中具有巨大潛力,也成為體細胞核移植技術的常見供體細胞[49]。然而,多項研究證實MSCs也可成為合適的核供體[5]。利用牛的羊水MSCs和脂肪MSCs生產克隆牛的研究表明,MSCs對于提高牛的核移植效率具有重要意義[50]。特別是,Su等[51]和Kwong等[52]分別對蒙古綿羊和山羊的BM-MSCs與成纖維細胞作為不同核供體制備的克隆胚胎體外發育能力進行了比較。結果顯示,利用BM-MSCs克隆的胚胎具有較高的卵裂率和囊胚率。這表明BM-MSCs可作為大型動物自體研究的良好細胞類型,并將成為體細胞克隆和未來轉基因研究的寶貴材料。此外,有研究將羚牛耳成纖維細胞與去核牛卵母細胞融合,產生羚牛胚胎,但發育率較低[53]。近年來,對于羚牛的分類學研究表明該物種與山羊、綿羊等羊亞科動物的親緣關系最近,存在高度保守性[14]。因此,在未來的研究中,羚牛MSCs將有望在種內與種間體細胞核移植技術上發揮巨大潛力。
4 結 論
綜上所述,本研究成功分離鑒定羚牛骨髓間充質干細胞,為羚牛生物多樣性保護研究提供依據。未來應從羚牛不同組織MSCs的分離培養以及體外胚胎克隆方面繼續開展深入研究,為瀕危野生動物資源保存奠定良好基礎。

