血清干擾素-γ、淀粉樣蛋白A及可溶性血管內皮生長因子受體-1在原因不明復發性流產患者中的表達及意義
明 妮, 劉 智, 吳海卉, 張桂桂, 劉麗華
(湖北省武漢百佳婦產醫院 婦產科, 湖北 武漢, 430000)
復發性流產(RSA)指連續自然流產發生次數≥3次,其與染色體異常、免疫功能異常、內分泌異常等緊密相關,但仍有50%左右RSA患者病因不明[1-2]。原因不明復發性流產(URSA)的發病機制雖尚未明確,但相關研究[3]指出,其與母-胎免疫耐受異常中負性調控因子關系密切。血清干擾素-γ(IFN-γ)在先天性免疫及適應性免疫的連接中發揮重要的調節作用[4]。血清淀粉樣蛋白A(SAA)為急性時相反應相關的免疫調節蛋白,在機體炎癥反應、細胞增殖、分化及免疫調節過程中具有重要作用,可能參與滋養層細胞的侵入及分化過程[5]。可溶性血管內皮生長因子受體-1(sFlt-1)主要由滋養層細胞分泌而成,可與血管內皮生長因子(VEGF)結合并產生血管抑制作用[6]。本研究前瞻性選取100例URSA患者與同期行人工流產的正常早孕婦女60例進行對照研究,探討血清IFN-γ、SAA及sFlt-1在URSA患者中的表達及意義,旨在為URSA患者的臨床干預及妊娠結局的改善提供參考,現報告如下。
1 資料與方法
1.1 一般資料
前瞻性選取2020年12月—2022年1月湖北省武漢百佳婦產醫院收治的URSA患者100例為研究組,另選取同期行人工流產的正常早孕婦女60例為對照組。納入標準: 研究對象均為停經者,尿妊娠實驗及血絨毛膜促性腺激素(HCG)均為陽性,且B超顯示早期宮內妊娠。排除標準: 嚴重內分泌失調、肝腎功能不全和免疫性疾病及血液性疾病者。URSA診斷標準[7]: ① 自然流產發生次數≥3次者; ② 影像學檢查顯示生殖器官無異常者; ③ 夫妻雙方染色體均顯示正常; ④ 性激素、血糖水平及甲狀腺功能正常者; ⑤ 病原體檢查正常者。對照組標準: 孕期無腹痛或陰道出血者; 無內分泌紊亂、生殖道感染、自身免疫性疾病及染色體畸形病史者; 無自然流產、胎停史者。研究組患者年齡20~39歲,平均(29.39±3.22)歲; 對照組孕婦年齡21~36歲,平均(27.08±3.61)歲。2組孕婦一般資料見表1。本研究經院醫學倫理會批準。
1.2 方法
統計2組的基線資料,包括年齡、體質量指數(BMI)、停經時間、孕周、孕囊直徑、分娩次數、自然流產次數、妊娠終止方式等。抽取受試者空腹外周肘靜脈血5 mL, 高速離心分層(3 000轉/min離心10 min, 離心半徑10 cm), 分離血清,送至檢驗科。血清IFN-γ、SAA均采用酶聯免疫吸附(EILSA)法檢測(試劑盒均購于上海研卉生物科技有限公司); 血清sFlt-1采用雙抗體夾心法檢測(上海江萊生物科技有限公司)。
1.3 統計學分析

2 結 果
2.1 2組一般資料比較
2組BMI、停經時間、孕周、孕囊直徑、妊娠終止方式比較,差異無統計學意義(P>0.05); 2組年齡、分娩次數及自然流產次數比較,差異有統計學意義(P<0.05)。見表1。
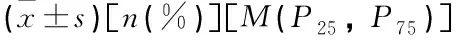
表1 2組一般資料比較
2.2 2組血清IFN-γ、SAA及sFlt-1水平比較
研究組血清IFN-γ、SAA及sFlt-1水平高于對照組,差異有統計學意義(P<0.05)。見表2。

表2 2組血清IFN-γ、SAA及sFlt-1水平比較
2.3 血清IFN-γ、SAA及sFlt-1的相關性分析
Pearson相關性分析結果顯示,血清IFN-γ與SAA、sFlt-1均呈正相關(r=0.671、0.728,P<0.05); SAA與sFlt-1呈正相關(r=0.708,P<0.05)。見表3。
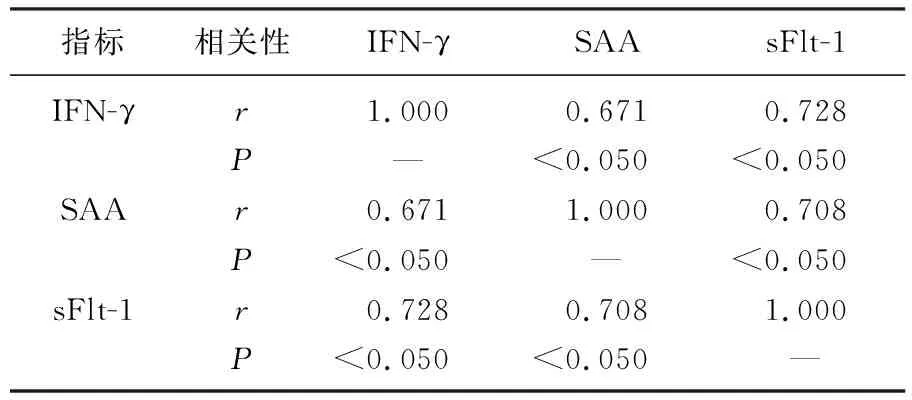
表3 血清IFN-γ、SAA及sFlt-1的相關性分析
2.4 URSA的二元Logistic回歸分析
以組別為因變量(賦值: 0=研究組,1=對照組),以年齡、IFN-γ、SAA、sFlt-1定量參數為自變量,納入Logistic回歸分析。二元Logistic回歸分析顯示,年齡、IFN-γ、SAA、sFlt-1為URSA發生的影響因素(P<0.05)。見表4。
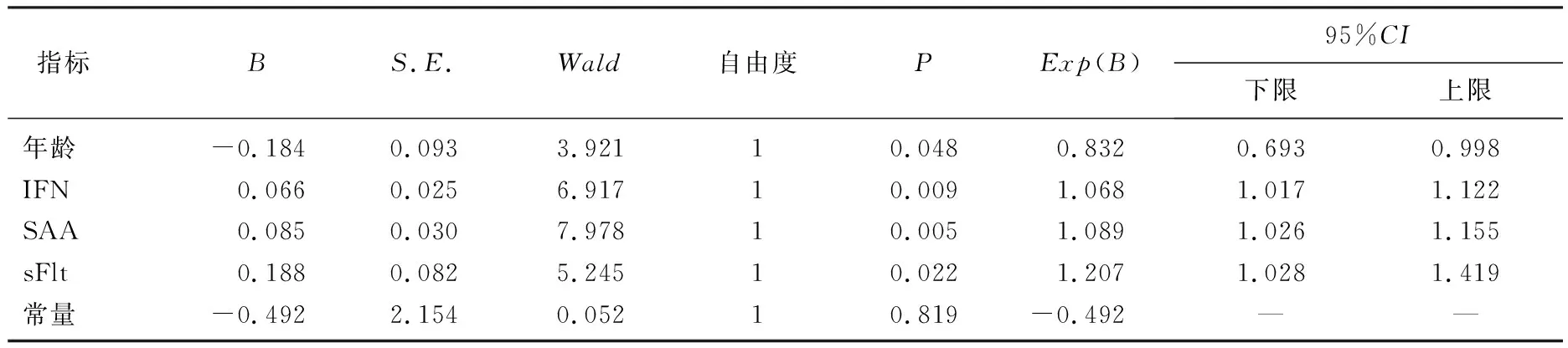
表4 URSA的二元Logistic回歸分析
IFN-γ: 干擾素-γ; SAA: 血清淀粉樣蛋白A; sFlt-1: 可溶性血管內皮生長因子受體-1。
2.5 血清IFN-γ、SAA及sFlt-1對URSA的預測
價值
以研究組為狀態變量,以對照組為參照指標,以血清IFN-γ、SAA及sFlt-1為檢驗指標繪制ROC曲線。結果顯示,血清IFN-γ、SAA及sFlt-1預測URSA的曲線下面積(AUC)為0.877、0.862、0.850,準確性較高; 以ROC曲線靠左上方約登指數的最大切點作為最佳臨界值(IFN-γ為35.705 μg/mL, SAA為21.360 μg/mL, sFlt-1為9.125 μg/L), 血清IFN-γ預測URSA的敏感度為80.0%、特異度為85.0%, SAA敏感度為78.0%、特異度為88.3%, sFlt-1敏感度為70.0%、特異度為90.0%, 診斷價值較好。見表5、圖1。
表5 血清IFN-γ、SAA及sFlt-1對URSA的預測價值
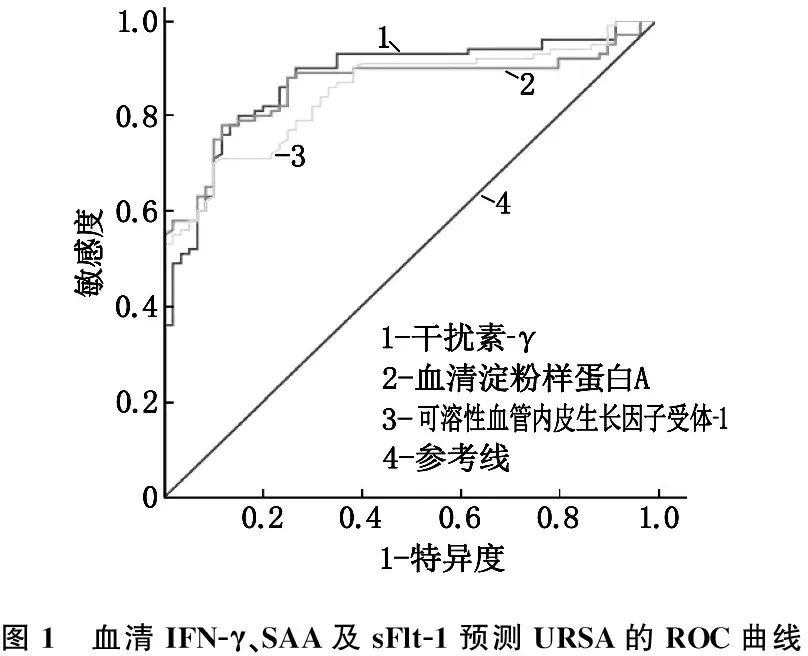
圖1 血清IFN-γ、SAA及sFlt-1預測URSA的ROC曲線
3 討 論
正常妊娠者的胚胎與母體內免疫系統不會產生排斥作用,而當母體-胚胎免疫耐受機制紊亂時,其胚胎可受免疫打擊而引發流產[8]。臨床研究[9]指出,RSA與染色體、生殖道異常、內分泌異常等密切相關,但URSA的致病機制尚未完全闡明。研究[10]顯示,母-胎界面免疫耐受異常為URSA的發病機制之一。妊娠免疫耐受機制復雜,免疫因素已成為URSA研究的熱點。研究[11]指出, CD4+Th在母體-胚胎免疫耐受過程中具有重要作用。CD4+Th包含Th1、Th2 2個亞型,Th1可刺激IFN-γ、白細胞介素(IL)-12等因子分泌,這些因子均可對滋養層細胞的生長產生抑制及排斥作用,介導滋養層細胞凋亡,并激活胎盤毒性細胞,引起流產,而Th2可刺激IL-4炎性因子分泌,促進機體抗體形成,抑制免疫炎性反應,維持妊娠。IFN-γ由淋巴細胞及單核細胞產生,具有人體免疫系統調節功能,其可誘導分泌Th1細胞因子[12]。本研究中,研究組血清IFN-γ水平顯著高于對照組,且IFN-γ水平升高為URSA的危險因素,提示血清IFN-γ與URSA有關。ROC曲線分析結果顯示,血清IFN-γ預測URSA的AUC為0.877, 預測敏感度及特異度均較高,提示血清IFN-γ可作為預測URSA的參考指標。
SAA為急性期蛋白,主要由載脂蛋白構成,可作為敏感的炎癥指標,在機體感染、炎癥存在時,其水平表現為不同程度升高。體外研究[13]表明, SAA可影響T淋巴細胞及巨噬細胞,進而抑制免疫反應,因此SAA被認為是T細胞的抑制因子。曹英等[14]研究報道, SAA的表達在妊娠早期胚胎滋養層顯著升高,提示SAA可能參與早期胚胎發育過程。研究[15]發現,正常妊娠者SAA濃度可激活Toll樣受體,進一步維持母胎耐受相關抗炎及促炎因子平衡,達到調節滋養層細胞侵入子宮蛻膜過程; 因此,若妊娠早期孕婦SAA水平顯著升高,這可能與滋養層細胞侵入及合體化過程異常有關。炎癥因子為SAA引起的滋養層細胞合體化異常的主要原因。研究[16]指出,子癇前期血清SAA水平可顯著升高,且與促炎細胞因子相關,其可能為子癇前期的發病機制之一。以上結論均提示, SAA水平升高可對滋養層細胞的合體化及侵入子宮蛻膜產生干擾作用,進而誘發流產。本研究中,研究組血清SAA水平顯著高于對照組,且SAA水平升高為URSA的危險因素; ROC曲線分析結果顯示,血清SAA預測URSA的AUC為0.862, 預測敏感度、特異度均較高,提示血清SAA對URSA具有一定的預測價值。
VEGF在胎盤絨毛血管中具有重要作用,可參與URSA的進展過程[17]。sFlt-1為VEGF跨膜受體的可溶形式,主要由胎盤合體及滋養細胞分泌而成,可與內皮細胞表面受體Flt-1形成異源二聚體,因此可拮抗VEGF,抑制其生物學活性[18]。研究[19]報道,機體血清sFlt-1水平升高可對血管內皮產生直接作用,造成其形態及功能異常,可抑制胎盤血管形成,造成胎盤缺氧,進展為流產。本研究中,研究組血清sFlt-1水平顯著高于對照組,且sFlt-1水平升高為URSA的危險因素; ROC曲線分析結果顯示,血清sFlt-1預測URSA的AUC為0.850, 預測敏感度、特異度均較高,與李俠等[20]研究結果具有一致性,提示血清sFlt-1對URSA具有一定的預測價值。
綜上所述,血清IFN-γ、SAA及sFlt-1水平升高與URSA的發生有關,且血清IFN-γ、SAA及sFlt-1水平可作為URSA的預測指標,對URSA的早期診斷及預測具有價值。但本研究存在不足,樣本量較小,因此仍需進一步擴大樣本進行研究。

