建構(gòu)認(rèn)識(shí)模型 提升“宏微結(jié)合”素養(yǎng)
唐琛 王慧 于少華 孫敏


摘要: 以“離子反應(yīng)”教學(xué)為例,創(chuàng)造真實(shí)的實(shí)驗(yàn)情境,激發(fā)學(xué)生的認(rèn)知沖突,引導(dǎo)學(xué)生自主探究實(shí)驗(yàn)。從單一電解質(zhì)溶液到多種電解質(zhì)溶液,從宏觀現(xiàn)象的預(yù)測(cè)到微觀本質(zhì)的分析,從定性解釋到定量分析,層層深入,讓學(xué)生逐步構(gòu)建離子反應(yīng)的認(rèn)識(shí)模型,提升學(xué)生“宏微結(jié)合”素養(yǎng),同時(shí)實(shí)施多樣化評(píng)價(jià),為開展認(rèn)識(shí)模型建構(gòu)的課堂教學(xué)提供實(shí)踐參考。
關(guān)鍵詞: 宏微結(jié)合; 核心素養(yǎng); 離子反應(yīng); 認(rèn)識(shí)模型; 高中教學(xué)
文章編號(hào): 10056629(2022)10005005
中圖分類號(hào): G633.8
文獻(xiàn)標(biāo)識(shí)碼: B
1 理論依據(jù)
高中化學(xué)學(xué)科核心素養(yǎng)分為宏觀辨識(shí)與微觀探析(簡(jiǎn)稱“宏微結(jié)合”)、變化觀念與平衡思想、證據(jù)推理與模型認(rèn)知、科學(xué)探究與創(chuàng)新意識(shí)、科學(xué)態(tài)度與社會(huì)責(zé)任五個(gè)維度。為了更好地發(fā)展學(xué)生的核心素養(yǎng),《普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)》(簡(jiǎn)稱“新課標(biāo)”)在課程基本理念中提出,“知道可以通過分析、推理等方法認(rèn)識(shí)研究對(duì)象的本質(zhì)特征、構(gòu)成要素及其相互關(guān)系,建立認(rèn)知模型,并能運(yùn)用模型解釋化學(xué)現(xiàn)象,揭示現(xiàn)象的本質(zhì)和規(guī)律”[1]。“模型認(rèn)知”素養(yǎng)除了關(guān)注科學(xué)模型的建構(gòu)與應(yīng)用外,還強(qiáng)調(diào)科學(xué)思維的過程,要為學(xué)生學(xué)習(xí)化學(xué)知識(shí)、解決化學(xué)問題構(gòu)建相應(yīng)的思維框架,即認(rèn)識(shí)模型的構(gòu)建與應(yīng)用[2]。此類認(rèn)識(shí)模型主要由研究對(duì)象、認(rèn)識(shí)角度、認(rèn)識(shí)方式、化學(xué)問題、任務(wù)類型等要素構(gòu)成,具有將化學(xué)學(xué)習(xí)內(nèi)容從知識(shí)關(guān)聯(lián)的結(jié)構(gòu)化提升到認(rèn)識(shí)思路的結(jié)構(gòu)化的重要價(jià)值[3]。創(chuàng)設(shè)特定的情境,讓學(xué)生在化學(xué)知識(shí)的學(xué)習(xí)和化學(xué)問題的解決中,基于核心概念構(gòu)建認(rèn)識(shí)模型,可促進(jìn)知識(shí)向能力的轉(zhuǎn)化,從而發(fā)展化學(xué)學(xué)科核心素養(yǎng)。
本文以“從具體的知識(shí)傳授到核心觀念的構(gòu)建,從知識(shí)的解析為本到基于學(xué)生認(rèn)識(shí)發(fā)展為本”為指導(dǎo)思想,圍繞離子反應(yīng)核心概念的建構(gòu)、理解和應(yīng)用,形成認(rèn)識(shí)水平的考查指標(biāo)并在教學(xué)過程中進(jìn)行實(shí)時(shí)評(píng)價(jià),將核心概念轉(zhuǎn)化為認(rèn)識(shí)物質(zhì)性質(zhì)的角度和思路。以離子反應(yīng)認(rèn)識(shí)模型的自主建構(gòu)為統(tǒng)領(lǐng),通過從宏觀現(xiàn)象的解釋到微觀本質(zhì)的分析、為微觀分析尋找宏觀證據(jù)等學(xué)習(xí)任務(wù),讓學(xué)生在宏觀與微觀之間不斷切換角度進(jìn)行思考,從而提升“宏微結(jié)合”的化學(xué)學(xué)科核心素養(yǎng)。
2 主題的確立
“電離和離子反應(yīng)”是2019年魯科版高中化學(xué)必修一第二章第2節(jié)的內(nèi)容。新課標(biāo)對(duì)本節(jié)內(nèi)容的要求是“認(rèn)識(shí)酸、堿、鹽等電解質(zhì)在水溶液中或熔融狀態(tài)下能發(fā)生電離。通過實(shí)驗(yàn)事實(shí)認(rèn)識(shí)離子反應(yīng)及其發(fā)生條件。了解常見離子的檢驗(yàn)方法”。
本部分內(nèi)容可以分為3課時(shí)。第1課時(shí)為離子反應(yīng)認(rèn)識(shí)模型的初步建構(gòu)——電解質(zhì)的電離,以“固體氯化鈉溶于水后會(huì)發(fā)生什么”為驅(qū)動(dòng)問題,引導(dǎo)學(xué)生提出猜想、實(shí)驗(yàn)驗(yàn)證,建立起宏觀物質(zhì)與微觀粒子間的關(guān)聯(lián),形成認(rèn)識(shí)單一電解質(zhì)溶液的思路方法,初步形成“宏微結(jié)合”的意識(shí);第2課時(shí)為離子反應(yīng)認(rèn)識(shí)模型的建構(gòu),以“稀H2SO4和Ba(OH)2溶液混合后會(huì)發(fā)生什么”為問題情境,引導(dǎo)學(xué)生分析探究,進(jìn)入微觀視角認(rèn)識(shí)化學(xué)反應(yīng),真正從本質(zhì)上理解離子反應(yīng)的實(shí)質(zhì),從而突破學(xué)生書寫離子方程式的難點(diǎn),形成多種電解質(zhì)溶液性質(zhì)及變化分析的思路方法,自主建構(gòu)離子反應(yīng)的認(rèn)識(shí)模型,發(fā)展學(xué)生“宏微結(jié)合”核心素養(yǎng);第3課時(shí)為離子反應(yīng)認(rèn)識(shí)模型的應(yīng)用,以“如何用化學(xué)沉淀法除去粗鹽中的雜質(zhì)離子”為問題情境,引導(dǎo)學(xué)生分析思考,設(shè)計(jì)實(shí)驗(yàn)方案,再實(shí)驗(yàn)驗(yàn)證,在真實(shí)的實(shí)驗(yàn)情境中應(yīng)用離子反應(yīng)認(rèn)識(shí)模型解決物質(zhì)的除雜問題,體現(xiàn)離子反應(yīng)認(rèn)識(shí)模型的功能價(jià)值,進(jìn)一步提升學(xué)生“宏微結(jié)合”的核心素養(yǎng)。
建構(gòu)認(rèn)識(shí)模型是一個(gè)動(dòng)態(tài)、復(fù)雜的過程,需要以具體的化學(xué)知識(shí)為基礎(chǔ),在化學(xué)問題的解決過程中,逐步形成對(duì)認(rèn)識(shí)對(duì)象結(jié)構(gòu)化的認(rèn)識(shí),從而形成相應(yīng)的思維框架。本部分第1課時(shí)形成認(rèn)識(shí)單一電解質(zhì)溶液的思路方法,初步建構(gòu)離子反應(yīng)的認(rèn)識(shí)模型;第2課時(shí)形成認(rèn)識(shí)多種電解質(zhì)溶液的思路方法,真正建構(gòu)離子反應(yīng)的認(rèn)識(shí)模型;第3課時(shí)實(shí)際應(yīng)用離子反應(yīng)的認(rèn)識(shí)模型,完成對(duì)陌生情境復(fù)雜問題的解決。三課時(shí)有序推進(jìn),有利于學(xué)生逐步建構(gòu)和應(yīng)用離子反應(yīng)認(rèn)識(shí)模型。本文具體以第2課時(shí)建構(gòu)離子反應(yīng)的認(rèn)識(shí)模型為例,從教學(xué)目標(biāo)、評(píng)價(jià)思路、實(shí)踐過程以及教學(xué)反思等方面進(jìn)行詳細(xì)闡述,為建構(gòu)認(rèn)識(shí)模型的課堂教學(xué)提供實(shí)踐參考。
3 教學(xué)目標(biāo)與評(píng)價(jià)思路
3.1 教學(xué)目標(biāo)
(1) 通過對(duì)Ba(OH)2溶液和稀H2SO4溶液的再次認(rèn)識(shí),鞏固認(rèn)識(shí)單一電解質(zhì)溶液的思路方法。
(2) 通過Ba(OH)2溶液和稀H2SO4溶液的實(shí)驗(yàn)探究,形成認(rèn)識(shí)多種電解質(zhì)溶液的思路方法,建立離子反應(yīng)的認(rèn)識(shí)模型。
(3) 通過分析描述NaOH溶液滴加到CuCl2溶液中的微粒變化,初步應(yīng)用離子反應(yīng)的認(rèn)識(shí)模型。
3.2 評(píng)價(jià)目標(biāo)
(1) 通過學(xué)生對(duì)Ba(OH)2溶液和稀H2SO4溶液的再次認(rèn)識(shí),診斷并發(fā)展學(xué)生從微觀角度認(rèn)識(shí)物質(zhì)的水平,鞏固并提升認(rèn)識(shí)單一電解質(zhì)在水溶液中行為的思路方法。
(2) 通過Ba(OH)2溶液和稀H2SO4溶液的實(shí)驗(yàn)現(xiàn)象預(yù)測(cè)和分析解釋,診斷并提升學(xué)生根據(jù)宏觀現(xiàn)象預(yù)測(cè)微觀本質(zhì)以及根據(jù)微觀本質(zhì)解釋宏觀現(xiàn)象的能力;通過電導(dǎo)率變化趨勢(shì)圖的繪制,診斷并發(fā)展學(xué)生認(rèn)識(shí)多種電解質(zhì)在水溶液中行為的思路方法。
(3) 通過分析NaOH溶液滴加到CuCl2溶液的微粒變化及離子方程式的書寫,診斷并發(fā)展學(xué)生對(duì)離子反應(yīng)認(rèn)識(shí)模型的應(yīng)用水平。
3.3 評(píng)價(jià)思路
基于“教、學(xué)、評(píng)”一體化理念,以核心素養(yǎng)為導(dǎo)向,確定“離子反應(yīng)”的教學(xué)和評(píng)價(jià)思路如圖1所示。
4 教學(xué)實(shí)踐過程
4.1 診斷已知,探查起點(diǎn)
[學(xué)習(xí)任務(wù)1]Ba(OH)2溶液和稀H2SO4溶液的再次認(rèn)識(shí)。請(qǐng)將你的認(rèn)識(shí)記錄在學(xué)案上。
學(xué)生自主思考,在學(xué)案中記錄相應(yīng)的認(rèn)識(shí)想法,并闡述自己的觀點(diǎn),學(xué)生和學(xué)生相互交流評(píng)價(jià),達(dá)成共識(shí)。Ba(OH)2屬于易溶于水的堿,在水溶液中會(huì)電離出Ba2+和OH-,且兩者數(shù)量之比為1∶2,同時(shí)溶液中還存在水分子。H2SO4屬于易溶于水的酸,在水溶液中會(huì)電離出SO2-4和H+,且兩者數(shù)量之比為1∶2,同時(shí)溶液中還存在水分子。
[評(píng)價(jià)任務(wù)1]診斷學(xué)生是否具有微觀的視角認(rèn)識(shí)物質(zhì),是否掌握單一電解質(zhì)在水溶液中的行為,為后續(xù)離子反應(yīng)奠定基礎(chǔ)。以下是教學(xué)實(shí)踐過程中,不同水平學(xué)生的表現(xiàn)。
水平1:認(rèn)為Ba(OH)2溶液中存在Ba(OH)2;H2SO4溶液中存在H2SO4。
水平2:認(rèn)為Ba(OH)2溶液中存在Ba2+和OH-;H2SO4溶液中存在H+和SO2-4。
水平3:認(rèn)為Ba(OH)2溶液中存在Ba2+和OH-;H2SO4溶液中存在H+和SO2-4,并可指出離子的數(shù)量關(guān)系,且還能關(guān)注水分子。
4.2 創(chuàng)設(shè)情境,構(gòu)建模型
[學(xué)習(xí)任務(wù)2]在2~3mL滴有2~3滴酚酞的Ba(OH)2溶液中滴加過量稀H2SO4會(huì)發(fā)生什么?請(qǐng)預(yù)測(cè)實(shí)驗(yàn)現(xiàn)象,并進(jìn)行分析解釋。
學(xué)生先自主思考,然后小組內(nèi)交流討論,小組代表表述相應(yīng)的觀點(diǎn),各小組通過交流評(píng)價(jià),達(dá)成一致的意見。然后學(xué)生分組實(shí)驗(yàn),驗(yàn)證預(yù)測(cè)的實(shí)驗(yàn)現(xiàn)象,教師再進(jìn)行精煉總結(jié)。
(1) 現(xiàn)象:酚酞變紅。
解釋:Ba(OH)2屬于易溶于水的堿,在水溶液中會(huì)電離出OH-,因此加酚酞后會(huì)變紅。
(2) 現(xiàn)象:酚酞變紅后褪色。
解釋:H2SO4屬于易溶于水的酸,在水溶液中會(huì)電離出H+,隨著稀H2SO4的加入,H+與OH-結(jié)合生成H2O, OH-濃度不斷減小,酚酞褪色。
(3) 現(xiàn)象:生成白色沉淀。
解釋:Ba(OH)2屬于易溶于水的堿,在水溶液中會(huì)電離出Ba2+, H2SO4屬于易溶于水的酸,在水溶液中會(huì)電離生SO2-4,隨著稀H2SO4的加入,Ba2+與SO2-4結(jié)合生成BaSO4白色沉淀。
[評(píng)價(jià)任務(wù)2]診斷學(xué)生能否根據(jù)宏觀現(xiàn)象預(yù)測(cè)微觀本質(zhì),根據(jù)微觀本質(zhì)解釋宏觀現(xiàn)象,初步感受溶液中離子變化與離子反應(yīng)。通過實(shí)驗(yàn)探究,讓學(xué)生真實(shí)感受離子反應(yīng)的發(fā)生,理解粒子間的相互作用。以下是實(shí)驗(yàn)現(xiàn)象解釋的教學(xué)實(shí)踐過程中,不同水平學(xué)生的表現(xiàn)。
水平1:Ba2+與SO2-4反應(yīng)生成BaSO4白色沉淀,發(fā)生酸堿中和反應(yīng),酚酞變紅后褪色。
水平2:Ba2+與SO2-4反應(yīng)生成BaSO4白色沉淀,OH-與H+發(fā)生反應(yīng),酚酞變紅后褪色。
水平3:Ba2+與SO2-4反應(yīng)生成BaSO4白色沉淀,酚酞遇OH-變紅,硫酸中有H+, OH-與H+反應(yīng),OH-濃度減小,酚酞變紅后褪色。
[學(xué)習(xí)任務(wù)3]請(qǐng)預(yù)測(cè)并在學(xué)案上畫出向Ba(OH)2溶液中滴加過量稀硫酸的過程中溶液的導(dǎo)電性變化趨勢(shì)圖。
學(xué)生自主思考后,小組內(nèi)交流討論,小組代表表述相應(yīng)的觀點(diǎn),小組間相互評(píng)價(jià),達(dá)成共識(shí)。隨著過量稀硫酸的滴加,溶液的導(dǎo)電性由強(qiáng)變?nèi)酰僮儚?qiáng),隨后教師用微型溶液導(dǎo)電器做導(dǎo)電性演示實(shí)驗(yàn),結(jié)果如圖2所示,驗(yàn)證學(xué)生的預(yù)測(cè)。
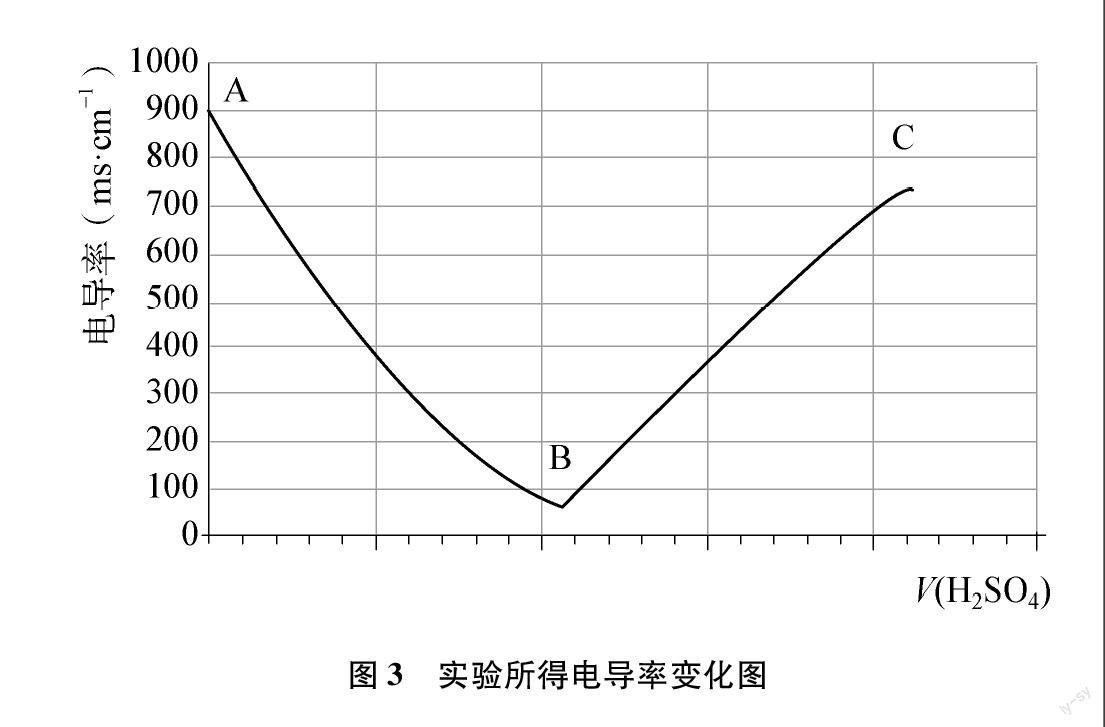
通過以上實(shí)驗(yàn)來比較導(dǎo)電性強(qiáng)弱還是較粗糙的,科學(xué)家們找到一個(gè)更精確的、可定量表示溶液中離子濃度大小的物理量——電導(dǎo)率。電導(dǎo)率的數(shù)值越高,表示溶液中的離子濃度越大。實(shí)驗(yàn)測(cè)出電導(dǎo)率的變化圖如圖3所示,讓學(xué)生再次解釋說明向Ba(OH)2溶液中滴加過量稀硫酸過程中混合溶液的電導(dǎo)率變化情況。
學(xué)生通過自主梳理和完善,再次解釋說明電導(dǎo)率的變化趨勢(shì),然后由教師通過整理剛才的實(shí)驗(yàn)探究過程,形成離子反應(yīng)及離子方程式的概念,歸納總結(jié)認(rèn)識(shí)多種電解質(zhì)水溶液的思路方法,建構(gòu)離子反應(yīng)的認(rèn)識(shí)模型(如圖4所示)。
[評(píng)價(jià)任務(wù)3]通過電導(dǎo)率變化趨勢(shì)圖的繪制,診斷學(xué)生對(duì)多種電解質(zhì)在水溶液中行為的掌握情況;通過電導(dǎo)率變化趨勢(shì)圖的再次解釋說明,進(jìn)一步鞏固分析離子反應(yīng)的角度和思路方法,形成離子反應(yīng)的核心概念,構(gòu)建離子反應(yīng)的認(rèn)識(shí)模型。以下是電導(dǎo)率變化趨勢(shì)圖的繪制教學(xué)實(shí)踐過程中不同水平學(xué)生的表現(xiàn)。
水平1:滴加稀硫酸后,離子數(shù)目增加,導(dǎo)電性變強(qiáng)。學(xué)生繪制圖如圖5所示。
水平2:滴加稀硫酸后,發(fā)生離子反應(yīng),離子濃度降低,導(dǎo)電性變?nèi)酢W(xué)生繪制圖如圖6所示。
水平3:滴加稀硫酸后,發(fā)生離子反應(yīng),離子濃度降低,導(dǎo)電性先變?nèi)酰捎诘渭拥氖沁^量的稀硫酸,所以后續(xù)離子濃度增加,導(dǎo)電性又變強(qiáng)。學(xué)生繪制圖如圖7所示。
4.3 應(yīng)用模型,解決問題
[學(xué)習(xí)任務(wù)4]分析NaOH溶液滴加到CuCl2溶液中的微粒變化,并寫出相應(yīng)的離子方程式。
學(xué)生自主思考后,交流討論,通過相互評(píng)價(jià),達(dá)成共識(shí),并應(yīng)用構(gòu)建的離子反應(yīng)認(rèn)識(shí)模型解決陌生情境下的離子反應(yīng)。然后教師歸納總結(jié)離子反應(yīng)發(fā)生的條件及本質(zhì)。宏觀上需要生成氣體、沉淀和水,微觀上是某些離子的濃度下降。
[評(píng)價(jià)任務(wù)4]診斷學(xué)生能否應(yīng)用構(gòu)建的認(rèn)識(shí)模型,解決兩種電解質(zhì)溶液在水溶液中的行為,體會(huì)認(rèn)識(shí)模型的應(yīng)用價(jià)值,歸納離子反應(yīng)發(fā)生的條件及本質(zhì)。以下是教學(xué)實(shí)踐過程中,不同水平學(xué)生的表現(xiàn)。
水平1:Na++OH-+Cu2++2Cl-Cu(OH)2↓+NaCl
水平2:2Na++2OH-+Cu2++2Cl-Cu(OH)2↓+2Na++2Cl-
水平3:2OH-+Cu2+Cu(OH)2↓
5 教學(xué)反思
“離子反應(yīng)”是高中化學(xué)必修課程中的核心概念,是高中階段水溶液的認(rèn)識(shí)起點(diǎn),也是發(fā)展學(xué)生從微觀角度認(rèn)識(shí)物質(zhì)性質(zhì),使學(xué)生認(rèn)識(shí)方式從宏觀發(fā)展到微觀,并向“宏微結(jié)合”轉(zhuǎn)變的重要環(huán)節(jié)。本文旨在離子反應(yīng)認(rèn)識(shí)模型的構(gòu)建過程中發(fā)展學(xué)生“宏微結(jié)合”的化學(xué)學(xué)科核心素養(yǎng)。
5.1 創(chuàng)設(shè)實(shí)驗(yàn)情境,引發(fā)認(rèn)知沖突
以“探究稀H2SO4和Ba(OH)2溶液混合后發(fā)生的變化”創(chuàng)設(shè)實(shí)驗(yàn)情境,引發(fā)學(xué)生的認(rèn)知沖突,激發(fā)學(xué)生想要解決問題的欲望。情境的創(chuàng)設(shè)是建立在充分診斷學(xué)生前認(rèn)識(shí)的基礎(chǔ)上,通過學(xué)習(xí)任務(wù)1診斷學(xué)生的已有認(rèn)識(shí),鞏固單一電解質(zhì)在水溶液中行為的認(rèn)知,然后結(jié)合學(xué)生的最近發(fā)展區(qū),提出有效的問題情境。
5.2 自主實(shí)驗(yàn)探究,建立認(rèn)識(shí)模型
學(xué)生自主實(shí)驗(yàn)探究,建立認(rèn)識(shí)模型是本節(jié)課的核心環(huán)節(jié),構(gòu)建認(rèn)識(shí)模型有利于學(xué)生學(xué)習(xí)抽象的化學(xué)概念,理解化學(xué)現(xiàn)象的本質(zhì),發(fā)展思維能力[4]。在教學(xué)過程中,教師要充分考慮學(xué)生的實(shí)際水平,圍繞核心認(rèn)知提出驅(qū)動(dòng)性問題,引導(dǎo)學(xué)生自主探究。有效的驅(qū)動(dòng)性問題的提出,需要教師在備課過程中充分了解學(xué)生的水平,在教學(xué)過程中做到心中有數(shù)。核心問題的提出一定要在教學(xué)過程中追問到核心認(rèn)知,如“酚酞變紅后褪色”的解釋說明環(huán)節(jié),學(xué)生只回答到酸堿中和是不到位的,教師一定要追問到微粒的角度和數(shù)量的變化,才能真正讓學(xué)生在學(xué)習(xí)任務(wù)中落實(shí)核心認(rèn)知。
5.3 實(shí)施多樣化評(píng)價(jià),教學(xué)評(píng)一體化
“新課標(biāo)”提出樹立素養(yǎng)為本的化學(xué)學(xué)習(xí)評(píng)價(jià)觀,實(shí)施“教、學(xué)、評(píng)”一體化教學(xué),多樣化的教學(xué)評(píng)價(jià)需要貫穿整個(gè)教學(xué)活動(dòng)的始終。如學(xué)習(xí)任務(wù)1“Ba(OH)2溶液和稀H2SO4溶液的再次認(rèn)識(shí)”是對(duì)學(xué)生已知的探查,通過學(xué)生的自主思考、相互評(píng)價(jià),鞏固單一電解質(zhì)在水溶液中行為的認(rèn)知;學(xué)習(xí)任務(wù)4“NaOH溶液滴加到CuCl2溶液中微粒變化的分析”是對(duì)學(xué)生新認(rèn)知的診斷,評(píng)價(jià)學(xué)生是否能應(yīng)用離子反應(yīng)的認(rèn)識(shí)模型來解決實(shí)際問題。教學(xué)過程中,教師通過觀察、提問、點(diǎn)評(píng)等方式進(jìn)行表現(xiàn)性評(píng)價(jià)和過程性評(píng)價(jià),同時(shí)引導(dǎo)學(xué)生開展自我評(píng)價(jià)、小組互評(píng)等。教學(xué)結(jié)束后,可組織學(xué)生訪談、結(jié)合紙筆測(cè)試等診斷評(píng)價(jià)學(xué)生的水平,以此促進(jìn)學(xué)生的批判性思維以及自我評(píng)價(jià)、反思能力的不斷提高。
參考文獻(xiàn):
[1]中華人民共和國(guó)教育部制定.普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)[S]. 北京: 人民教育出版社, 2018: 3~4.
[2]解宏偉, 王秀紅, 于志民, 曹宇. 基于認(rèn)識(shí)模型建構(gòu)與應(yīng)用的化學(xué)教學(xué)設(shè)計(jì)——“水溶液中的離子反應(yīng)與離子平衡”一輪復(fù)習(xí)課[J]. 化學(xué)教育(中英文), 2022, 43(3): 37~44.
[3]王婉洋, 王磊, 于少華, 康永明, 白光耀, 陳娜, 范洪玲. 元素周期律復(fù)習(xí)教學(xué)中認(rèn)識(shí)模型建構(gòu)的有效策略[J]. 化學(xué)教育(中英文), 2018, 39(7): 18~26.
[4]張禮聰. 促進(jìn)“模型認(rèn)知”的化學(xué)教學(xué)——以“化學(xué)反應(yīng)中的熱量變化”為例[J]. 化學(xué)教與學(xué), 2019,(11): 30~32.

