菟絲子飲片、水煎液和配方顆粒的HPLC 指紋圖譜相關性研究
姚曉璇,王瑜婷,邱彩月,何榮榮,陳銘恩,黎桃敏,劉燎原
(廣東一方制藥有限公司/廣東省中藥配方顆粒企業重點實驗室,廣東佛山528244)
菟絲子為旋花科植物南方菟絲子Cuscuta australisR.Br.或菟絲子Cuscuta chinensisLam.的干燥成熟種子。始載于《神農本草經》,被列為上品。菟絲子性平,味辛、甘,具有補益肝腎、固精縮尿、安胎明目的功效[1?2]。現代研究表明,菟絲子主要包括黃酮類、有機酸、多糖、木脂素類、氨基酸和生物堿等成分,其主要藥理作用有保肝、抗骨質疏松、調節免疫、抗氧化、腫瘤、增強內分泌系統功能、抑制黑色素合成等[3?4],具有良好的藥用價值。
中藥配方顆粒是以中藥飲片為原料,經水提、濃縮、干燥、制粒而成的可供中醫臨床調配使用的顆粒制劑[5],中藥配方顆粒是中藥湯劑的一種現代劑改形式,是中藥飲片的一種補充。中藥配方顆粒與中藥湯劑之間的差異來源于湯液濃縮、干燥過程中相關成分的物理遺失與化學變化[6]。目前,有關菟絲子藥材的化學成分測定和指紋圖譜研究較多[7?9],尚無對菟絲子及其制劑產品相關性研究的報道。本研究分別建立了菟絲子飲片、水煎液、配方顆粒的HPLC指紋圖譜,比較3者之間HPLC指紋圖譜的相關性和差異性,探討菟絲子配方顆粒制備過程中的化學成分轉化,確保顆粒劑與湯劑質量的一致性,以期為菟絲子配方顆粒的質量控制和臨床安全有效用藥提供參考。
1 儀器與試藥
1.1 儀器
Waters Arc 型高效液相色譜儀(美國Waters 公司);XP26 型百萬分之一天平、ME204E 型萬分之一天平(瑞士METTLER TOLEDO 公司);Milli?Q Direct 型超純水系統(德國Merck 公司);SODA?12型噴霧干燥機(上海大川原干燥設備有限公司);LGS20 型干法制粒機(南京迦南科技有限公司);YRE?501 型旋轉蒸發儀(鞏義市予華儀器有限責任公司);DLSB?5/20 型低溫冷卻液循環水泵(鄭州長城科工貿有限公司);KQ?500DE 型數控超聲波清洗器(昆山市超聲儀器有限公司)。
1.2 試藥
綠原酸(批號:110753?202018,純度96.1%)、金絲桃苷(批號:111521?201809,純度94.9%)、異槲皮苷(批號:111809?201804,純度97.2%)對照品均購自中國食品藥品檢定研究院;隱綠原酸(批號:DST210427?035,純度98.24%)對照品購自成都樂美天醫藥科技有限公司;乙腈、甲醇為色譜純(德國Merck 公司),磷酸為色譜純(天津市科密歐化學試劑有限公司),水為超純水,其余試劑均為分析純。
16 批菟絲子藥材(樣品編號為S1-S16)經廣東一方制藥有限公司魏梅主任藥師鑒定為正品,均為南方菟絲子Cuscuta australisR. Br.的干燥成熟種子,藥材產地信息見表1。16批菟絲子飲片(樣品編號為Y1-Y16)嚴格按照2020 年版《中國藥典》一部菟絲子項下飲片炮制規定進行炮制[1];16 批菟絲子水煎液(樣品編號為T1-T16)嚴格按照《醫療機構中藥煎藥室管理規范》相關要求進行煎煮[10],取每批菟絲子的提取液,減壓濃縮,定容至100 mL,得樣品水煎液;16批菟絲子配方顆粒(樣品編號為P1-P16)由水煎液經濃縮、干燥、制粒等步驟得到。
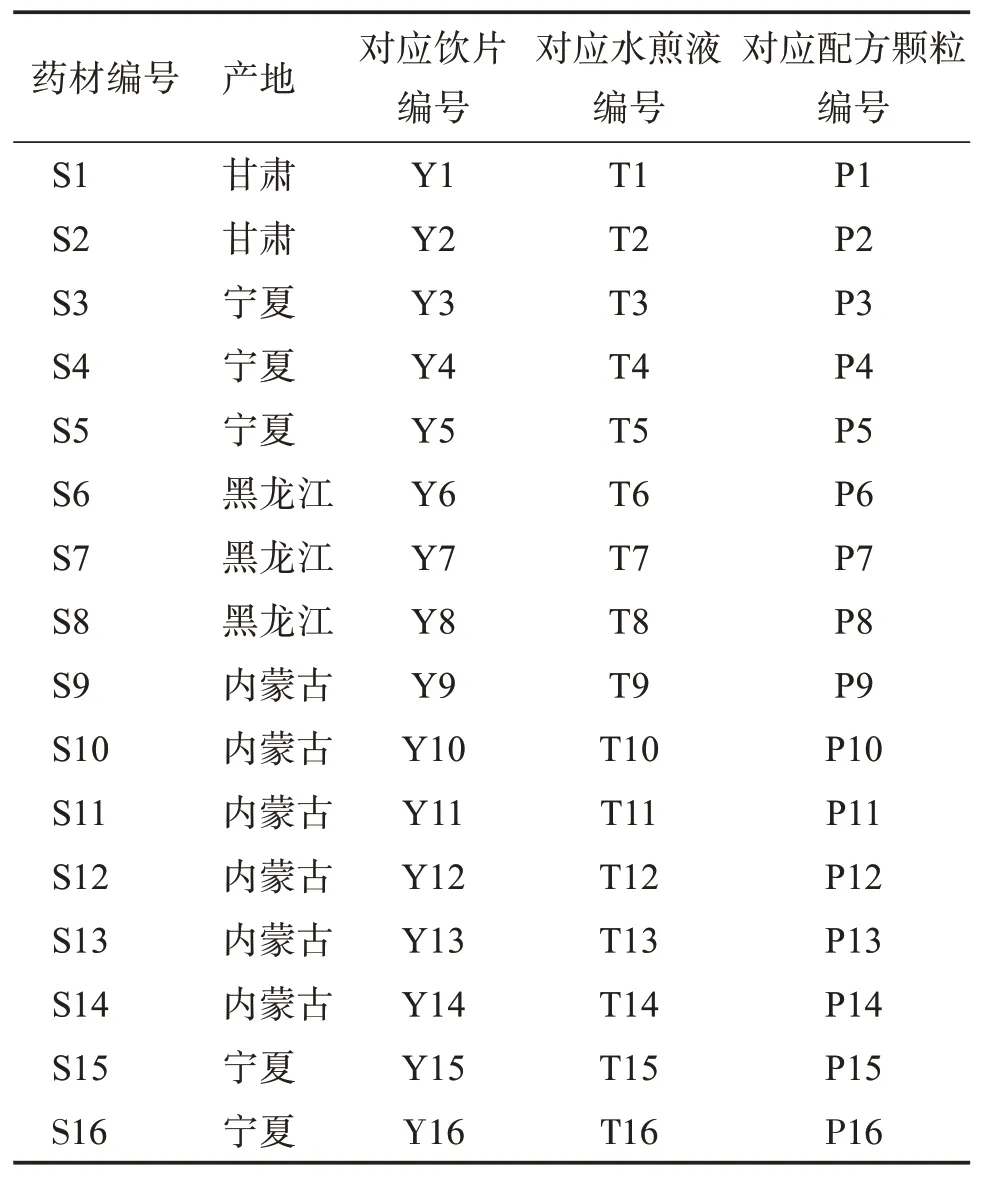
表1 16批菟絲子藥材的來源信息Table 1 Source information of 16 batches of Cuscutae Semen
2 方法與結果
2.1 色譜條件[11]
色譜柱:Xselect HSS T3(250 mm × 4.6 mm,5 μm);流動相:乙腈(A)?0.1%磷酸溶液(B)梯度洗脫(0~30 min,7%~12%A;30~35 min,12%~15%A;35~55 min,15%A;55~80 min,15%~30%A;80~85 min,30%~93%A;85~90 min,93%A);流速:1.0 mL/min;柱溫:30 ℃;檢測波長:360 nm;進樣量:5 μL。
2.2 對照品溶液的制備
分別取綠原酸、隱綠原酸、金絲桃苷、異槲皮苷對照品適量,精密稱定,加甲醇制成質量濃度分別為78.42、62.20、58.27、56.86 μg/mL 的混合對照品溶液。
2.3 供試品溶液的制備
2.3.1 菟絲子飲片供試品溶液取菟絲子飲片粉末(過四號篩)約1.0 g,精密稱定,置具塞錐形瓶中,精密加入70%(體積分數,下同)甲醇50 mL,稱定質量,加熱回流30 min,取出,放冷,再稱定質量,用70%甲醇補足減失的質量,搖勻,濾過,取續濾液,即得飲片供試品溶液。
2.3.2 菟絲子水煎液供試品溶液精密吸取混合均勻的菟絲子水煎液10 mL,置50 mL 量瓶中,加水5 mL,加甲醇定容至刻度,稱定質量,超聲處理(300 W,45 kHz)30 min,取出,放冷,再稱定質量,用70%甲醇補足減失的質量,搖勻,濾過,取續濾液,即得水煎液供試品溶液。
2.3.2 菟絲子配方顆粒供試品溶液取菟絲子配方顆粒適量,研細,取約0.2 g,精密稱定,置具塞錐形瓶中,精密加入70%甲醇25 mL,稱定質量,超聲處理(300 W,45 kHz)30 min,取出,放冷,再稱定質量,用70%甲醇補足減失的質量,搖勻,濾過,取續濾液,即得配方顆粒供試品溶液。
2.4 方法學考察
2.4.1 專屬性試驗分別精密吸取空白溶劑、對照品溶液及供試品溶液,按“2.1”項色譜條件進樣測定,結果見圖1。可見,供試品溶液色譜在與對照品溶液色譜相應的保留時間處具有相同的色譜峰,且空白溶劑無干擾,表明方法專屬性良好。

圖1 專屬性試驗HPLC色譜圖Figure 1 The HPLC chromatograms of specific test
2.4.2 精密度試驗精密吸取“2.2”項對照品溶液,按“2.1”項色譜條件連續進樣6 次,以5 號峰金絲桃苷為參照峰,計算得各共有峰相對保留時間和相對峰面積的RSD 范圍分別為0.15%~0.22%和0.23%~0.64%,表明儀器精密度良好。
2.4.3 穩定性試驗取菟絲子飲片(編號Y16),精密稱定,按“2.3.1”項方法制備供試品溶液,分別于制備0、4、8、12、24、48 h 后按“2.1”項色譜條件進樣測定,以5號峰金絲桃苷為參照峰,計算得各特征峰相對保留時間和相對峰面積的RSD 范圍分別為0.16%~1.21%和1.32%~2.57%,表明菟絲子飲片供試品溶液在48 h內穩定性良好。
2.4.4 重復性試驗取菟絲子飲片(編號Y16)6 份,精密稱定,按“2.3.1”項方法制備供試品溶液,按“2.1”項色譜條件進樣測定。以5 號峰金絲桃苷為參照峰,計算得各特征峰相對保留時間和相對峰面積的RSD 范圍分別為0.10%~0.12% 和0.13%~2.20%,表明方法重復性良好。
2.5 HPLC指紋圖譜的建立與相似度評價
2.5.1 指紋圖譜的建立分別取16 批菟絲子飲片、水煎液和配方顆粒,按“2.3”項方法分別制備供試品溶液,按“2.1”項色譜條件進樣測定,記錄色譜圖。采用國家藥典委員會頒布的“中藥色譜指紋圖譜相似度評價系統2012 版”對色譜圖進行匹配,確定菟絲子飲片、水煎液、配方顆粒均有8 個共有峰,如圖2-4 所示。通過與對照品圖譜對比,確定1 號峰為綠原酸,2 號峰為隱綠原酸,5 號峰為金絲桃苷,6號峰為異槲皮苷。
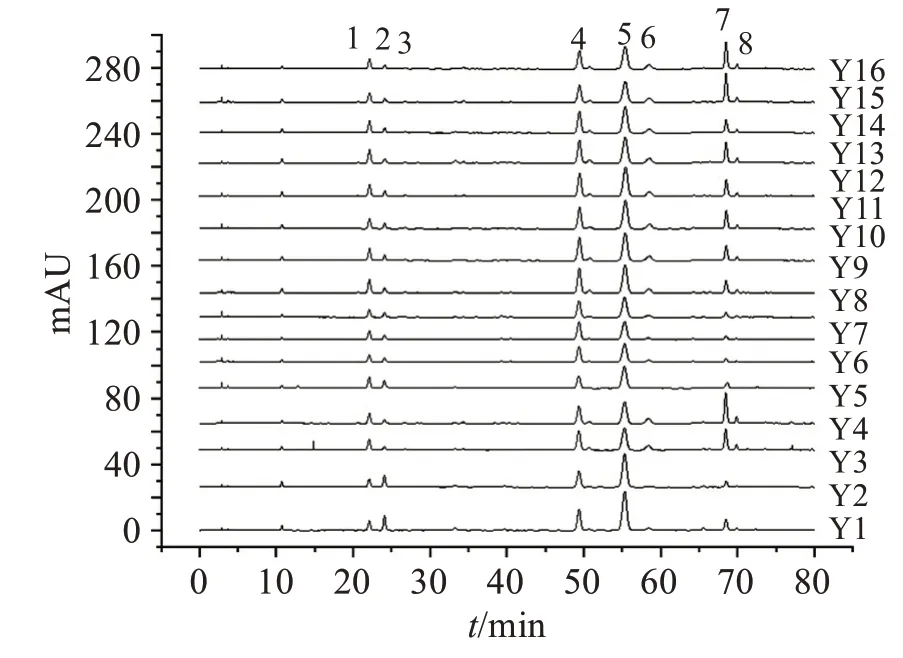
圖2 16批菟絲子飲片的HPLC指紋圖譜疊加圖Figure 2 The HPLC fingerprints of 16 batches of Cuscutae Semen pieces
2.5.2 相似度評價分別將16 批菟絲子飲片、水煎液、配方顆粒HPLC指紋圖譜導入“中藥色譜指紋圖譜相似度評價系統2012 版”軟件,分別計算各批次菟絲子飲片、水煎液、配方顆粒HPLC指紋圖譜與其對照圖譜的相似度,結果見表2。可見,16批菟絲子飲片、水煎液、配方顆粒HPLC指紋圖譜與其相應對照指紋圖譜(R1、R2、R3)的相似度均大于0.900,表明不同批次菟絲子飲片、水煎液、配方顆粒的質量較為穩定。
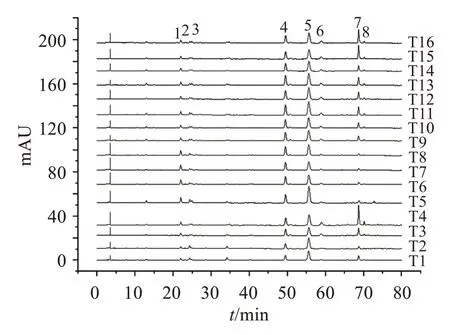
圖3 16批菟絲子水煎液的HPLC指紋圖譜疊加圖Figure 3 The HPLC fingerprints of 16 batches of Cuscutae Semen water decoction
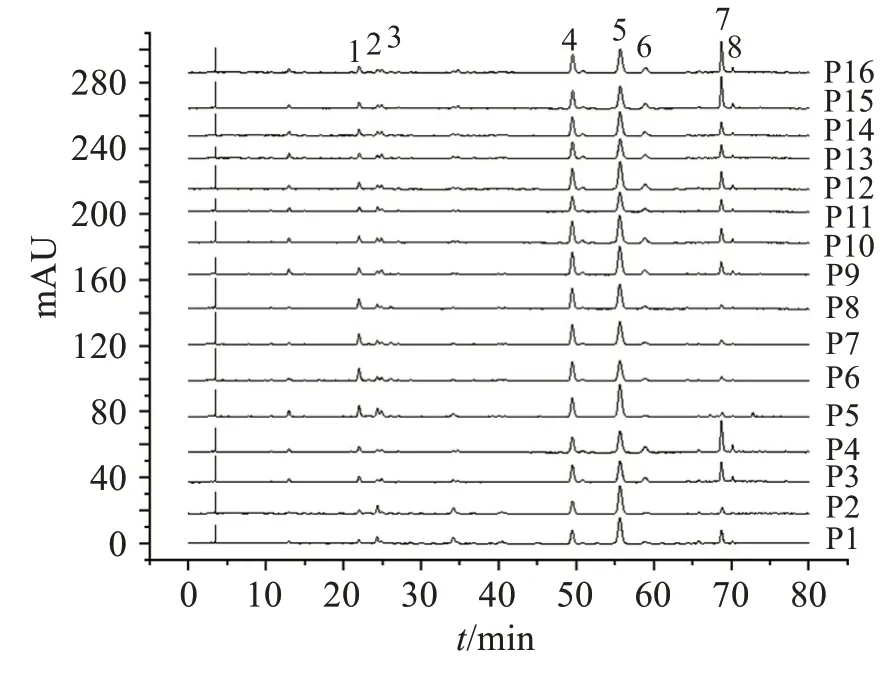
圖4 16批菟絲子配方顆粒的HPLC指紋圖譜疊加圖Figure 4 The HPLC fingerprints of 16 batches of Cuscutae Semen formula granules
2.5.3 對照指紋圖譜的比較分別將16批菟絲子飲片、水煎液和配方顆粒指紋圖譜生成的對照指紋圖譜R1、R2 和R3(見圖5)導入“中藥色譜指紋圖譜相似度評價系統2012版”軟件,結果顯示:與菟絲子飲片比較,菟絲子水煎液和配方顆粒的相似度分別為0.998 和0.997,菟絲子水煎液和配方顆粒指紋圖譜相似度為1.000,表明菟絲子飲片、水煎液與配方顆粒成分基本一致,菟絲子水煎液在提取、濃縮、干燥、制粒過程中,其成分種類無明顯變化。

表2 16 批菟絲子飲片、水煎液和配方顆粒HPLC 指紋圖譜相似度評價結果Table 2 Results of similarity analysis of 16 batches of Cuscu?tae Semen pieces,water decoction,formula granules
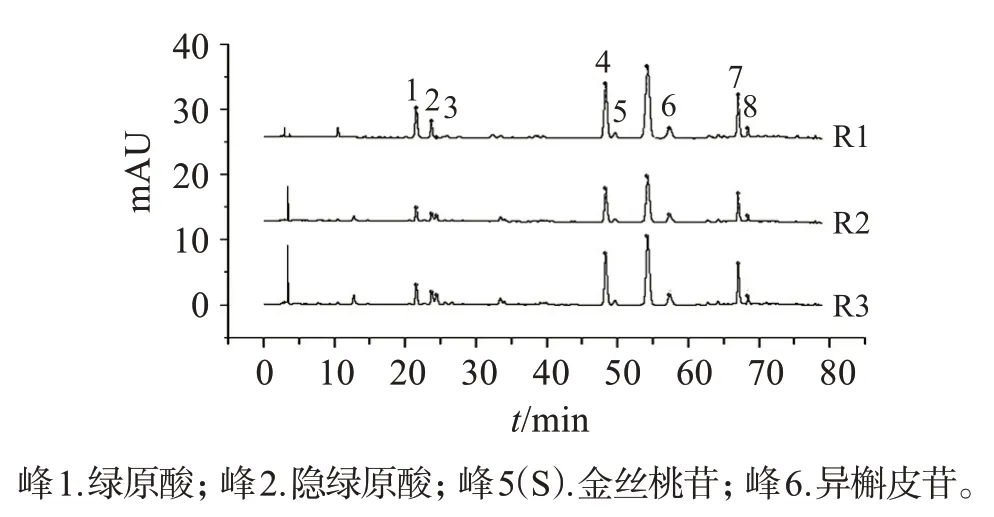
圖5 菟絲子飲片對照指紋圖譜(R1)、水煎液對照指紋圖譜(R2)和配方顆粒對照指紋圖譜(R3)Figure 5 Reference fingerprints of Cuscutae Semen pieces,water decoction,formula granules by HPLC
2.6 化學模式識別研究
2.6.1 共有峰相關性分析采用SPSS 26.0 軟件,以16批菟絲子飲片、水煎液和配方顆粒共48個樣品各特征峰的“峰面積占比”值(各特征峰峰面積占特征峰總面積的比例)為變量進行皮爾遜相關性分析,結果見表3。可見,菟絲子飲片與水煎液或配方顆粒比較,除色譜峰峰3 外,菟絲子飲片、水煎液及其配方顆粒的7 個共有峰均具有顯著的正相關性;菟絲子水煎液與配方顆粒比較,8 個峰均具有極顯著的正相關性。
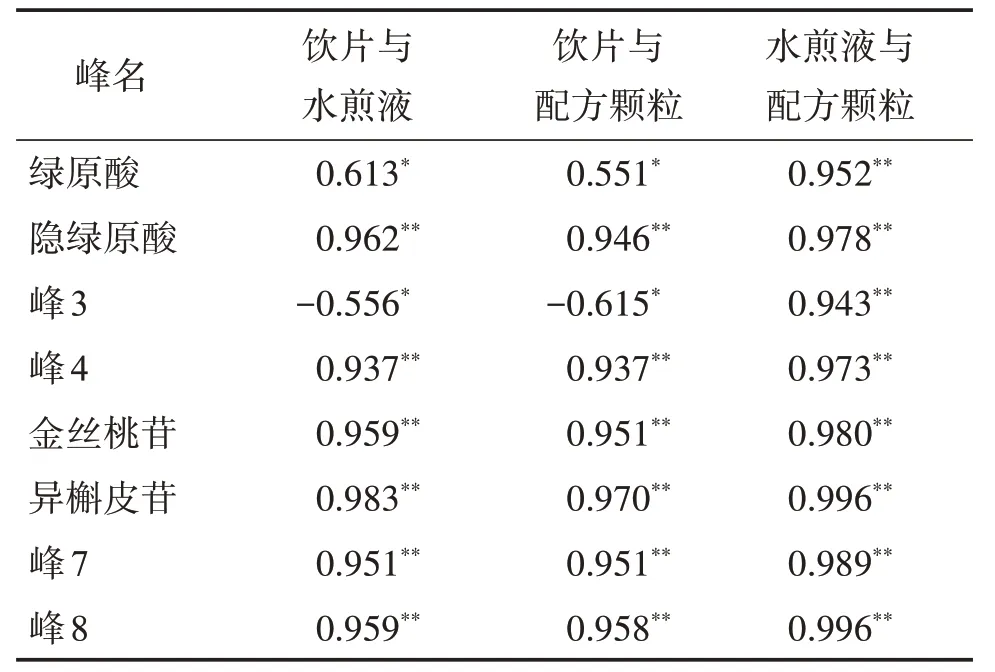
表3 16批菟絲子飲片、水煎液、配方顆粒指紋圖譜共有峰的相關性分析結果Table 3 Correlation analysis results of common peaks of Cuscu?tae Semen pieces,water decoction and formula granules
2.6.2 聚類分析采用SPSS 26.0 軟件,以16 批菟絲子飲片、水煎液和配方顆粒共48個樣品各特征峰面積為變量進行聚類分析[12],結果見圖6。可見,當距離為10 時,48 批樣品可以分為4 類,Y6-Y8、T1-T16、P1-P4、P6-P16 聚為一類,Y3-Y4、Y9-Y16 聚為一類,Y2、Y5、P5 聚為一類,Y1 單獨聚為一類。表明甘肅與黑龍江產地與其他2個產地的菟絲子飲片存在差異,菟絲子水煎液與配方顆粒之間無明顯差異,可聚為一類。
2.6.3 主成分分析(PCA) 采用SPSS 26.0 軟件,對16批菟絲子飲片、水煎液和配方顆粒共48個樣品各特征峰面積的標準化值(Xi)進行主成分分析,主成分結果以特征值>1 為標準提取得到2 個主成分,計算得特征值和方差貢獻率見表4,主成分因子載荷矩陣見表5。由結果可知,前2個主成分累積貢獻率為78.80%,表明提取的2 個主成分能反映菟絲子指紋圖譜的大部分信息。主成分1 的特征值為3.958,方差貢獻率為49.48%,載荷較高的峰有綠原酸、峰4、金絲桃苷、異槲皮苷、峰7 和峰8,表明這6 個峰主要反映主成分1的信息;主成分2的特征值為2.345,方差貢獻率為29.32%,載荷較高的峰有隱綠原酸、峰3,表明這2個峰主要反映主成分2的信息。


表4 菟絲子飲片、水煎液和配方顆粒主成分分析特征值及方差貢獻率Table 4 Characteristic value and variance contribution rate of Cuscutae Semen pieces,water decoction,formula granules

表5 菟絲子飲片、水煎液和配方顆粒主成分因子載荷矩陣Table 5 Factors loading matrix of Cuscutae Semen pieces,water decoction,formula granules

圖7 菟絲子飲片、水煎液和配方顆粒HPLC 指紋圖譜主成分得分圖Figure 7 PCA Score plot of principal component analysis of Cuscutae Semen pieces,water decoction,formula granules
2.6.4 正交偏最小二乘判別分析(OPLS?DA) 采用SIMCA 14.1 軟件,以16 批菟絲子飲片、水煎液和配方顆粒共48 個樣品各特征峰峰面積為變量進行OPLS?DA 分析,結果見圖8-9。由模型參數可知,數據矩陣的解釋率參數R2X(cum)=0.900,模型區分參數R2Y(cum)=0.702,模型預測參數Q2=0.651,均>0.500,表明該數學模型穩定可靠[15?16]。48 個樣品可分成3 類。以VIP 值>1 為提取標準,得到峰3、金絲桃苷、峰4是影響分類的主要標志性成分。

圖8 菟絲子飲片、水煎液和配方顆粒HPLC 指紋圖譜OPLS?DA得分圖Figure 8 OPLS?DA Score plot of Cuscutae Semen pieces,waterdecoction,formula granules
3 討論
中藥配方顆粒既保留了傳統中醫藥辨證論治、復方配伍、隨證加減的優勢和特色,同時彌補了傳統中藥湯劑煎煮費時、儲存攜帶不便等不足,相比中藥飲片具有更高的附加值,更能體現中藥用藥的現代化、規范化和標準化,是對傳統中藥的重要創新[17]。目前中藥配方顆粒與中藥飲片水煎液的成分對比研究,大多以單個指標成分含量進行比較,整體成分比較的研究較少,不能全面反映中藥質量水平。中藥指紋圖譜是中藥整體性的化學表征,可以直觀地反映制備工藝的穩定性和配方顆粒的質量,是中藥配方顆粒進行質量控制的重要方法[18]。
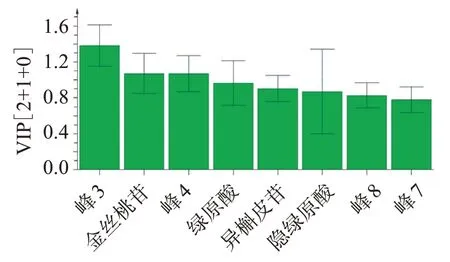
圖9 菟絲子飲片、水煎液和配方顆粒HPLC 指紋圖譜VIP值Figure 9 Result of VIP of Cuscutae Semen pieces,water decoc?tion,formula granules
本文建立的菟絲子飲片、水煎液和配方顆粒HPLC指紋圖譜及分析方法共確定了8個共有峰,并指認了其中4個共有峰分別為綠原酸、隱綠原酸、金絲桃苷和異槲皮苷。相似度評價結果顯示,16 批菟絲子飲片、水煎液和配方顆粒均與相應的對照指紋圖譜的相似度較高,表明不同批次的菟絲子整體的化學成分具有較好的一致性;水煎液和配方顆粒的制備工藝穩定。散點圖中點與點之間的距離代表各樣品之間存在的差異程度[19]。CA、PCA和OPLS?DA結果顯示,不同批次菟絲子飲片較為分散,不同批次水煎液、配方顆粒之間較為緊密,表明經過水煎煮后菟絲子中各類化學成分具有較好的一致性;飲片與水煎液、配方顆粒之間的差異較大,可能是由于菟絲子中的熱敏性成分(如綠原酸)經過煎煮后含量發生變化;水煎液和配方顆粒之間的關系較為緊密,差異較小,表明菟絲子從水煎液到配方顆粒的制備過程中各類化學成分得到了較好地保留。由皮爾遜相關性分析可得,除峰3 外,其他7 個峰均具有顯著正相關性。該方法能較好地反映三者的相關性及差異性,可為菟絲子配方顆粒的生產過程和質量控制提供依據。

