低溫脅迫對番茄幼苗不同葉齡葉片葉綠素熒光成像特性的影響
胡雪華,劉寧寧,陶慧敏,彭可佳,夏曉劍,胡文海
低溫脅迫對番茄幼苗不同葉齡葉片葉綠素熒光成像特性的影響

1井岡山大學生命科學學院,江西吉安 333009;2浙江大學農業與生物技術學院園藝系,杭州 310058
研究番茄幼苗第2葉(成熟葉)和第4葉(新生葉)葉綠素熒光成像特性對低溫脅迫的響應,并分析低溫脅迫下番茄不同葉齡葉片光合活性區域相對面積及熒光參數值的變化,以探明番茄幼苗不同葉齡葉片對低溫脅迫的適應機制。以番茄品種‘中蔬4號’(L. cv Zhongshu No.4)4葉期幼苗為材料,對番茄幼苗進行低溫(8℃、200 μmol·m-2·s-1)處理15 d后常溫(26℃白天/20℃夜晚,500 μmol·m-2·s-1)恢復1 d,于處理不同時期對幼苗全株進行葉綠素熒光成像,并比較第2葉和第4葉的葉綠素熒光成像特性。低溫處理期間,第4葉的光合活性區域相對面積(RAP)僅在處理前期(5 d)有所下降,而全株和第2葉的RAP則隨處理時間的延長持續下降,但常溫1 d即可完全恢復。低溫處理下PSII調節性能量耗散的量子產量(Y(NPQ))、PSII非調節性能量耗散的量子產量(Y(NO))和非光化學猝滅(NPQ)的熒光活性區域相對面積(RAF)與RAP基本一致,但PSII實際光化學效率(Y(II))和光化學猝滅(qP)的RAF則顯著低于RAP。低溫處理前期(5 d),番茄幼苗光合活性區域的PSII最大光化學效率(Fv/Fm)、Y(NPQ)、NPQ急劇下降和Y(NO)急劇上升,隨后,Fv/Fm保持不變,但Y(NPQ)和NPQ有所上升,Y(NO)則下降。但是,低溫處理1 d即導致光合活性區域Y(II)的急劇下降,隨后維持不變。另外,番茄全株和第4葉的光合活性區域qP僅表現在處理第1天時小幅下降,隨后則維持高于處理前的水平,而第2葉qP則在第5天有明顯上升后又迅速下降。總體上,第4葉光合活性區域的Fv/Fm、Y(II)、Y(NPQ)、NPQ和qP明顯高于第2葉,Y(NO)低于第2葉。番茄幼苗可通過主動降低葉片光合活性區域面積來適應低溫脅迫,而葉片熱耗散能力在低溫處理前期受到抑制,直到處理后期才逐漸發揮其光保護作用;低溫脅迫下番茄幼苗優先保護生長點和新生葉,成熟葉主要通過可逆降低光合活性區域面積來適應低溫脅迫,而新生葉則主要通過維持相對較高的PSII反應中心光化學和熱耗散能力防御低溫光抑制;低溫導致新生葉光合活性區域中部分有活性的PSII反應中心關閉的同時,刺激了剩余有活性PSII反應中心開放程度的提高,這將有利于低溫脅迫解除后光合活性的恢復。
番茄;低溫脅迫;葉綠素熒光成像;光抑制;葉齡
0 引言
【研究意義】番茄(L.)是我國冬春設施栽培面積最大的喜溫蔬菜之一[1],低于10℃通常會造成番茄植株冷害的發生[2]。光合作用是低溫脅迫下受到抑制的主要生理代謝過程[3]。由于同一植株上不同葉片以及同一葉片不同部位的光合特性存在差異[4-5],因此,對低溫脅迫后番茄幼苗全株進行葉綠素熒光成像分析,并比較不同葉齡葉片間葉綠素熒光成像特征的差異,有助于從整體水平上探究番茄幼苗光合特性對低溫脅迫的適應機制,為番茄設施栽培提供依據。【前人研究進展】低溫脅迫抑制了番茄葉片SBPase、FBPase和Rubisco等光合酶活性[6-9],降低了光系統II(PSII)光化學效率,阻礙了光合電子傳遞的順利進行,從而造成光抑制甚至光合機構的破壞[10-14]。葉綠素熒光分析技術作為研究植物光合特性的主要手段,具有快速無損傷、高靈敏度等優勢。然而,有關植物葉片葉綠素熒光特征的研究大多是通過測定或分析葉片局部某一點的葉綠素熒光參數,以葉片某一特定位置的葉綠素熒光信息代替了全葉甚至全株的葉綠素熒光特征。由于植物葉片存在光合異質性,因此,葉片局部的葉綠素熒光信息并不足以代表葉片整體的熒光特征,無法正確評估植物的光合特性[15-16]。葉綠素熒光成像技術可以獲得植物全葉或全株葉綠素熒光信號,既能提供熒光參數數值,又可觀察熒光特性的空間異質性,從而成為葉綠素熒光研究的重要方法之一[17-18]。雖然葉綠素熒光成像技術的應用為植物環境脅迫研究提供了巨大潛力,但是大多數文獻仍是采用葉片局部區域的熒光參數開展研究,并不能代表全葉的熒光特性,該技術在植物逆境脅迫研究中的方法還需進一步完善。而少數利用葉綠素熒光成像技術對作物整體熒光成像的研究主要側重于作物生理監測,例如王恒[19]對應用于植物生理檢測的高通量葉綠素熒光成像系統的研究,董貞芬[20]對低溫脅迫下番茄幼苗葉綠素熒光成像的分析及研究,以及Bresson等[21]基于Fv/Fm熒光值分布來量化植株光合效率空間異質性的動態分析,這類方法在分析葉綠素熒光參數圖的過程中需要采用圖像處理技術對植物區域的圖像進行提取和分析,由于圖像處理技術的專業性而限制了大多數研究者的應用。筆者前期預試驗表明,8℃低溫處理導致番茄葉片熒光成像面積顯著縮小,但常溫下1 d即可恢復,這意味著番茄在低溫脅迫下會主動抑制葉片部分區域的光合活性以減輕低溫傷害,并且還呈現不同葉片的熒光成像面積和同一葉片不同熒光參數的熒光成像面積縮小程度不一致等特征。王春萍等[5]研究也表明4℃低溫脅迫下水稻幼苗葉片的傷害程度隨著葉齡的增加而增大。【本研究切入點】對低溫脅迫下的番茄幼苗全株進行葉綠素熒光成像,并分析不同葉片葉綠素熒光成像的差異性,避免以局部葉綠素熒光特征代表植株整體對低溫脅迫響應的局限;進一步分析植株具有光合活性的區域的熒光參數對低溫脅迫的響應,以利于判斷植物保持有光合活性的部位如何防御低溫傷害。【擬解決的關鍵問題】本研究對8℃低溫處理15 d后常溫恢復1 d的番茄幼苗,在處理的各個時期采用ImagingPAM熒光成像系統對幼苗全株進行葉綠素熒光成像,并分析全株、第2葉和第4葉葉綠素熒光成像特征的變化及差異,探明番茄幼苗不同葉齡葉片光合機構對低溫脅迫的響應,從植株整體水平上探究番茄幼苗光合特性對低溫脅迫的適應機制,并完善葉綠素熒光成像技術在植物逆境脅迫研究中的應用。
1 材料與方法
試驗于2020年在井岡山大學人工氣候室進行。
1.1 試驗材料與處理
供試番茄品種為‘中蔬4號’(L. cv Zhongshu No.4)。種子播種于裝有草炭土的塑料盆(長20 cm、寬14 cm、高5 cm),幼苗2葉期移入裝有草炭土的圓形塑料盆(直徑10 cm、高15 cm),澆灌園試營養液進行水肥管理,置于人工氣候室內培養。人工氣候室設置晝夜溫度26℃/20℃(白天/夜晚),空氣相對濕度75%,采用LED植物生長燈提供約500 μmol·m-2·s-1光照,晝夜光周期設置為10/14 h,8:00和18:00分別為晝夜起始時間。幼苗4葉期時,選取植株高度和冠幅較為一致且其全株葉綠素熒光成像于ImagingPAM成像窗口中的5盆植株為試驗材料。
于處理前(T0d)將5盆番茄試驗植株分別編號1、2、3、4、5,并按編號順序于8:30開始逐一開展全株葉綠素熒光成像測定,每一盆植株在測定結束后立即移入人工氣候箱中進行8℃低溫處理,人工氣候箱空氣相對濕度75%,光照強度約200 μmol·m-2·s-1,光照時間8:00—18:00。于低溫處理第1、5、10、15天(分別記為T1d、T5d、T10d、T15d)于8:30開始,按編號順序逐一進行葉綠素熒光成像測定。低溫處理15 d的植株結束熒光成像測定后立即移入人工氣候室,恢復1 d(R1d)后按編號順序對各植株進行葉綠素熒光成像測定。
1.2 葉綠素熒光成像測定
采用調制式IMAGING-PAM葉綠素熒光儀(Walz,德國)對番茄幼苗進行全株葉綠素熒光成像測定。按照操作手冊,移除IMAGING-MAX/GS底部載物平臺并安裝4個金屬支架,將盆栽植株移入熒光儀中并使植株頂部位于18.5 cm的標準工作距離處(即LED陳列前端和植株頂部之間的距離,原安裝底部載物平臺處),以黑色絨布遮住植株根部培養基質和花盆,并用黑布包裹熒光儀進行遮光暗處理30 min。設置光化光(actinic light)強度為281 μmol·m-2·s-1,選擇Kinetics模式,進行葉綠素熒光誘導曲線(持續260 s)的測定,并導出熒光成像源文件。
1.3 葉綠素熒光參數圖像分析
1.3.1 全株、第2葉和第4葉AOI區域的選擇 ImaingWin v2.47軟件提供了Circle(圓形)、Rectangle(矩形)和Polygon(多邊形)3種AOI(area of interest)區域選擇方式。其中Polygon方式可通過連續設置多邊形點連接成任意形狀,為以全葉作為AOI區域開展研究提供了方便。利用ImaingWin v2.47軟件打開熒光成像源文件,在Image窗口下選擇NIR圖像類型,采用Polygon方式沿著植株外圍將全株納入AOI范圍,獲得全株AOI區域;采用Polygon方式,分別沿第2葉和第4葉邊緣連續設置多邊形點使之與葉片邊緣盡量重合,獲得第2葉和第4葉全葉AOI區域(圖1-A)。
1.3.2 全株、第2葉和第4葉光合活性區域熒光參數平均值的讀取 利用ImaingWin v2.47軟件Report功能可導出各AOI范圍內像素值(size)、PSII最大光化學效率(Fv/Fm)、PSII實際光化學效率(Y(II))、PSII調節性能量耗散的量子產量(Y(NPQ))、PSII非調節性能量耗散的量子產量(Y(NO))、非光化學猝滅(NPQ/4)和光化學猝滅(qP)等參數值。根據IMAGING-PAM操作手冊,當光合活性區域(photosynthetically active regions,即Fv/Fm>0區域)為斑塊時,應禁用軟件Options中“Mean over AOI”功能,此時僅對AOI范圍內光合活性區域的熒光值進行平均,所顯示的熒光圖像和熒光參數平均值僅對應AOI的光合活性區域。以低溫處理5 d的植株1全株葉綠素熒光成像圖為例,在NIR圖像類型下采用Polygon方式對第2葉和第4葉進行全葉AOI選擇(圖1-A),在Fv/Fm圖像類型下(圖1-B)明顯可觀察到兩葉沿著葉片邊緣均有一定面積Fv/Fm=0的非光合活性區域(即AOI中呈現黑色的部位),其中第2葉光合活性區域面積占全葉總面積的比例明顯低于第4葉。

圖1 低溫處理5 d時番茄幼苗第2葉和第4葉AOI選擇(A)及其光合活性區域(B)(以植株1為例)
選擇好全株、第2葉和第4葉的AOI后,通過軟件的Report功能導出全株、第2葉和第4葉AOI區域的Size、Fv/Fm、Y(II)、Y(NPQ)、Y(NO)、NPQ/4和qP等熒光參數值。經過260 s光化光誘導,植株熒光曲線已平滑,因此,選擇誘導曲線最后一次測得的熒光數據進行分析,所有熒光參數值均為AOI范圍內光合活性區域的平均值。
1.3.3 植株全株的光合活性區域相對面積和各熒光參數的熒光活性區域相對面積的計算 通過ImaingWin v2.47軟件,在Image窗口對最后一次熒光成像選擇Analysis功能,通過設置各熒光參數Low值為0.004,High值為1(其中,Y(NO)參數Low值設定為0,High值設定為0.996),讀取Red Pixel Assessment中的Number值,該值即為各熒光參數的熒光活性區域面積(size of fluorescence active regions,SAF)。由于ImagingPAM熒光成像系統定義Fv/Fm>0的部位為光合活性區域,因此,Fv/Fm的熒光活性區域面積即為光合活性區域面積(size of photosynthetically active regions,SAP)。基于處理前(T0d)植株全株各部位的Fv/Fm均大于0且較為均勻,此時植株的光合活性區域面積與植株總面積一致,因此,采用此時各植株的光合活性區域面積作為該植株總面積(SAP(T0d))。
處理各時期植株熒光參數的熒光活性區域相對面積(relative area of fluorescence active regions, RAF)采用該時期植株各熒光參數的熒光活性區域面積(SAF(Treatment),其中Treatment代表T0d、T1d、T5d、T10d、T15d、R1d)與SAP(T0d)比較而得,RAF(%) = SAF(Treatment)/SAP(T0d)×100。全株的光合活性區域相對面積(relative area of photosynthetically active regions,RAP)則為Fv/Fm的RAF。雖然番茄幼苗在低溫脅迫下葉片會發生輕微的卷曲和下垂,從而導致植株面積下降,使采用該方法估算植株光合活性區域相對面積和熒光參數活性區域相對面積會稍低于實際值,但不會改變低溫對其影響的整體趨勢,因此,本研究仍采用這種計算方式。
1.3.4 第2葉和第4葉光合活性區域相對面積的計算 由ImaingWin v2.47軟件Report功能導出的Size值為AOI像素值,即AOI面積。配合Options菜單中啟用和禁用“Mean over AOI”功能,可獲得AOI總面積和AOI光合活性區域面積。啟用“Mean over AOI”,Size值為AOI總像素值,即AOI總面積(ST);禁用“Mean over AOI”,Size值則是AOI中具有光合活性區域的像素值,即AOI的光合活性區域面積(SP)。第2葉和第4葉的光合活性區域相對面積RAP(%) = SP/ ST×100。
2 結果
2.1 低溫脅迫對光合活性區域相對面積和Fv/Fm的影響
隨著低溫處理時間的延長,Fv/Fm熒光成像呈現出由葉緣逐漸向主脈收縮變小的趨勢,以及葉片葉齡越大其熒光成像面積縮小越明顯的特征;低溫處理也導致Fv/Fm值的下降,表現為代表Fv/Fm值大小的顏色由深藍色向綠色和黃色轉變,且葉齡越大熒光值越小,同一葉片靠近莖和葉脈中心部分的熒光值越大。低溫處理后僅恢復1 d,Fv/Fm熒光成像面積得以迅速恢復,并且新葉靠近莖中心的大部位區域也基本恢復至深藍色,但老葉則仍有較大面積呈現黃綠色(圖2)。這表明新葉對低溫脅迫的抵抗能力和恢復能力均高于老葉。由于ImagingPAM熒光成像系統定義Fv/Fm>0部位為光合活性區域,因此,圖2也代表了光合活性區域的變化情況。
低溫處理對番茄全株、第2葉和第4葉光合活性區域相對面積的影響如圖3-A所示。第4葉光合活性區域相對面積在低溫處理1 d時并未下降,處理5 d下降6.9%后就不再下降。但番茄全株和第2葉光合活性區域相對面積隨著處理時間的延長而持續下降,低溫處理1 d即分別下降21.6%和14.2%,處理15 d時則分別下降了55.4%和40.8%。常溫下恢復1 d,番茄全株、第2葉和第4葉的光合活性區域相對面積均可完全恢復至處理前水平,說明8℃低溫脅迫15 d并未引起番茄幼苗葉片壞死。
低溫處理對番茄全株、第2葉和第4葉光合活性區域Fv/Fm的影響如圖3-B所示。幼苗全株、第2葉和第4葉的Fv/Fm在處理前均約0.710,低溫處理1 d即引起Fv/Fm的迅速下降,處理5 d時達到最低點,分別為0.256、0.229和0.320;但隨后的低溫處理并未引起全株和第2葉Fv/Fm的下降,第4葉反而有所上升。恢復1 d,第4葉Fv/Fm可完全恢復至處理前水平,而全株和第2葉則恢復至0.620和0.580,仍低于處理前水平。

圖2 低溫脅迫15 d和恢復1 d期間番茄幼苗Fv/Fm的熒光成像(以植株1為例)
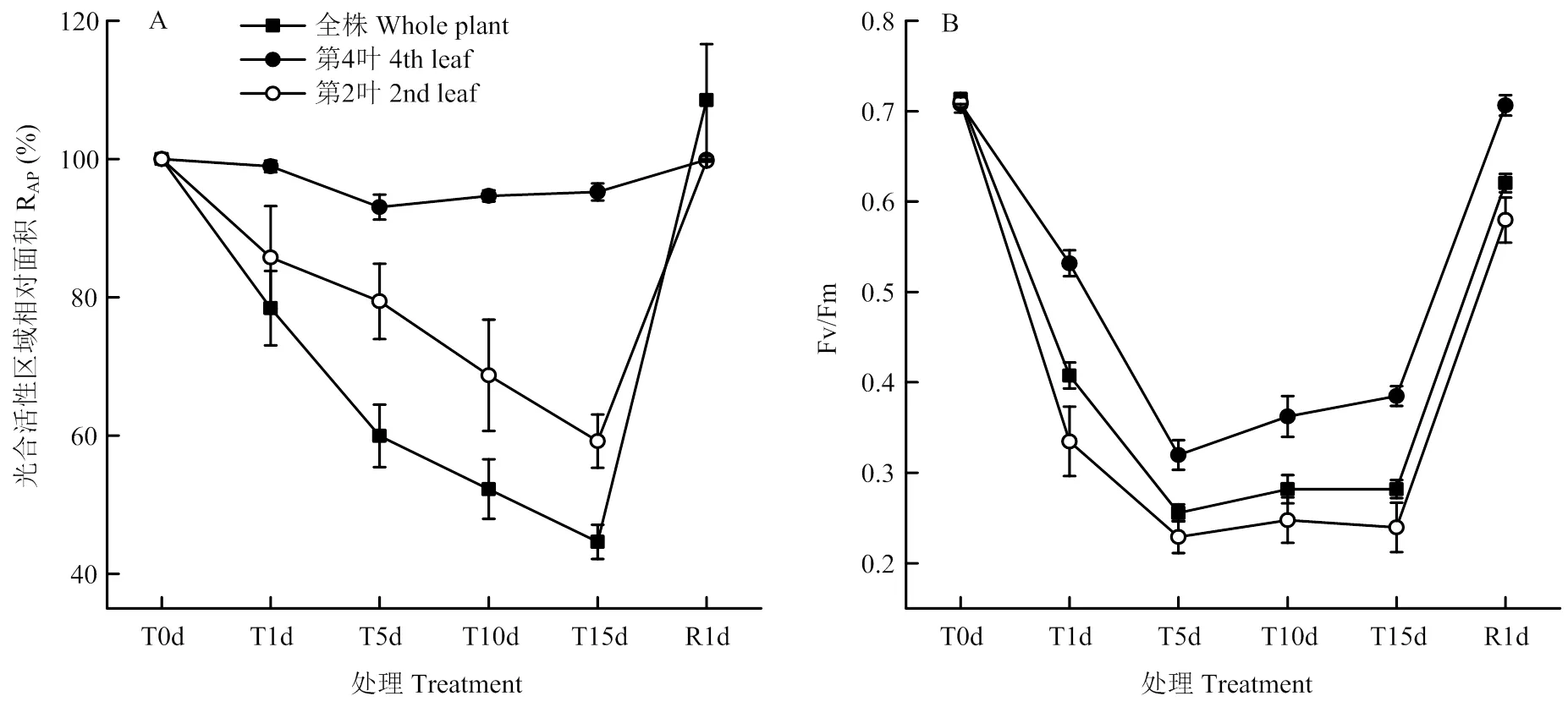
圖3 低溫脅迫對番茄幼苗光合活性區域相對面積(RAP)和Fv/Fm的影響
2.2 低溫脅迫對Y(II)、Y(NPQ)和Y(NO)的影響
由圖4和圖5-A可知,低溫處理可導致Y(II)、Y(NPQ)和Y(NO)熒光成像面積的下降,但對Y(II)的影響更為明顯。番茄幼苗Y(II)熒光成像面積隨著處理時間的延長而急劇下降,至處理15 d時難以觀察到植株基本形態。低溫脅迫下Y(NPQ)和Y(NO)的成像面積雖然略有下降,但仍保持了植株基本形態。低溫處理期間Y(NPQ)和Y(NO)的熒光活性區域表現出與光合活性區域面積同步下降,在處理15 d時還稍高于光合活性區域面積,而Y(II)熒光活性區域面積則明顯低于光合活性區域面積。然而,恢復1 d時,Y(II)、Y(NPQ)和Y(NO)熒光成像面積均可恢復至處理前水平,且與植株光合活性區域面積相一致。
低溫處理1 d即導致番茄幼苗光合活性區域Y(II)熒光值大幅下降,隨后則呈現小幅升高、降低、再升高的變化(圖5-B)。雖然番茄幼苗全株和第2葉光合活性區域的Y(II)熒光值在低溫處理前高于第4葉,但低溫處理期間第4葉的Y(II)熒光值高于全株和第2葉。恢復1 d,全株和第2葉的Y(II)熒光值可恢復至處理前水平,而第4葉則明顯高于處理前水平。由圖4-A可知,靠近莖尖生長中心的新葉表現綠色,老葉葉緣處仍表現為明顯的黃色,表明長期低溫脅迫后番茄幼苗優先恢復生長中心葉片的Y(II)。
處理前番茄幼苗全株和第2葉光合活性區域的Y(NPQ)明顯低于第4葉,低溫處理期間Y(NPQ)呈現先下降后上升的變化趨勢(圖5-C)。其中,第4葉的Y(NPQ)在低溫處理5 d時下降至最低點后開始上升;而全株和第2葉的Y(NPQ)分別在處理5 d和10 d時降到最低點,然后均從低溫處理10 d后開始上升。恢復1 d后,第2葉的Y(NPQ)仍有小幅上升,而第4葉和全株的Y(NPQ)則與低溫處理15 d時沒有明顯變化,但均未恢復至處理前水平。
處理前番茄幼苗全株、第2葉和第4葉光合活性區域Y(NO)未見差異,低溫處理則導致了Y(NO)的上升,且全株和第2葉的上升幅度大于第4葉(圖5-D)。全株和第2葉的Y(NO)在處理10 d時達到最大值,而第4葉則在低溫處理5 d時達到最大值,然后均隨著處理時間的延長而明顯下降。恢復1 d后,全株、第2葉和第4葉的Y(NO)均顯著下降,其中第4葉可恢復至處理前水平,但全株和第2葉的Y(NO)仍稍高于處理前水平。結合圖4-C番茄幼苗外圍部分Y(NO)熒光成像呈現藍色,而靠近莖尖生長中心的葉片部分則呈黃綠色,說明位于番茄內側的莖尖和新葉的Y(NO)更易于恢復。
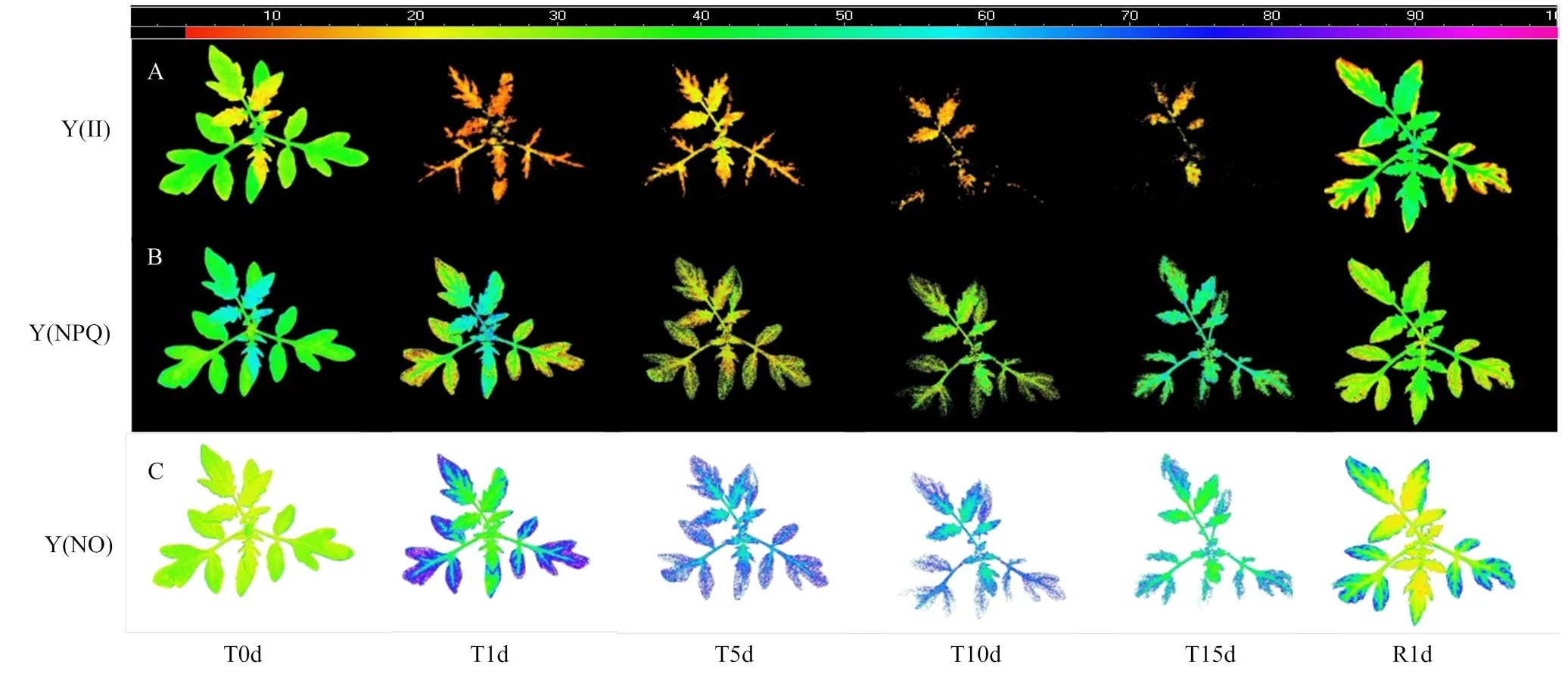
圖4 低溫脅迫15 d和恢復1 d期間番茄幼苗Y(II)、Y(NPQ)和Y(NO)的熒光成像(以植株1為例)

圖5 低溫脅迫對番茄幼苗光合活性區域Y(II)、Y(NPQ)和Y(NO)的影響
2.3 低溫脅迫對NPQ和qP的影響
由圖6和圖7-A可知,低溫脅迫下番茄幼苗NPQ熒光成像面積雖然略有下降,但仍呈現出植株基本形態,且其熒光活性區域相對面積除了在低溫處理15 d時稍高于光合活性區域相對面積外,其他時間均與光合活性區域相對面積沒有明顯差異。而qP的熒光成像面積在低溫處理1 d時即大幅下降,且在低溫處理后期難以觀察到植株基本形態。但恢復1 d時,NPQ和qP的熒光成像面積均可恢復至處理前水平。

圖6 低溫脅迫15 d和恢復1 d期間番茄幼苗NPQ和qP的熒光成像(以植株1為例)
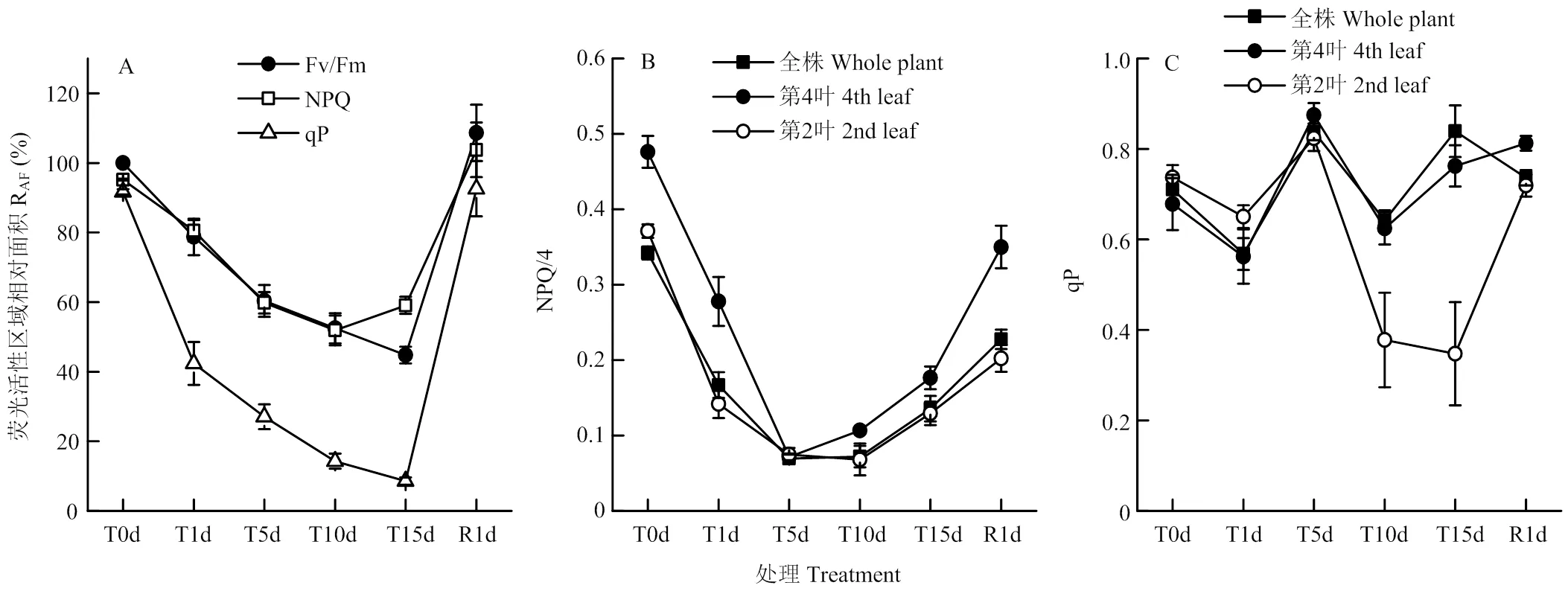
圖7 低溫脅迫對番茄幼苗光合活性區域NPQ和qP的影響
處理前番茄幼苗全株和第2葉光合活性區域NPQ明顯低于第4葉,低溫處理期間NPQ呈先下降后上升的變化。幼苗全株、第2葉和第4葉的Y(NPQ)均在低溫處理5 d時下降至最低點,隨后,第4葉在低溫處理5 d后即開始恢復,全株和第2葉從10 d后開始恢復。恢復1 d,全株、第2葉和第4葉的NPQ仍顯著上升,但均未恢復至處理前水平(圖7-B)。
低溫處理前番茄全株、第2葉和第4葉光合活性區域的qP沒有明顯差異,低溫處理1 d導致qP小幅下降,處理5 d時均明顯上升至高于處理前水平;隨后,低溫處理10 d時qP又有所下降,其中第4葉和全株仍保持在不低于處理前水平,而第2葉則下降至處理前的51.3%;低溫處理15 d時,全株和第4葉的qP又顯著上升至高于處理前水平,而第2葉則變化不大。恢復1 d時,第2葉qP迅速恢復至處理前水平,第4葉也略有上升并高于處理前,而全株qP則下降至處理前水平(圖7-C)。
3 討論
3.1 低溫脅迫影響番茄幼苗不同葉齡葉片光合活性區域面積及分布
葉綠素熒光成像技術在作物低溫脅迫研究中的應用表明冷害并不是均勻發生在葉片各部分[18,22-23],本研究結果也表明低溫處理引起了番茄幼苗所有葉片各熒光參數的異質性增大并且對葉齡大的葉片影響更大。進一步比較各時期不同葉齡葉片的熒光參數熒光成像和熒光活性相對面積,雖然低溫導致了幼苗全株和所有葉片的熒光活性區域縮小,但對第2葉的抑制作用更明顯,而靠近生長中心的第4葉則顯著優于第2葉和全株水平。而且第2葉也表現出光合活性區域主要分布于近莖端和葉脈處,幼苗植株的光合活性區域整體呈現以莖尖生長點為中心向外擴散的分布趨勢。這些結果均表明低溫脅迫下番茄幼苗優先保護生長點和新生葉。王春萍等[5]的研究也表明低溫脅迫下水稻幼苗葉片的葉齡越大越容易受到傷害,葉齡越小則對低溫的抵抗能力越強。
與此同時,本研究觀察到低溫脅迫導致葉片光合活性區域的縮小在常溫恢復1 d時即可完全恢復至處理前水平,這意味著低溫導致的光合活性區域面積減少是保護性的可逆反應。植物綠色葉片低溫光抑制是由于葉片吸收的光能超過碳同化所需,光能吸收與利用的失衡導致光合機構中過剩激發能的積累,最終促進了活性氧的產生和傷害的發生[24-26]。據此,推測低溫脅迫下(8℃、200 μmol·m-2·s-1)番茄可以主動關閉葉片部分區域的PSII反應中心光化學活性,通過減少對光能的吸收來主動防御低溫傷害,是番茄在低溫脅迫下的一種自適應反應。筆者課題組前期研究也表明,番茄葉片單位面積有活性的PSII反應中心數目(RC/CS)在8℃低溫處理的第1天即顯著下降,并在低溫處理4 d后恢復的第1天即大幅上升,也從另一側面說明低溫脅迫誘導了番茄葉片PSII反應中心的可逆失活[14]。這一現象在其他文獻中未見報道,因此,需要在更多的植物種類和不同光溫脅迫條件下進行研究,進一步驗證植物是否具有主動關閉葉片部分區域PSII的光化學反應活性以適應低溫脅迫的響應機制。
3.2 低溫脅迫影響番茄幼苗不同葉齡葉片光合活性區域葉綠素熒光參數
葉綠素熒光參數反映了植物葉片PSII的功能和吸收光能分配情況。低溫脅迫通常會抑制番茄幼苗葉片PSII光化學效率,從而減少葉片吸收光能分配給PSII光化學反應的比例,導致吸收光能中PSII非調節性能量耗散部分的增加和PSII光抑制的發生,表現為Fv/Fm、qP和Y(II)(或ΦPSII)的下降和Y(NO)的上升[27-29]。而低溫對番茄葉片熱耗散能力的影響則因低溫處理條件不同而異,4℃暗處理10 h誘導了番茄品種Micro-Tom葉片NPQ增強[30],夜間5℃處理3 d也誘導了番茄品種‘L-404’葉片Y(NPQ)的增強[18],而低溫弱光(15℃白天/7℃夜晚,180 μmol·m-2·s-1)處理15 d導致番茄品種‘合作903’葉片NPQ下降[28]。本研究發現8℃低溫處理前期(5 d)對番茄品種‘中蔬4號’葉片光合活性區域光抑制的影響較明顯,而處理后期(5—15 d)并未引起光抑制程度的加劇。低溫處理后期第2葉光合活性區域面積持續下降,這表明低溫處理后期番茄幼苗成熟葉可通過主動縮小葉片光合活性區域來適應低溫脅迫。然而,第4葉的光合活性區域面積在低溫處理后期并未下降,而其Fv/Fm反而有所上升,這意味著新生葉具有與成熟葉不同的低溫光抑制防御機制。
PSII天線色素吸收光能可分為PSII光化學反應利用的能量Y(II)、PSII調節性能量耗散Y(NPQ)和非調節性的能量耗散Y(NO)三部分[31]。高Y(NO)值意味著PSII反應中心過量激發能的積累,并將成為光抑制發生的誘因[31-32]。本研究中所有葉片的Y(NO)在低溫處理的前5 d迅速上升,第10 天時第2葉并沒有明顯變化而第4葉開始下降,第15 d時則全部呈明顯下調。該結果證明了低溫處理前期番茄葉片PSII反應中心激發能的積累引起了光抑制的發生,而低溫處理后期PSII反應中心激發能的積累不但沒有進一步加劇反而有所緩解,從而使光合活性區域的光抑制程度并未加劇,新生葉光抑制程度反而有所緩解。低溫處理前期Y(NO)迅速上升的原因是由于Y(II)和Y(NPQ)同時大幅下降所致,而后期Y(NO)有所緩解的原因則主要是由于Y(NPQ)恢復上升所致。低溫處理1 d即導致Y(II)大幅下降53.7%,并在隨后的低溫處理中一直保持低水平。Y(II)的下降表明低溫降低了PSII反應中心將光能轉化為電能進行電子傳遞的能力[33],這與筆者課題組利用快速葉綠素熒光誘導動力學分析的結果相一致,低溫處理降低了番茄葉片單位面積對光能的吸收(ABS/CS)、捕獲(TRo/CS)和進行電子傳遞(ETo/CS)的能力[14]。Y(NPQ)則在處理的前5 d內持續下降至處理前的48.0%,隨后第4葉隨著處理時間的延長而明顯恢復上升,而第2葉和全株則在第10天后明顯恢復上升,處理期間NPQ也呈現出相同的變化趨勢。這些結果意味著低溫處理前期不但沒有誘導反而抑制了番茄光合機構熱耗散的進行,低溫處理后期熱耗散才逐漸發揮其光保護作用。
然而,本研究還發現,番茄全株和第4葉光合活性區域qP僅表現為在處理第1 天時分別小幅下降20.1%和17.1%,隨后維持在不低于或高于處理前水平。qP反映了PSII反應中心的開放程度[33],取決于QA的氧化還原程度,決定了PSII的激發能捕獲速率[34]。這意味著在長達15 d的低溫處理期間,番茄新生葉光合活性區域的PSII反應中心只在第1天有較小程度的關閉,隨后一直維持著較高開放程度,對激發能的捕獲能力增強。多數文獻中低溫導致植物qP下降,這主要與熒光參數測量采用光纖式熒光儀有關,在這種情況下測得的qP是測量區域內(包括光合活性區域和非光合活性區域)的qP平均值。事實上,如果以番茄全株或第4葉全葉面積(包括光合活性區域和非活性區域)所讀取的qP平均值也隨著低溫處理時間延長而下降(數據未列出)。結合番茄全株和各葉片光合活性區域面積隨著低溫處理時間的延長而持續下降,而Y(II)和qP熒光活性相對面積顯著低于光合活性區域相對面積這一結果,是否意味著低溫脅迫除了誘導番茄葉片部分區域PSII反應中心的可逆失活,還導致光合活性區域中部分有活性的PSII反應中心關閉,但刺激了新生葉剩余有活性的PSII反應中心開放程度的提高。有研究表明,低溫脅迫在降低作物葉片單位面積有活性的PSII反應中心數目(RC/CS)時會迫使作物剩余有活性的反應中心效率的提高[14,35]。而番茄新生葉對低溫的這種響應是否有利于脅迫解除后葉片光合能力的恢復?本研究觀察到低溫處理后恢復1 d,第4葉的qP即可恢復至處理前的119.8%,熒光成像圖也顯示此時番茄幼苗絕大部分葉片區域呈現比處理前qP數值更高的藍紫色,似乎佐證了這種設想。但是,與處理前相比,第2葉在低溫處理后期(10、15 d)相比處理前約下降了50%,這意味著長期低溫脅迫對番茄成熟葉有活性的PSII反應中心數量和開放程度均有明顯的抑制作用。王春萍等[5]的研究也表明,與對照相比,低溫脅迫下水稻葉齡最小的第3葉qP有明顯上升,而葉齡最大的第1葉qP則顯著下降。雖然有關植物低溫馴化提高抗寒性有較多研究,例如辣椒在14℃亞適溫馴化5 d可促進依賴于葉黃素循環的熱耗散能力的增強[36],番茄在12℃/10℃低溫馴化3 d后可通過激發H2O2以誘導抗氧化酶的表達與活性的上調[37],并對光合機構起保護作用。而本研究中8℃低溫處理后期新生葉光合活性區域維持較高的PSII開放程度這一自適應現象在以往研究中鮮見討論,值得深入研究。
4 結論
8℃低溫處理下,番茄幼苗可通過主動降低葉片光合活性區域面積來適應低溫脅迫,處理前期對光合活性區域光抑制影響顯著,而處理后期光抑制程度沒有加劇;葉片熱耗散能力在低溫處理前期受到抑制,直到處理后期才逐漸發揮其光保護作用;低溫脅迫下番茄幼苗優先保護生長點和新生葉,成熟葉主要通過可逆降低光合活性區域面積來適應低溫脅迫,而新生葉則主要通過維持相對較高的PSII反應中心光化學和熱耗散能力防御低溫光抑制;低溫導致新生葉光合活性區域中部分有活性的PSII反應中心關閉的同時,刺激了剩余有活性PSII反應中心開放程度的提高,有利于低溫脅迫解除后恢復期光合活性的恢復。
[1] 羅鑫輝, 劉明月, 黃科, 劉玉兵, 彭淼, 王軍偉. 不同品種番茄幼苗低溫適應性評價及光合特性分析. 中國瓜菜, 2021, 34(8): 49-55.
LUO X H, LIU M Y, HUANG K, LIU Y B, PENG M, WANG J W. Evaluation of low temperature adaptability and analysis of photosynthetic characteristics in different tomato varieties. China Cucurbits and Vegetables, 2021, 34(8): 49-55. (in Chinese)
[2] PARK E J, JEKNI? Z, SAKAMOTO A, DENOMA J, YUWANSIRI R, MURATA N, CHEN T H H. Genetic engineering of glycinebetaine synthesis in tomato protects seeds, plants, and flowers from chilling damage. Plant Journal, 2004, 40: 474-487.
[3] ALLEN D J, ORT D R. Impacts of chilling temperatures on photosynthesis in warm-climate plants. Trends of Plant Science, 2001, 6(1): 36-42.
[4] 胡文海, 喻景權. 低溫弱光對番茄葉片光合作用和葉綠素熒光參數的影響. 園藝學報, 2001, 41(1): 41-46.
HU W H, YU J Q. Effects of chilling under low light on photosynthesis and chlorophyll fluorescence characteristic in tomato leaves. Acta Horticulturae Sinica, 2001, 28(1): 41-46. (in Chinese)
[5] 王春萍, 雷開榮, 李正國, 林清, 吳紅. 低溫脅迫對水稻幼苗不同葉齡葉片葉綠素熒光特性的影響. 植物資源與環境學報, 2012, 21(3): 38-43.
WANG C P, LEI K R, LI Z G, LIN Q, WU H. Effects of chilling stress on chlorophyll fluorescence characteristics of seedling leaves with different leaf ages of. Journal of Plant Resources and Environment, 2012, 21(3): 38-43. (in Chinese)
[6] BRüGGEMANN W, KLAUCKE S, MAAS-KANTEL K. Long-term chilling of young tomato plants under low light.and molecular properties of two key enzymes of the Calvin cycle inMill andMill. Planta, 1994, 194: 160-168.
[7] BYRD G T, ORT D R, OGREN W L. The effects of chilling in the light on ribulose-1,5-bisphosphate carboxylase/oxygenase activation in tomato (Mill.). Plant Physiology, 1995, 107: 585-591.
[8] ARTUSO A, GUIDI L, SOLDATINI G F, PARDOSSI A, TOGNONI F. The influence of chilling on photosynthesis and activities of some enzymes of sucrose metabolism inMill. Acta Physiologiae Plantarum, 2000, 22(2):95-101.
[9] DING F, WANG M L, ZHANG S X, AN X Z. Changes in SBPase activity influence photosynthetic capacity, growth, and tolerance to chilling stress in transgenic tomato plants. Scientific Reports, 2016, 6: 32741.
[10] KEE S C, MARTIN B, ORT D R. The effects of chilling in the dark and in the light on photosynthesis of tomato: Electron transfer reactions. Photosynthesis Research, 1986, 8: 41-51.
[11] HU W H, ZHOU Y H, DU Y S, XIA X J, YU J Q. Differential response of photosynthesis in greenhouse- and field-ecotypes of tomato to long-term chilling under low light. Journal of Plant Physiology, 2006, 163: 1238-1246.
[12] 陳靜, 陳啟林, 程智慧, 徐春和. 花青苷對低溫弱光處理的番茄(Mill.)幼苗光合機構的保護作用. 中國農業科學, 2007, 40(4): 788-793.
CHEN J, CHEN Q L, CHENG Z H, XU C H. Protective effect of anthocyanin on photosynthetic apparatus of tomato (Mill.) seedling leaves exposed to low temperature and low irradiance. Scientia Agricultura Sinica, 2007, 40(4): 788-793. (in Chinese)
[13] ZUSHI K, KAJIWARA S, MATSUZOE N. Chlorophyll a fluorescence OJIP transient as a tool to characterize and evaluate response to heat and chilling stress in tomato leaf and fruit. Scientia Horticulturae, 2012, 148: 39-46.
[14] 胡文海, 胡雪華, 閆小紅, 周升團. 低溫脅迫及恢復對番茄快速葉綠素熒光誘導動力學特征的影響. 中國農業氣象, 2021, 42(10): 859-869.
HU W H, HU X H, YAN X H, ZHOU S T. Response of chlorophyll fluorescence transient in leaves of tomato under chilling stress and subsequent recovery. Chinese Journal of Agrometeorology, 2021, 42(10): 859-869. (in Chinese)
[15] RALPH P J, MACINNIS-NG C M O, FRANKART C. Fluorescence imaging application: Effect of leaf age on seagrass photokinetics. Aquatic Botany, 2005, 81(1): 69-84.
[16] 樊大勇, 付增娟, 謝宗強, 李榮貴, 張淑敏. 調制式熒光影像新技術: 葉片內部最大光化學量子效率及其異質性的活體測定. 植物生態學報, 2016, 40(9): 942-951.
FAN D Y, FU Z J, XIE Z Q, LI R G, ZHANG S M. A new technology of modulated Chl a fluorescence image:measurement of the PSII maximum photochemical efficiency and its heterogeneity within leaves. Chinese Journal of Plant Ecology, 2016, 40(9): 942-951. (in Chinese)
[17] KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42: 313-349.
[18] DONG Z F, MEN Y H, LI Z M, ZOU Q Y, JI J W. Chlorophyll fluorescence imaging as a tool for analyzing the effects of chilling injury on tomato seedlings. Scientia Horticulturae, 2019, 246: 490-497.
[19] 王恒. 應用于植物生理檢測的高通量葉綠素熒光成像系統研究[D]. 杭州: 浙江大學, 2018.
WANG H. Research on high throughput chlorophyll fluorescence imaging system applied in plant physiology detection [D]. Hangzhou: Zhejiang University, 2018. (in Chinese)
[20] 董貞芬. 低溫脅迫下番茄幼苗葉綠素熒光成像的分析及研究[D]. 沈陽: 沈陽農業大學, 2019.
DONG Z F. Analysis and study on chlorophyll fluorescence imaging of tomato seedlings under low temperature stress [D]. Shenyang: Shenyang Agricultural University, 2019. (in Chinese)
[21] BRESSON J, VASSEUR F, DAUZAT M, KOCH G, GRANIER C, VILE D. Quantifying spatial heterogeneity of chlorophyll fluorescence during plant growth and in response to water stress. Plant Methods, 2015, 11: 23.
[22] HOGEWONING S W, HARBINSON J. Insights on the development, kinetics, and variation of photoinhibition using chlorophyll fluorescence imaging of a chilled, variegated leaf. Journal of Experimental Botany, 2007, 58(3): 453-463.
[23] XIA X J, FANG P P, GUO X, QIAN X J, ZHOU J, SHI K, ZHOU Y H, YU J Q. Brassinosteroid-mediated apoplastic H2O2-glutaredoxin 12/14 cascade regulates antioxidant capacity in response to chilling in tomato. Plant, Cell & Environment, 2018, 41(5): 1052-1064.
[24] ALAM B, JACOB J. Overproduction of photosynthetic electrons is associated with chilling injury in green leaves. Photosynthetica, 2002, 40(1): 91-95.
[25] ORT D R, BAKER N R. A photoprotective role for O2as an alternative electron sink in photosynthesis? Current Opinion in Plant Biology, 2002, 5(3): 193-198.
[26] HU W H, YAN X H, YU J Q. Importance of the mitochondrial alternative oxidase (AOX) pathway in alleviating photoinhibition in cucumber leaves under chilling injury and subsequent recovery when leaves are subjected to high light intensity. The Journal of Horticultural Science and Biotechnology, 2017, 92(1): 31-38.
[27] 楊再強, 張波, 張繼波, 彭曉丹, 張婷華, 張靜. 低溫脅迫對番茄光合特性及抗氧化酶活性的影響. 自然災害學報, 2012, 21(4): 168-174.
YANG Z Q, ZHANG B, ZHANG J B, PENG X D, ZHANG T H, ZHANG J. Effects of low temperature stresses on photosynthetic charateristics and activity of antioxidant enzymes of tomatos. Journal of Natural Disasters, 2012, 21(4): 168-174. (in Chinese)
[28] SHU S, TANG Y Y, YUAN Y H, SUN J, ZHONG M, GUO S R. The role of 24-epibrassinolide in the regulation of photosynthetic characteristics and nitrogen metabolism of tomato seedlings under a combined low temperature and weak light stress. Plant Physiology and Biochemistry, 2016, 107: 344-353.
[29] WEI D D, ZHANG T P, WANG B Q, ZHANG H L, MA M Y, LI S F, CHEN T H H, BRESTIC M, LIU Y, YANG X H. Glycinebetaine mitigates tomato chilling stress by maintain high-cyclic electron flow rate of photosystem I and stability of photosystem II. Plant Cell Reports, 2022, 41: 1087-1101.
[30] DING F, WANG M L, LIU B, ZHANG S X. Exogenous melatonin mitigates photoinhibition by accelerating non-photochemical quenching in tomato seedlings exposed to moderate light during chilling. Frontiers in Plant Science, 2017, 8: 244.
[31] 胡文海, 張斯斯, 肖宜安, 閆小紅. 兩種杜鵑花屬植物對長期遮陰后全光照環境的生理響應及其光保護機制. 植物生態學報, 2015, 39(11): 1093-1100.
HU W H, ZHANG S S, XIAO Y A, YAN X H. Physiological responses and photo-protective mechanisms of two Rhododendron plants to natural sunlight after long term shading. Chinese Journal of Plant Ecology, 2015, 39(11): 1093-1100. (in Chinese)
[32] KRAMER D M, JOHNSON G, KIIRATS O, EDWARDS G E. New fluorescence parameters for the determination of QAredox state and excitation energy fluxes. Photosynthesis Research, 2004, 79:209-218.
[33] MAXWELL K, JOHNSON G N. Chlorophyll fluorescence- a practical guide. Journal of Experimental Botany, 2000, 51(345): 659-668.
[34] 許大全. 光合作用效率. 上海: 上海科學技術出版社, 2002: 29-37.
XU D Q. Photosynthetic Efficiency. Shanghai: Shanghai Scientific and Technical Publishers, 2002: 29-37. (in Chinese)
[35] XU C, WANG M T, YANG Z Q, ZHENG Q T. Low temperature and low irradiation induced irreversible damage of strawberry seedlings. Photosynthetica, 2020, 58(1): 156-164.
[36] LIU P, MENG Q W, ZOU Q, ZHAO S J, LIU Q Z. Effects of cold-hardening on chilling-induced photoinhibition of photosynthesis and on xanthophyll cycle pigments in sweet pepper. Photosynthetica, 2001, 39(3): 467-472.
[37] ZHOU J, WANG J, SHI K, XIA X J, ZHOU Y H, YU J Q. Hydrogen peroxide is involved in the cold acclimation-induced chilling tolerance of tomato plants. Plant Physiology and Biochemistry, 2012, 60: 141-149.
Effects of Chilling on Chlorophyll Fluorescence Imaging Characteristics of Leaves with Different Leaf Ages in Tomato Seedlings

1School of Life Sciences, Jinggangshan University, Ji’an 343009, Jiangxi;2College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058
This study analyzed the characteristics of chlorophyll fluorescence imaging of the 2nd (mature) and 4th (newly born) leaves of tomato seedlings in response to chilling stress, aiming to probe the mechanism of leaves with different ages adapted to chilling stress in tomato seedlings.In this study,L. cv Zhongshu No. 4 was used as the research material. The tomato seedlings in the 4-leaf stage were treated at chilling (8℃, 200 μmol·m-2·s-1) for 15 d and then recovered at normal temperature (26℃ day/20℃ night, 500 μmol·m-2·s-1) for 1 d. The Chlorophyll fluorescence imagings of the whole seedlings were measured at different stages under different treatments, and the characteristics of chlorophyll fluorescence imaging of the 2nd and 4th leaves were compared.The results showed that the relative area of photosynthetically active regions (RAP) on the 4th leaves decreased slowly during the first 5 d of the chilling stress, while the RAPon the 2nd leaves and the whole plants decreased steadily during the whole chilling treatment. The RAPrecovered completely after 1 d of recovery. Under chilling treatment, the relative area of fluorescence active regions (RAF) for quantum yield of regulatory energy dissipation (Y(NPQ)), quantum yield of nonregulatory energy dissipation (Y(NO)), and nonphotochemical quenching (NPQ) showed similar changes as that of RAP. However, the RAFof effective PSII quantum yield (Y(II)) and coefficient of photochemical quenching (qP) were significantly lower than that of RAP. The maximum PSII quantum yield (Fv/Fm), Y(NPQ), and NPQ decreased while Y(NO) increased sharply in the photosynthetically active region in tomato seedlings during the first 5 d of the chilling treatment. In the following days, the Fv/Fm remained unchanged, whereas Y(NPQ) and NPQ increased and Y(NO) decreased. However, Y(II) declined sharply 1 d after chilling stress and then remained unchanged. Interestingly, qP in the photosynthetic active region of the 4th leaves decreased only slightly after 1 d of chilling treatment, and then maintained higher than that before treatment. However, qP of the 2nd leaves increased significantly on the 5th day and then decreased rapidly. Overall, the Fv/Fm, Y(II), Y(NPQ) and qP in the 4th leaves were higher than those in the 2nd leaves, whereas the Y(NO) were relatively lower in the 4th leaves.The study found that tomato seedlings responded to chilling stress by decreasing the area of photosynthetically active regions. The regulatory nonphotochemical quenching, which played a central role in photoprotection, was inhibited in the early stage, but gradually increased during the later stage under chilling treatment. The mature leaves adapted to chilling stress likely by decreasing the size of photosynthetically active regions, while higher capacities of PSII photochemistry and thermal dissipation were maintained in the newly born leaves in response to chilling stress. The protection of shoot apex and newly born leaves might be the priority of tomato seedlings in response to chilling stress. For newly born leaves, the chilling induced the closure of some active PSII reaction centers, but improved the operating efficiency of the remaining active PSII reaction centers, which was potentially beneficial for the recovery of photosynthetic activity.
tomato (L.); chilling stress; chlorophyll fluorescence imaging; photoinhibition; leaf age

2022-04-13;
2022-06-16
江西省自然科學基金重點項目(2019ACB20017)
胡雪華,E-mail:huxuehua1210@126.com。通信作者胡文海,E-mail:huwenhai@jgsu.edu.cn
(責任編輯 趙伶俐)

