香水檸檬RHF2A的克隆與互作蛋白的篩選
李雨澤,朱嘉偉,林蔚,2,藍茉瑩,夏黎明,張藝粒,羅聰,黃桂香,何新華
香水檸檬的克隆與互作蛋白的篩選

1廣西大學農學院/亞熱帶農業生物資源保護與利用國家重點實驗室/植物科學國家級實驗教學示范中心,南寧 530004;2福建省農業科學院亞熱帶農業研究所,福建漳州 363005
以香水檸檬((L.) Burm. F.)為研究對象,分析兩個的時空表達規律,利用酵母雙雜交技術和雙分子熒光互補試驗(BiFC)篩選、驗證其互作蛋白,為深入研究在香水檸檬自交不親和過程中的分子作用機制奠定基礎。從前期轉錄組和泛素修飾組(未公開)篩選獲得2個E3泛素連接酶RHF2A(RING-H2 Zinc Finger2A)基因-1、-2,并克隆其全長序列,通過生物信息學分析2個的序列和蛋白質結構,預測其啟動子順式作用元件,構建35S-RHF2A-GFP融合蛋白表達載體用于亞細胞定位分析,采用實時熒光定量PCR分析兩個的時空表達模式,構建酵母雙雜誘餌載體從香水檸檬酵母文庫篩選互作蛋白。構建BiFC載體,在洋蔥活體細胞內對目標蛋白進行互作驗證。從香水檸檬克隆獲得、,ORF全長分別為1 161和1 134 bp;NCBI結構域預測發現其具有Ring/U-box結構域。啟動子分析發現其具有花粉特異性表達相關元件POLLEN1LELAT52、GTGANTG10。組織表達分析發現在花粉特異性表達,在葉中特異性表達;時空表達分析結果顯示,在自交柱頭表達量從第1天開始升高,第3天達到峰值,是雜交柱頭表達量的5倍以上。亞細胞定位顯示RHF2A-1和RHF2A-2定位在細胞核。經過Uniprot網站預測其互作蛋白顯示RHF2A能與KRP6、AT3G57370、UBA1、FBL17、SK11蛋白相互作用,推測其參與自交不親和泛素化反應途徑、配子體發育調控、花粉的生長發育等生物學過程。通過酵母雙雜交技術篩選出72個克隆,對其測序并進行Blast比對后排除重復克隆,最終得到ABCF3等20個候選互作蛋白。經過一對一互作驗證、雙分子熒光互補實驗確定RHF2A-1與ABCF3-2存在互作關系。的時空表達規律與自交不親和過程中花粉在雌蕊上的萌發規律相吻合;篩選得到檸檬授粉過程中直接影響花粉生長發育的互作候選蛋白,初步證明在自交不親和過程中具有重要作用。
香水檸檬;RHF2A;基因克隆;時空表達;酵母雙雜交技術
0 引言
【研究意義】自交不親和(self-incompatibility,SI)是植物遺傳過程中一種常見的現象,雌蕊和雄蕊能夠正常發育,但沒有自花授粉結實的功能,有效避免了近親繁殖,從而保證了遺傳多樣性。已證實香水檸檬的無籽特性是由配子體自交不親和引起[1-2],配子體自交不親和性的花粉能在柱頭上萌發,但在花粉管中延伸后遭到抑制。在配子體自交不親和反應中,除了和影響自交不親和特性外[3],泛素化降解途徑也是影響自交不親和的重要因素。已有較多研究報道,SCF復合體泛素途徑降解RNA酶是較為公認的花粉識別機制,是影響自交不親和作用的重要途徑。目前有關影響自交不親和作用的非S基因研究相對較少,課題組前期從香水檸檬泛素修飾組中發掘得到,擬南芥的與自交不親和相關,香水檸檬是否與自交不親和相關尚不清楚,研究探明香水檸檬的表達調控模式及其與其他基因之間的互作關系,有助于深入研究其參與自交不親和的調控機理。【前人研究進展】Ring finger蛋白家族是E3泛素連接酶中的重要組成部分[4],涉及植物中重要的泛素化途徑[5],其中編碼的E3泛素連接酶蛋白具有Ring/U-box結構域并參與蛋白質泛素化的途徑。在擬南芥中,、的雙突變體會導致雌雄配子體發育受阻,、的功能缺失會導致細胞周期的負調控因子泛素化降解受到抑制,使其蛋白積累增多,造成配子發育受阻的現象[6-7];研究發現,擬南芥具有Ring/U-box保守結構域的Ring finger E3泛素連接酶ARC1是SRK激酶的下游信號傳遞因子,在結合底物后能與同源的E2互作,將底物泛素化降解后導致自交不親和[8-10];SAMUEL等[11]發現S位點的受體激酶與具有Ring/U-box結構域的ARM蛋白相互作用,是導致自交不親和的成因;與蜜柚CgRHF1同源的蛋白AtXERICO能與UBC8(泛素結合酶8)、ASK1- interacting F-box protein(TLP9)、At2g31470(F-box 家族蛋白)等互作[10],且該基因有可能影響SCF復合體的合成,保持S-RNase的核酸酶活性,從而降解花粉管中的RNA,抑制花粉管生長,最終導致自交不親和反應。李慧敏等[12]在沙田柚中克隆得到一個,推測其可能在自交不親和泛素識別底物過程中扮演重要角色。唐文武等[13]從無籽、有籽砂糖橘中克隆出CrU-box基因,比較該基因在無籽、有籽砂糖橘中的差異,初步推測無籽砂糖橘突變以及自交授粉后高水平表達可能是導致自交不親和形成的原因之一。【本研究切入點】前人研究發現編碼的E3泛素連接酶蛋白具有Ring/ U-box結構域并參與蛋白質泛素化的途徑,RHF2A蛋白可能在對果實發育、逆境脅迫、配子體發育等方面發揮作用,無籽砂糖橘、沙田柚與自交不親和相關,香水檸檬具有自交不親和特性,前期從香水檸檬泛素修飾組篩選出中2個具有Ring/U-box結構域,但這2個基因是否與自交不親和相關尚不清楚,有待深入研究。【擬解決的關鍵問題】克隆、,研究其組織表達和時空表達特性,探明這2個基因表達規律;構建酵母雙雜交誘餌載體,從香水檸檬酵母文庫篩選互作蛋白并進行驗證,構建BiFC表達載體,在洋蔥活體細胞內進行互作驗證,初步明確互作關系;綜合分析鑒定該基因是否真正參與泛素化進而參與自交不親和作用,為深入研究在香水檸檬自交不親和過程中的作用機制奠定基礎。
1 材料與方法
試驗于2021—2022年在廣西大學農學院/亞熱帶農業生物資源保護與利用國家重點實驗室進行。
1.1 試驗材料
1.1.1 植物材料 對種植于廣西大學農學院果園的8年生香水檸檬植株的花去雄,進行自交授粉處理(香水檸檬♀×香水檸檬♂)和雜交授粉處理(香水檸檬♀×白花檸檬♂)并套袋。采集香水檸檬自交后和雜交后0、10 h、20 h、1 d、2 d、3 d、4 d的柱頭、花柱、子房樣品及各組織樣品(葉、柱頭、花柱、子房、花藥、花絲、花瓣、花托),采集的樣品立即放入-80℃冰箱中凍存備用。
1.1.2 試驗試劑及載體 高保真酶(武漢全式金公司),X-α-Gal、AbA,熒光定量PCR專用酶(大連TaKaRa公司),DNA膠回收試劑盒、質粒DNA抽提試劑盒、克隆載體pDM18-T、dNTP(上海生工生物工程股份有限公司),Marker(廣西南寧壹棵松生物科技有限公司),酵母質粒提取試劑盒(北京天根生物公司)。
1.2 RHF2A的克隆與生物信息學分析
采用HiPure HP Plant RNA MiNi Kit RNA提取試劑盒(廣州美基生物科技有限公司)提取香水檸檬花器官RNA,保存在-80℃冰箱,根據反轉錄試劑盒(大連TaKaRa公司)說明書合成cDNA。根據從香水檸檬泛素修飾組和轉錄組[14]挖掘出的兩個參與泛素化的序列設計引物,以cDNA為模板進行PCR擴增,回收符合預期的條帶并純化,將純化后的膠回收產物與pMD18-T載體連接轉入大腸桿菌感受態DH5α(武漢全式金公司),涂板后對菌落進行PCR檢測,送至廣州擎科生物公司測序。
使用BioXM2.6軟件將核苷酸序列翻譯成氨基酸序列,從NCBI上Protein BLAST獲得其他物種的同源氨基酸序列,DNAMAN6.0進行序列比對和MAGA6構建進化樹,使用NCBI CD-Seach進行保守結構域預測,利用Uniprot網站預測RHF2A互作蛋白,ExPASy預測蛋白質理化性質,利用IBS制作核苷酸結構圖。
通過PLACE和PlantCARE在線數據庫分析預測RHF2A-1和RHF2A-2啟動子順式作用元件后,用TBtools[15]進行可視化分析。
1.3 RHF2A表達模式分析
明確在香水檸檬自交、雜交授粉后不同時段和在雌蕊不同組織中的表達模式,以及在香水檸檬不同花組織中的表達模式。根據、序列設計特異性引物(表1),通過qRT-PCR對、的表達量進行檢測。反應體系及程序參照WANG等[16],以[17]為內參基因,采用2-ΔΔCT方法對數據進行整理[18]。使用IBM SPSS Statistics 24.0進行數據處理。
1.4 RHF2A的亞細胞定位
采用pBI221載體,去掉目的基因序列的終止密碼子后采用雙酶切法(H I和I)構建pBI221---EGFP和pBI221---EGFP載體(武漢金開瑞生物工程有限公司),以pBI221-EGFP載體為對照,同時進行轉化農桿菌感受態EHA105(上海昂羽生物公司)。采用新鮮洋蔥進行亞細胞定位,具體方法參照劉海燕等[19]。
1.5 酵母感受態的制備及自激活檢測
按照Y2HGold/Y187酵母感受態(上海昂羽生物公司)說明書轉化載體。用1 mL ddH2O重懸,吸取100 μL涂布在相應的缺陷培養基(SD/-Trp;SD/-Leu),29℃倒置培養48—96 h。
挑取單菌落,用相應的液體培養基(SD/-Trp;SD/-Leu)培養24—36 h,PCR檢測驗證后加入同等體積的酵母凍存液(YPDA液體培養基﹕甘油比例= 3﹕1),保存于-80℃用于后續試驗。

表1 PCR引物列表
將制備好的pGBKT7-RHF2A-1、pGBKT7-RHF2A- 2稀釋1/10、1/100、1/1000后吸取100 μL分別涂布在SD/-Trp、SD/-Trp/X-α-Gal(-Trp/X,X-α-Gal濃度為200 ng·mL-1)、SD/-Trp/X-α-Gal/AbA(-Trp/X/A,AbA濃度為500 μg·mL-1),在30℃倒置培養3—5 d后觀察菌落生長狀態。
1.6 酵母雙雜交篩選互作蛋白
酵母雙雜交試驗按照MatchmakerTMGold Yeast Two-Hybrid System User Manual(TaKaRa)操作手冊進行,酵母雙雜交試驗使用文庫為前期實驗室構建的香水檸檬均一化cDNA文庫,具體步驟參照操作手冊進行。挑取菌斑,采用T7/3AD引物進行PCR鑒定,反應程序參照WANG等[16]。將產物測序,經NCBI比對測序結果,挑選重要互作蛋白加入酵母凍存液,置于-80℃保存。
1.7 互作候選基因組織表達分析
對通過酵母雙雜交篩選出的重要互作蛋白進行組織表達分析,具體方法同1.3。
1.8 候選Prey蛋白一對一驗證
提取篩選出的重要蛋白的酵母質粒,轉入感受態DH5α,涂布在LB固體培養基上,37℃培養12—16 h,挑取培養基上的單菌落進行PCR鑒定,再提取大腸桿菌質粒(pGADT7-prey)。
參照1.5方法,將Bait質粒與Prey質粒分別共轉入Y2H Gold/Y187酵母感受態細胞中,挑單菌落用2×YPDA液體培養基在30℃過夜共培養。用槍頭吸取7 μL點在SD/-Trp/-Leu/-His/-Ade/X/A(Q/X/A)固體培養基上,倒置放入30℃培養箱中培養3—5 d,觀察菌落生長狀況。
1.9 雙分子熒光互補試驗
參照GV3101感受態(上海昂羽生物公司)轉化說明書,將puc-sPYNE-RHF2A-1、puc-sPYCE-ABCF3-2載體轉入GV3101感受態。將活化后的目的基因接種到LB液體培養基(含相應抗生素)中,28℃振蕩培養過夜,搖濃后按1﹕1等體積混合培養1 d。將搖濃的菌液8 000 r/min離心5 min棄上清液,加MS液體培養基(含乙酰丁香酮和MgCl2)稀釋至OD600=0.7— 1.0為最佳。將新鮮洋蔥表皮放到混合液中侵染20—30 min,取出洋蔥表皮平鋪于MS固體培養基,光照培養16 h后在共聚焦掃描顯微鏡中觀察熒光[20]。
2 結果
2.1 香水檸檬RHF2A的cDNA克隆與序列分析
2.1.1的cDNA克隆與序列分析 根據香水檸檬泛素修飾組和轉錄組挖掘出的兩個參與泛素化的,分別命名為、-2。基因序列設計克隆引物,以香水檸檬的cDNA為模板擴增出兩條長度約為1 100 bp的條帶(圖1),測序分析其開放閱讀框長度分別為1 161 bp和1 134 bp,、-2的核苷酸相似性為65.55%,與香水檸檬基因組(未公開)中的和-2序列一致,RHF2A-1和RHF2A-2分別編碼386個氨基酸和378個氨基酸,RHF2A-1、RHF2A-2的氨基酸相似性為58%,RHF2A-1、RHF2A-2編碼蛋白的理化性質見表2,兩個基因編碼的蛋白不穩定系數都大于40,均為不穩定蛋白,且總平均親水性都為負值,預測該蛋白為親水蛋白。
2.1.2 RHF2A系統進化樹分析 從柑橘基因組數據庫和NCBI下載RHF2A-1和RHF2A-2同源氨基酸序列,構建RHF2A系統發育進化樹顯示,RHF2A-1和RHF2A-2分為兩類,且都與克里邁丁橘()、甜橙()RHF2A的聚類最近(圖2)。
根據香水檸檬染色體注釋信息,通過MG2C在線軟件繪制香水檸檬在染色體中的定位圖;IBS制作DNA結構圖。結果顯示,-和-分別定位在8號和4號染色體上,都同樣具有7個內含子和6個外顯子(圖3)。
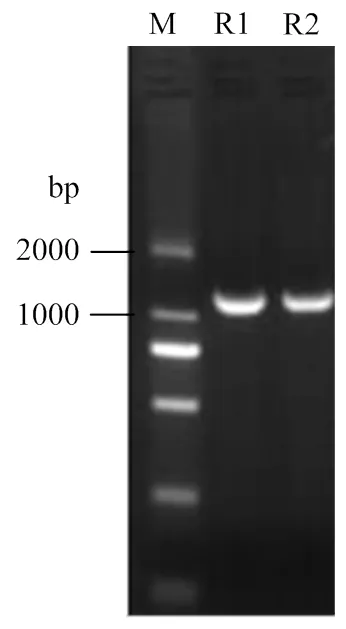
圖1 RHF2A-1和RHF2A-2電泳圖
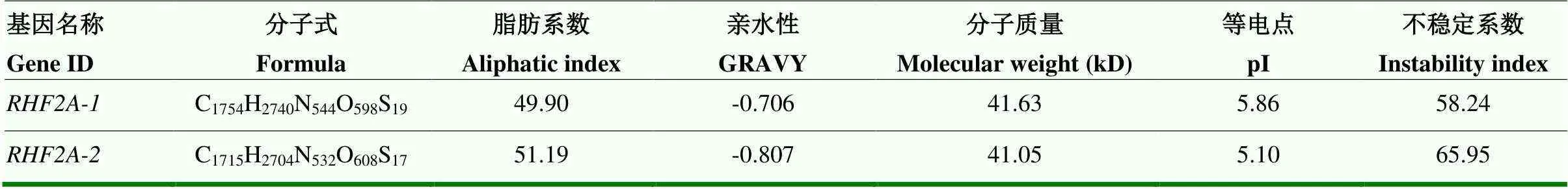
表2 RHF2A-1和RHF2A-2蛋白理化性質分析
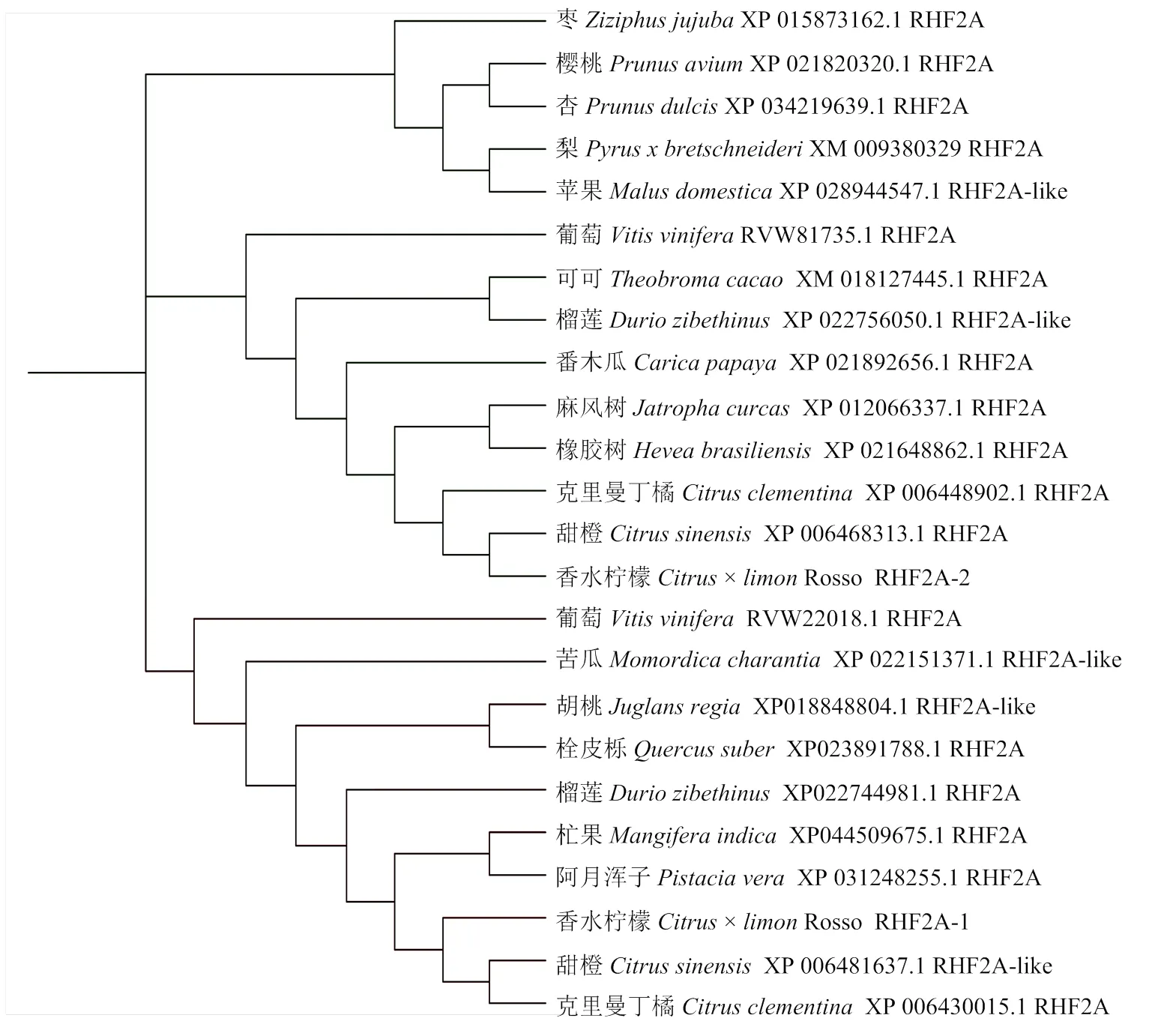
圖2 RHF2A同源基因氨基酸系統發育進化樹
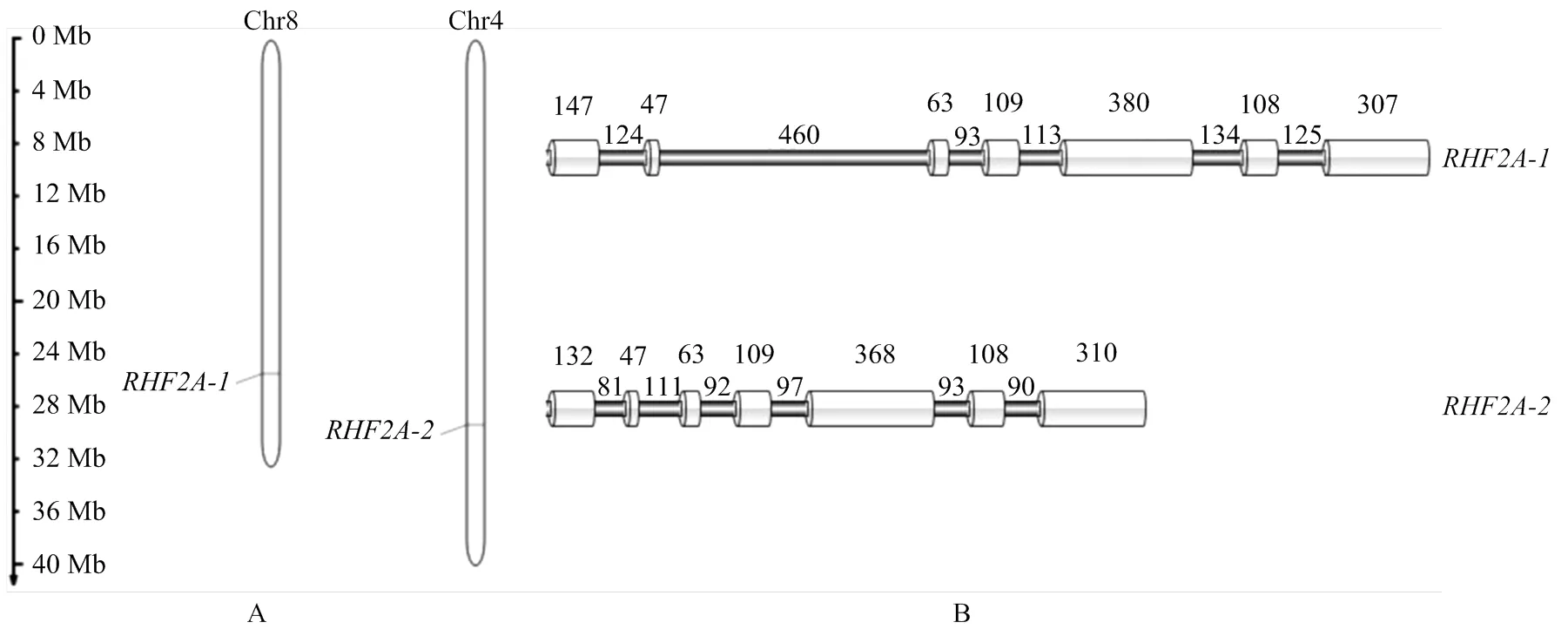
A:基因在染色體上的定位圖;B:DNA結構圖;圓柱形表示外顯子,橫線表示內含子
2.2 啟動子順式元件分析
利用PLACE和PlantCARE在線軟件分別預測-、-ATG上游-2.0 kb區域的啟動子順式作用元件。結果顯示,兩個啟動子序列都包含兩個相同的花粉基因特異性表達相關元件:GTGANTG10、POLLEN1LELAT52,而花粉基因特異性表達相關元件AAATGA只存在于-的啟動子中[20-21]。除此之外,還存在赤霉素響應元件、細胞分裂素響應元件、生長素響應元件、茉莉酸響應元件等激素相關的順式作用元件(圖4)。

圖4 RHF2A-1和RHF2A-2啟動子順勢元件分析
2.3 RHF2A-1和RHF2A-2表達模式分析
通過實時熒光定量測定兩個基因在花藥、花絲、柱頭、花柱、子房、花瓣、花托、葉中的表達量。結果顯示,-在花藥中特異表達,-在葉中特異性表達(圖5),說明-可能與花粉發育有關。
-在自交授粉1 d時的柱頭中的表達量開始上升,到第3天時達到一個最大值,是0 h的5倍以上。雜交授粉中-不同時段表達差異不明顯,且表達量低于自交授粉;自交授粉在花柱中1 d時達到峰值,且是0 h段雜交授粉表達量的60倍以上;在子房中,自交授粉和雜交授粉的表達量呈下降趨勢,且趨勢也大致相同。-在自交授粉和雜交授粉柱頭和花柱中表達差異小,且隨時間表達變化小;子房中-表達量呈上升趨勢,但與雜交授粉表達差異不大(圖6)。以上結果說明,-很可能參與自交不親和作用。
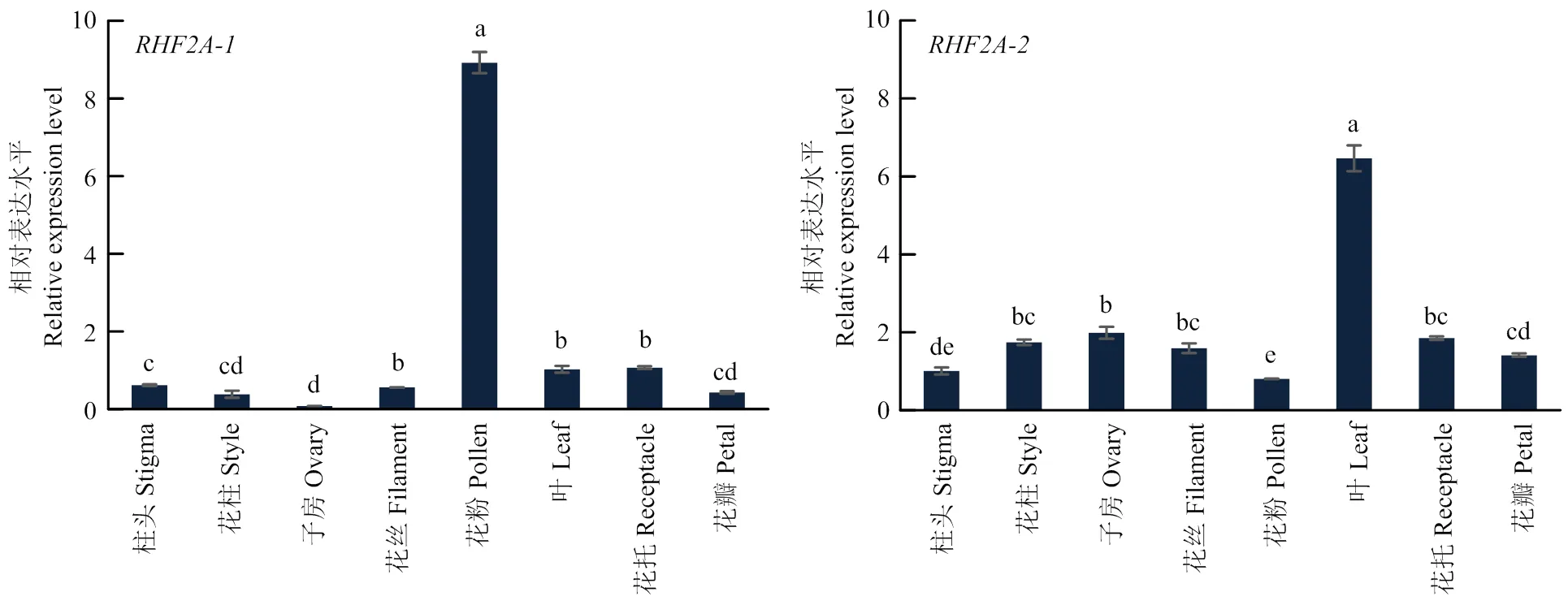
不同小寫字母表示0.05水平差異顯著。下同 Different lowercase letters represent significant difference at 0.05. The same as below
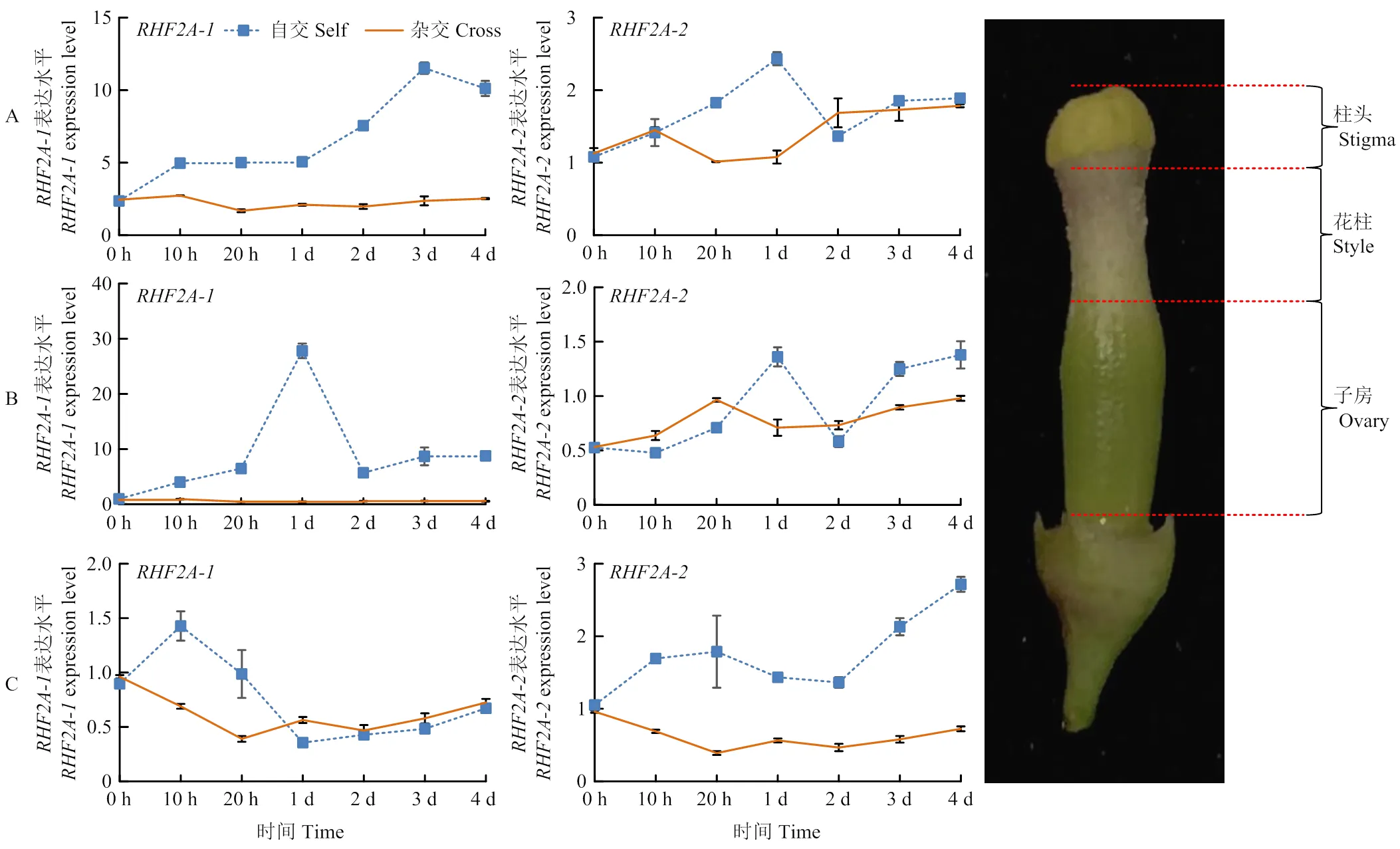
A、B、C分別為柱頭、花柱、子房的基因時空表達模式
2.4 RHF2A-1和RHF2A-2蛋白的亞細胞定位
通過農桿菌介導法將構建的ClRHF2A-1-GFP和ClRHF2A-2-GFP融合表達載體瞬時表達于洋蔥表皮細胞。在熒光共聚焦顯微鏡下,觀察到兩個基因均定位在細胞核上(圖7)。
2.5 誘餌載體構建和自激活檢測
轉化酵母RHF2A-1、RHF2A-2在SD/-Trp上正常生長為粉色,在SD/-Trp/X-α-gal上正常生長為粉色,在SD/-Trp/X-α-gal/AbA上不生長(圖8),說明RHF2A-1、RHF2A-2不自激活,可以進行下一步試驗。
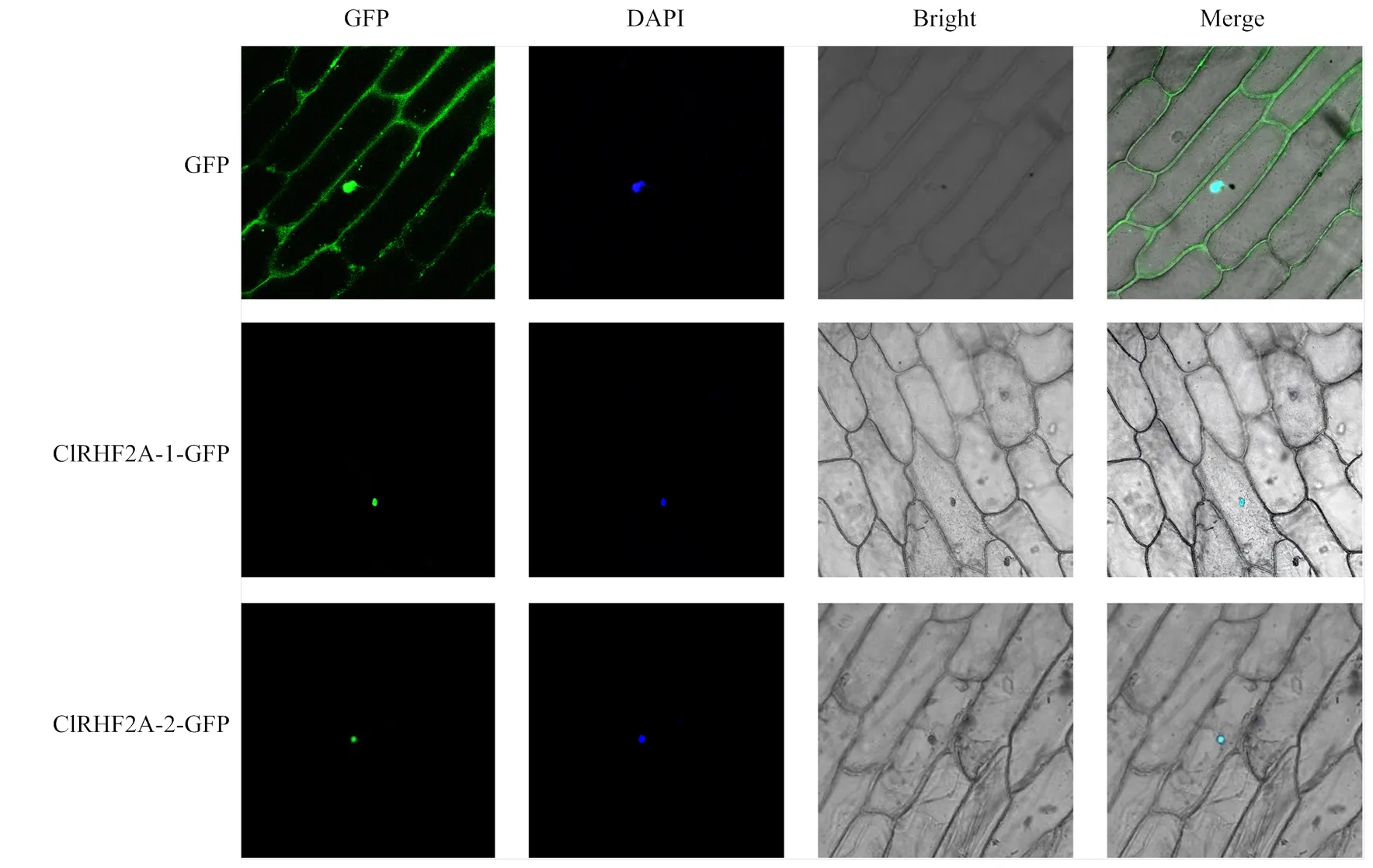
圖7 RHF2A-1和RHF2A-2蛋白在洋蔥中的亞細胞定位分析(標尺=100 μm)

圖8 RHF2A-1和RHF2A-2蛋白的自激活檢測
2.6 酵母雙雜交篩選互作蛋白及互作候選蛋白的功能注釋
將Bait酵母與文庫混合培養,涂布在QDO(SD/ -Leu/-Trp/-His/-Ade)培養基上,分別長出72和14個克隆,再挑單菌落在Q/X/A(SD/-Leu/-Trp/-His/-Ade/ X-α-gal/AbA)固體培養基上劃線擴大培養,將在平板上變藍的菌斑進行PCR鑒定后測序,排除重復克隆后挑選重要克隆列出如表3,將第二次篩選得到的重要克隆接種到Q/X/A固體培養基上進行第3次篩選,RHF2A-1篩選到20個陽性克隆,RHF2A-2篩選得到8個陽性克隆(圖9)。
將28個陽性克隆的PCR產物測序,將測序結果利用NCBI進行Blast比對分析,RHF2A-1篩選結果包括S-腺苷甲硫氨酸合酶2(adenosylmethionine synthase 2)、赤霉素受體GID1B(gibberellin receptor GID1B)、異質核核糖核蛋白1(ribonucleoprotein 1)、E3泛素蛋白連接酶RGLG2(E3 ubiquitin-protein ligase RGLG2)、bZIP轉錄因子17(bZIP transcription factor 17)、天冬氨酸蛋白酶A1(aspartic proteinase A1)、莖特異蛋白TSJT1(stem-specific protein TSJT1)、水稻開花位點T1(RICE FLOWERING LOCUS T 1)、蘋果酸脫氫酶(malate dehydrogenase)、天冬氨酸蛋白酶(aspartic proteinase)、FBA6、RING-H2 finger protein ATL39、ABCF3轉運蛋白(ABC transporter F family member 3)、AP-1 complex subunit mu-2、KH結構域蛋白HEN4(KH domain-containing protein HEN4)、SEC10b、TBCC、蛋白磷酸酶2C 56(protein phosphatase 2C 56)。利用網站Uniprot分別對候選蛋白進行Gene Ontology(GO)注釋,結果如表3所示,20個互作候選蛋白分別具有激素調節、影響花粉發育、花粉管伸長、泛素連接酶活性、泛素結合酶活性、氧化還原酶活性、花期調控、物質跨膜運輸、細胞形態發生等生物功能。特別篩選到ABCF3轉運蛋白與S-RNase跨膜運輸有關,而S-RNase是自交不親和的關鍵酶。
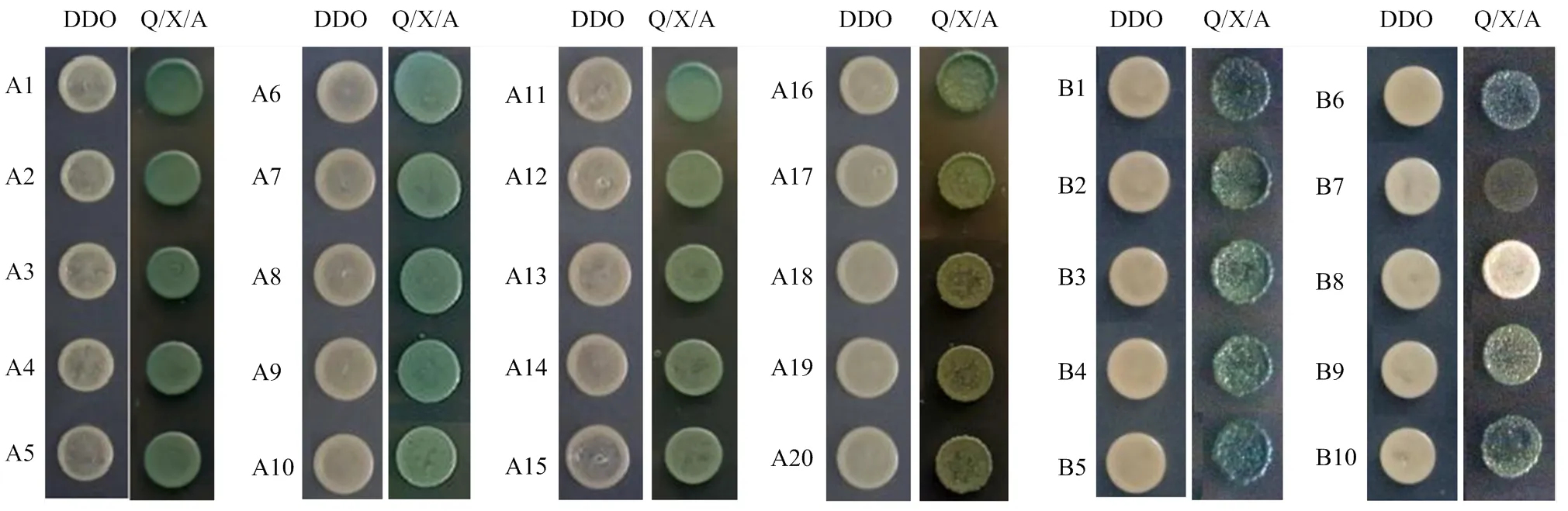
圖9 生長在DDO或QDO/X/A平板上的陽性克隆(A與B分別為RHF2A-1和RHF2A-2的篩選結果)
RHF2A-2篩選結果包括糖蛋白葡萄糖基轉移酶(UDP-glucose:glycoprotein glucosyltransferase)、液泡相關蛋白13F(sorting-associated protein 13F)、bZIP轉錄因子17(bZIP transcription factor 17)、生長素誘導蛋白PCNT115(auxin-induced protein PCNT115)、光系統II反應中心PSB28蛋白(photosystem II reaction center PSB28 protein)、AP-1 complex subunit mu-2、30S核糖體蛋白3-1(30S ribosomal protein 3-1)、蛋白質LEO1同系物(protein LEO1 homolog)、probable ubiquitin-conjugating enzyme E2 C、S-腺苷甲硫氨酸合酶 2(S-adenosylmethionine synthase 2)。8個互作候選蛋白分別具有激素調控、花期調控、泛素結合酶活性等生物功能(表4)。
2.7 互作候選基因組織表達分析
篩選得到的ABCF3候選蛋白屬于跨膜蛋白,與S-RNase 跨膜運輸有關。孟冬[22]在蘋果中發現MdABCF(MDP0000170302)與S-RNase存在互作關系,參與S-RNase的跨膜運輸,協同調控蘋果自交不親和反應。通過序列對比發現與為同源基因,進一步從香水檸檬全基因組中找到5個,分別命名為、、、、,互作候選蛋白ABCF3與ABCF3-2序列一致。qRT-PCR結果表明,、在花藥中特異性表達,在雌蕊中相較于葉、花瓣、花萼則高表達(圖10)。
2.8 RHF2A與ABCF一對一互作驗證
從香水檸檬全基因組中得到、、、序列,構建pGADT7-Prey載體,轉入Y187酵母感受態,30℃培養3—5 d,挑取單菌落與誘餌酵母共培養后在Q/X/A上點板驗證。結果顯示RHF2A-1與ABCF3-2互作,其余均不互作(圖11)。
2.9 雙分子熒光互補試驗驗證RHF2A-1與ABCF3-2相互作用
構建雙分子熒光互補載體 puc-sPYNE-RHF2A-1、puc-sPYCE-ABCF3-2,陰性對照為puc-sPYNE-RHF2A- 1+puc-sPYCE-empty,結果如圖12所示。在RHF2A-1與ABCF3-2共轉化后洋蔥的細胞核中檢測到強烈的YFP熒光信號,而在puc-sPYNE-RHF2A-1+puc-sPYCE- empty中沒有觀察到YFP熒光。證明RHF2A-1與ABCF3-2之間存在互作關系。

表3 RHF2A-1所有候選蛋白信息
3 討論
自交不親和是花粉經過花柱表面識別后,通過花粉管沿著花柱生長完成雙受精過程中受到影響而不能完成雙受精過程所導致。因此,花粉沿著花粉管向下延伸的過程中能否正常生長發育在自交不親和作用中是至關重要的影響因素。
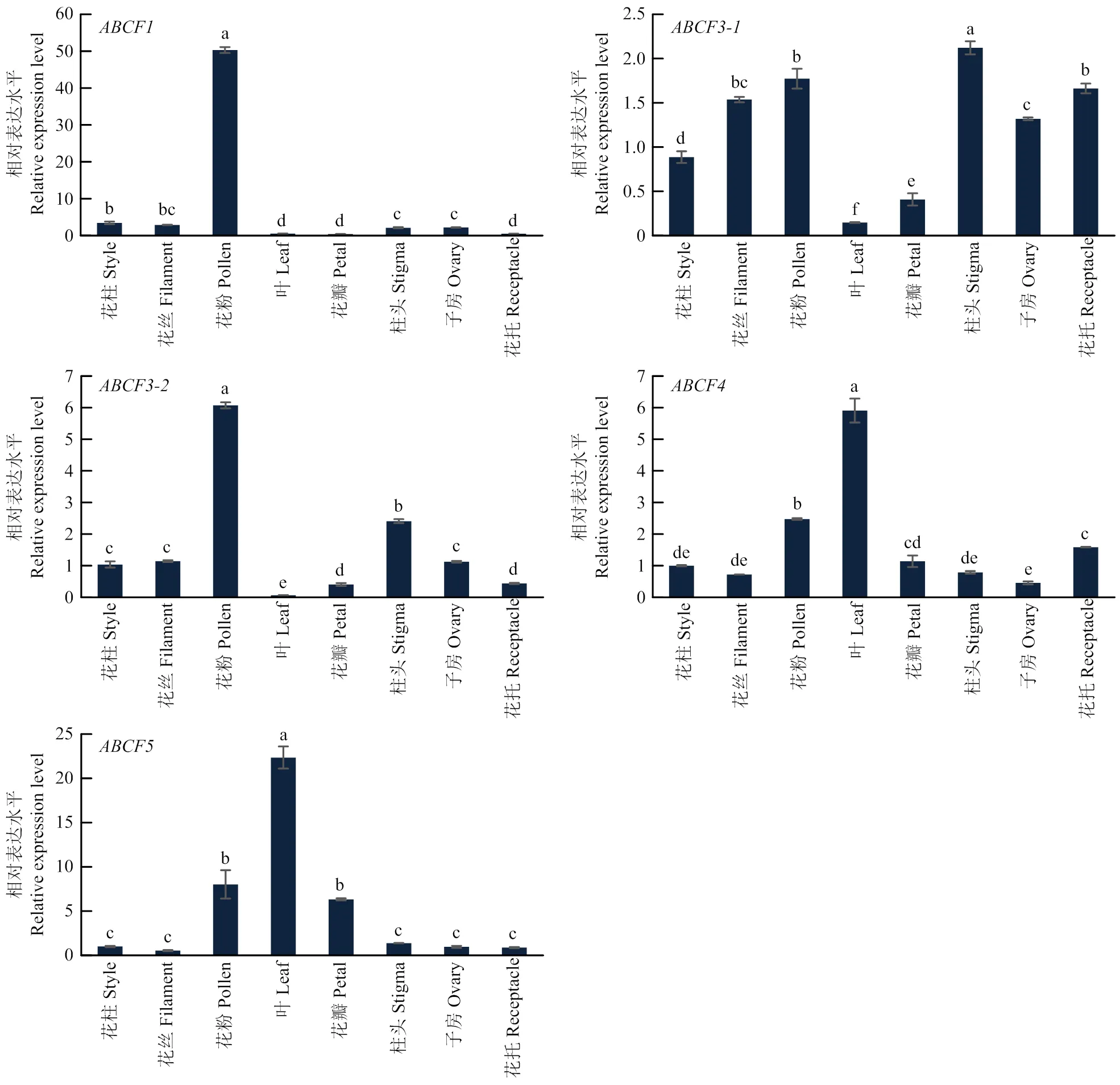
圖10 ABCF的組織表達分析
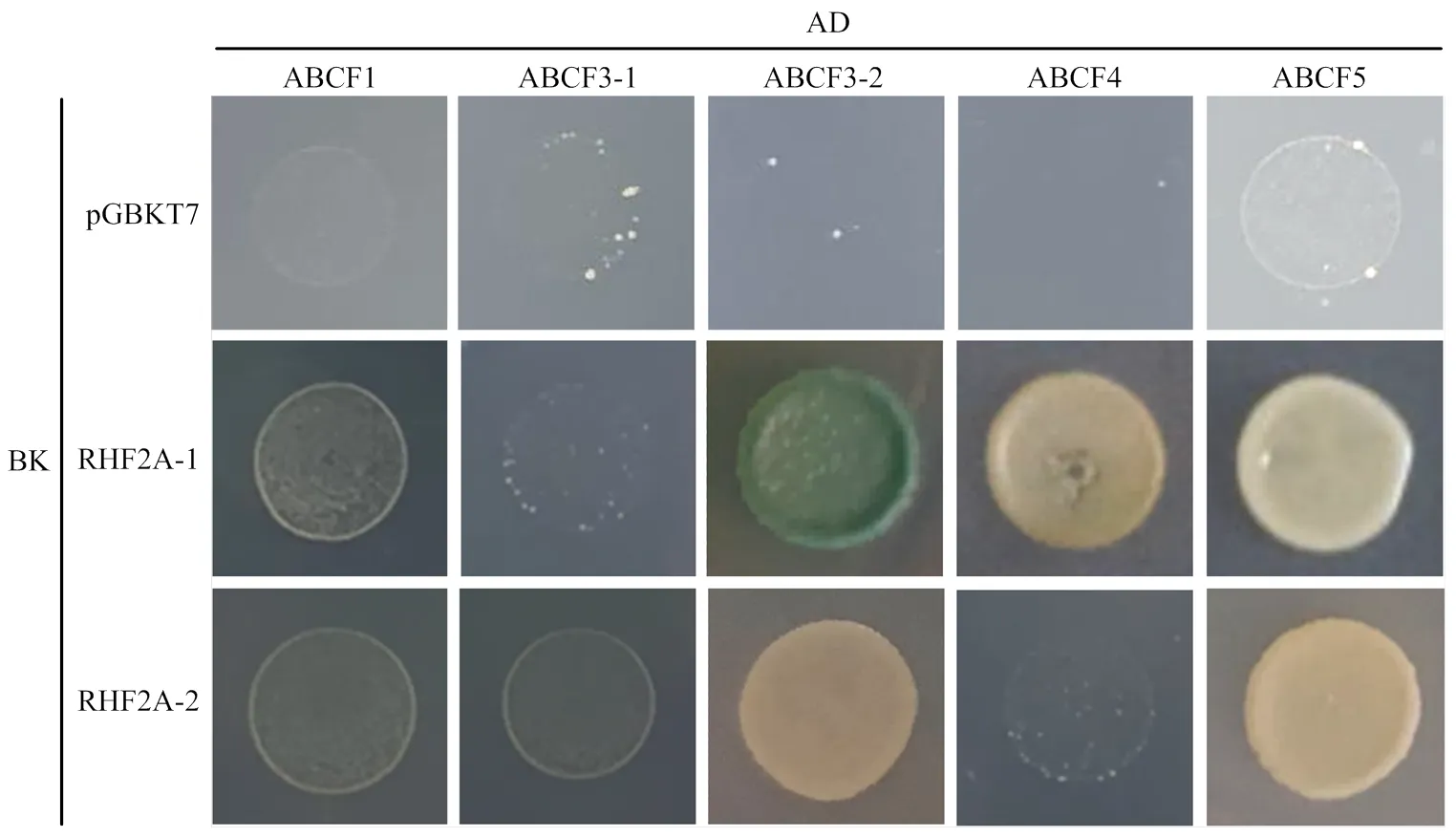
圖11 ClRHF2A-1與ClABCF蛋白的一對一互作驗證
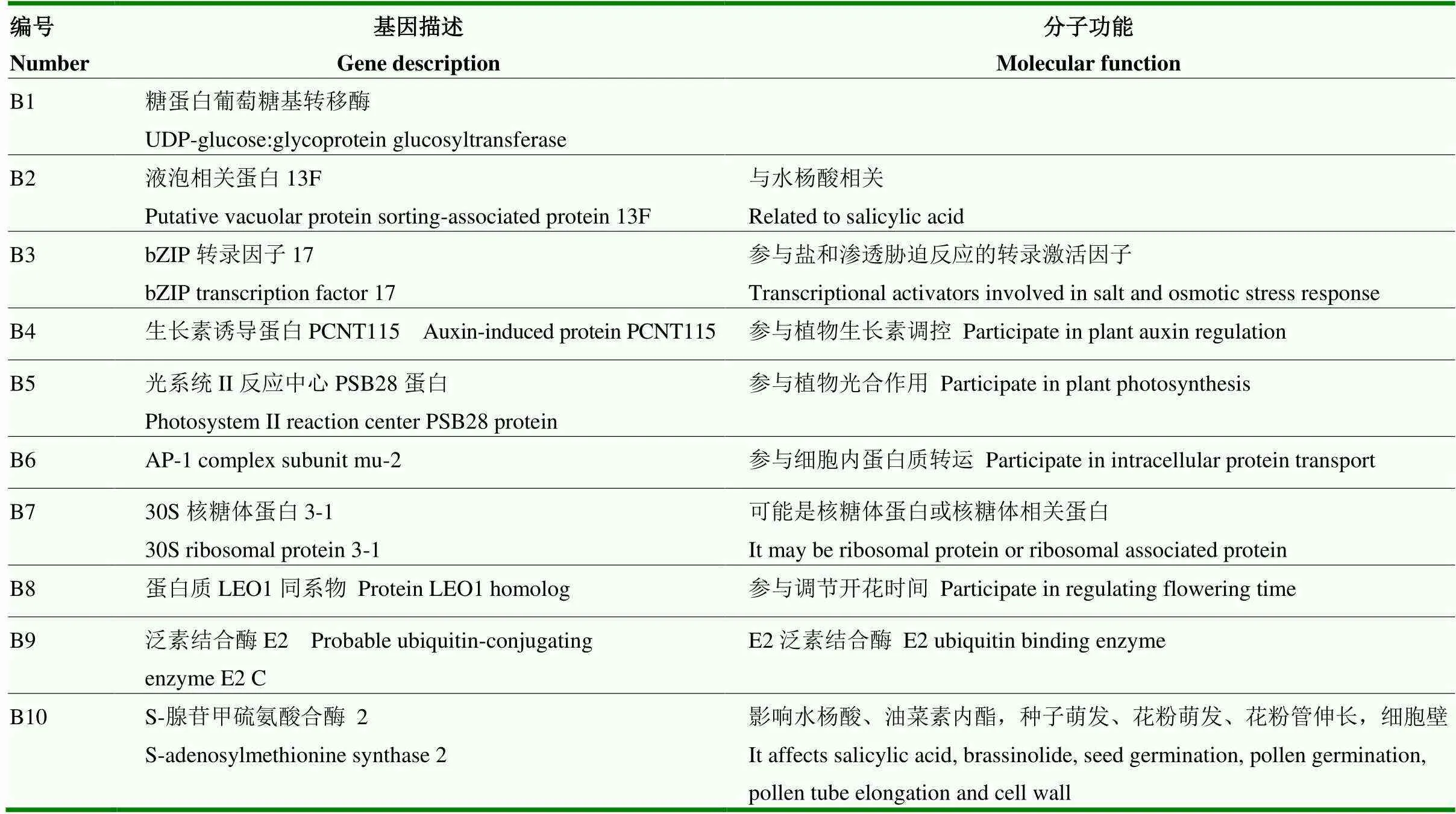
表4 RHF2A-2所有候選蛋白信息
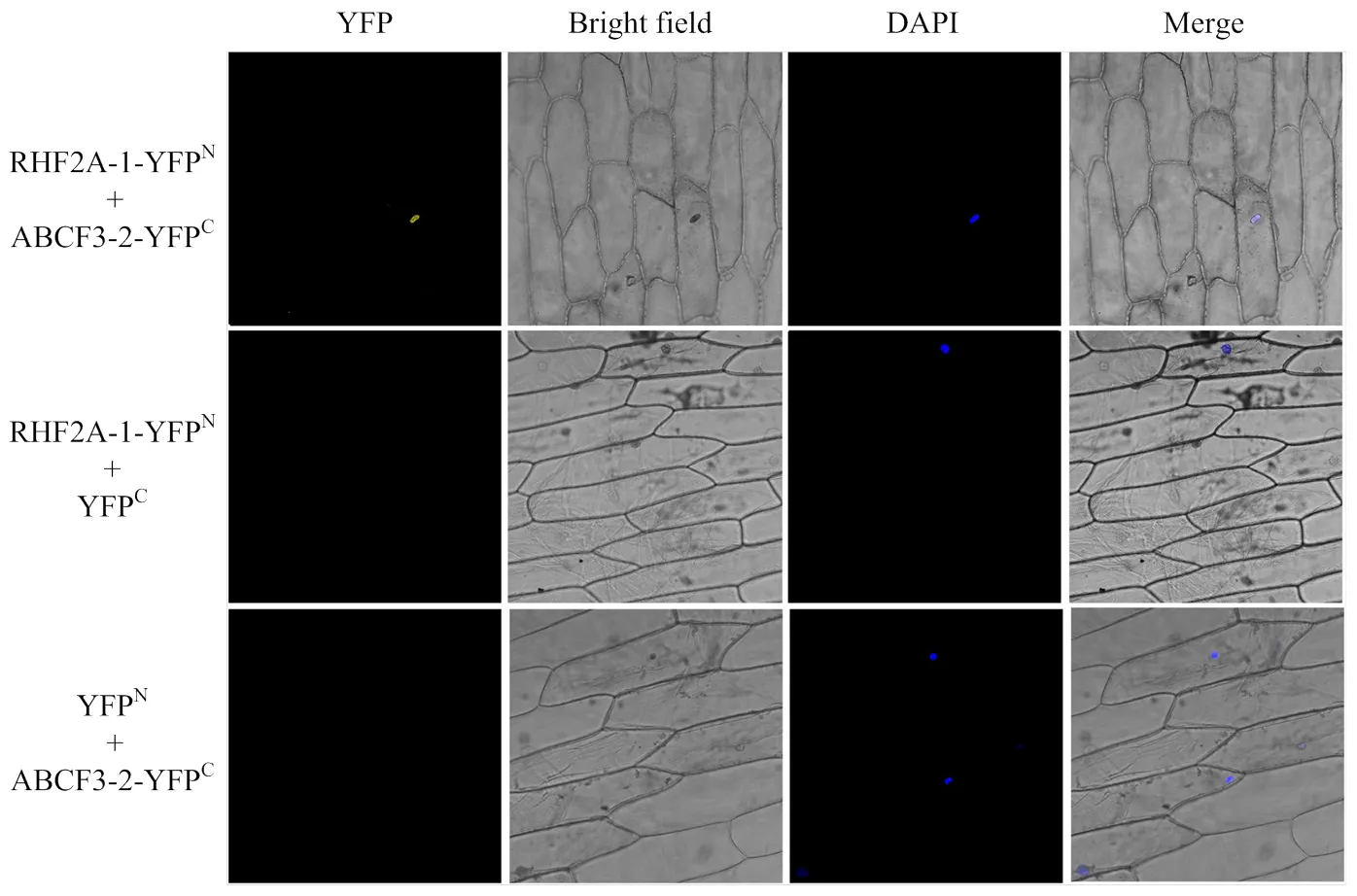
圖12 在洋蔥中用BiFC方法驗證RHF2A-1與ABCF3-2互作(標尺=100 μm)
3.1 RHF2A-1 和RHF2A-2 的基因序列分析
在擬南芥中,是作用于細胞周期的調控因子,參與配子體的形成和發育,功能缺失會引起配子體發育受阻,從而影響花粉正常發育[8]。從授粉后的香水檸檬雌蕊泛素修飾組中發掘得到的、在多種植物中高度保守,且在N端具有穩定的Ring/U-box結構域。分析其啟動子順勢元件發現,和都包含在花粉中特異性表達相關元件POLLEN1LELAT52[23-24]、GTGANTG10[25],啟動子含有AAATGA花粉特異性表達元件,而中未發現。推測可能在花粉中特異性表達,參與到花粉的生長發育。除此之外,啟動子部分包含各類激素響應元件,這表明該基因可能受到多種激素影響。前人研究中,IAA和GA3對花粉管的生長具有促進作用,而ABA可以抑制花粉管生長[26-28]。但有關激素與香水檸檬表達的關系尚不清楚,有待深入研究。
3.2 RHF2A-1和RHF2A-2的表達模式分析
在花藥中特異性表達,且表達量至少為其他組織表達量的9倍,推測該基因極有可能參與花粉發育。而在葉中特異性表達,且在雌雄蕊表達沒有顯著性差異,可能與自交不親和的關系較小。ZHANG等[29]的研究結果表明,自花和異花授粉的花粉在柱頭上都能夠萌發,并且能夠向下延伸,但24 h后在柱頭下部卷曲,最終不能到達子房,本研究進行的時空表達模式分析結果與其相吻合。在柱頭中,的表達量在1 d的時候上升趨勢顯著,在第3天達到一個峰值,在所有時間段自交授粉的表達量顯著高于雜交授粉。在花柱中,表達量在1 d時顯著上升到一個峰值,大約為0 h的60倍以上。而在子房中,該基因的表達量隨時間的變化,與雜交授粉表達量的變化趨勢沒有顯著性。該結果與Zhang等[29]的研究結果規律一致。而的時空表達模式與授粉后花粉生長模式不相符,在柱頭和花柱中的表達量隨時間變化趨勢不明顯,且在自交授粉和雜交授粉中表達無顯著性差異。因此,推測極大可能參與花粉在授粉過程中的生長發育,從而引起自交不親和。
3.3 RHF2A-1和RHF2A-2互作蛋白的篩選及驗證
ABC轉運蛋白是一類跨膜運輸蛋白,在蘋果中MdABCF被證實參與S-RNase的跨膜運輸并與其相互作用,從而參與自交不親和作用[30]。呂換男等[31]通過對親和的‘金墜’梨和不親和的‘鴨梨’進行蛋白質組學分析,篩選出6個與自交不親和相關的ABC轉運蛋白。賀丹等[32]發現在芍藥遠緣雜交中與內源激素有關,可能誘導激素發生變化,進而影響花粉發育。CHOI等[33]發現能促進花粉壁的形成,Cecchetti等[34]發現參與花藥的形成,且在其中起協同作用。本研究篩選到的與蘋果中為同源基因,序列相似度為83%,在香水檸檬花粉中的特異性表達結果也與在蘋果中的表達模式一致,的作用很可能與在蘋果中的作用相同,參與S-RNase的跨膜運輸。且在泛素修飾組中發現了,說明同樣參與了泛素途徑。因此,推測RHF2A-1與ABCF3-2相互作用,很可能在泛素化過程中協助ABCF3-2轉運大分子物質,但其調控機理還需進一步深入研究。
4 結論
通過前期泛素修飾組和轉錄組篩選克隆得到兩個,該基因具有穩定的Ring/U-box結構域。在啟動子部分發現含有花粉中特異性表達相關元件AAATGA,而啟動子中不含有該元件。在花藥中特異性表達;時空表達模式分析發現在自交授粉的柱頭和花柱中表達量顯著高于雜交授粉,子房中無明顯表達差異。利用RHF2A-1篩選得到20個候選蛋白,包括S-腺苷甲硫氨酸合酶、L-抗壞血酸氧化酶同系物、天冬氨酸蛋白酶、ABCF轉運蛋白1、TBCC等。RHF2A-1與ABCF3-2存在互作關系,RHF2A-1很可能參與到ABCF3-2的轉運過程中,共同調控花粉的生長發育及影響自交不親和大分子物質跨膜運輸過程。
[1] 張樹偉. 香水檸檬無籽成因和相關基因的分離與鑒定[D]. 南寧: 廣西大學, 2014.
ZHANG S W. Causes of Seedless Forming and Identifiction of Seedless Related Genes from ‘Xiangshui’ lemon [D]. Nanning: Guangxi University, 2014. (in Chinese)
[2] 梁梅. 柑橘自交不親和相關基因鑒定及其演化[D]. 武漢: 華中農業大學, 2019.
LIANG M.Gene identification and evolution of self-incompatibility of citrus [D]. Wuhan: Huazhong Agricultural University, 2019. (in Chinese)
[3] LIN W, ZHANG S W, DING F, HE X H, LUO C, HUANG G X, D M, WANG Q, YANG Z Y, SU L, HU G B. Two Genes (ClS1 and ClF-box) Involved the Self-Incompatibility of “Xiangshui” Lemon ((L.) Burm. F.). Plant Molecular Biology Reporter, 2019, 37(1/2): 50-62.
[4] 錢澤勇, 張會龍, 荊曉姝, 申澤丹, 鄧澍榮, 趙瑞, 沈昕, 陳少良. 胡楊Ring finger E3連接酶PeRH2提高煙草耐旱機制研究. 基因組學與應用生物學, 2015, 34(3): 454-463.
QIAN Z Y, ZHANG H L, JING X S, SHEN Z D, DENG S R, ZHAO R, SHEN X, CHEN S L. Overexpression of ring finger E3-1igase Gene PeRH2 fromin tobacco enhances drought tolerance in transgenic plants. Genomics and Applied Biology, 2015, 34(3): 454-463. (in Chinese)
[5] XU R Q, LI Q Q. A RING-H2 zinc-finger protein gene RIE1 is essential for seed development in Arabidopsis. Plant Molecular Biology, 2003, 53(1/2): 37-50.
[6] 劉敬婧. 擬南芥RING-finger家族成員RHF1a和RHF2a的功能研究[D]. 北京: 北京大學, 2007.
LIU J J. Two novel RING-finger proteins RHFla and RHF2a are essential for cell cycle progression during gametophyte development in[D]. Beijing: Peking University, 2007. (in Chinese)
[7] LIU J J, ZHANG Y Y, QIN G J, TSUGE T, SAKAGUCHI N, LUO G, SUN K T, SHI D Q, AKI S, ZHENG N Y, AOYAMA T, OKA A, YANG W C, UMEDA M, XIE Q, GU H Y, QU L J. Targeted degradation of the cyclin-dependent kinase inhibitor ICK4/KRP6 by RING-type E3 ligases is essential for mitotic cell cycle progression during. Plant Cell. 2008, 20(6): 1538-1554.
[8] BU Q Y, Li H M, ZHAO Q Z, JIANG H L, ZHAI Q Z, ZHANG J, WU X Y, SUN J Q, XIE Q, WANG D W,LI C Y. TheRING finger E3 ligase RHA2a is a novel positive regulator of abscisic acid signaling during seed germination and early seedling development. Plant Physiology, 2009, 150(1): 463-481.
[9] LI H M, JIANG H L, BU Q Z, ZHAO Q Y, SUN J Q, XIE Q, LI C Y. The Arabidopsis RING finger E3 ligase RHA2b acts additively with RHA2a in regulating abscisic acid signaling and drought response. Plant Physiology, 2011, 156(2): 550-563.
[10] INDRIOLO E, GORING D R. A conserved role for the ARC1 E3 ligase in Brassicaceae self-incompatibility. Frontiers in Plant Science, 2014, 5: 181.
[11] SAMUEL M A, MUDGIL Y, SALT J N, DELMAS F, RAMACHANDRAN S, CHILELLI A, GORING D R. Interactions between the S-Domain Receptor Kinases and AtPUB-ARM E3 Ubiquitin Ligases Suggest a Conserved Signaling Pathway in Arabidopsis. Plant Physiology, 2008, 147(4): 2084-2095.
[12] 李慧敏, 羅瓊, 肖君, 李少梅, 劉華英, 秦新民. 沙田柚RING-H2 finger基因的生物信息學分析. 生物信息學, 2017, 15(3): 149-155.
LI H M, LUO Q, XIAO J, LI S M, LIU H Y, QIN X M. Bioinformatics analysis of RING H2 finger gene from Citrus grandis var. Shatianyu Hort. Chinese Journal of Bioinformatics, 2017, 15(3): 149-155. (in Chinese)
[13] 唐文武, 莫燦坤, 吳秀蘭. 無籽沙糖桔E3泛素連接酶U-box基因的克隆及表達分析. 江西農業大學學報, 2018, 40(2): 383-388.
TANG W W, MO C K, WU X L. Cloning and Expression Analysis of U-boxgene,an E3 Ubiquitin Ligase, in ‘Wuzhishatangju’ (Citrus reticulata Blanco). Acta Agriculturae Universitatis Jiangxiensis, 2018, 40(2): 383-388. (in Chinese)
[14] ZHANG S W, Ding F, He X H, LUO C, HUANG G X, HU Y. Characterization of the ‘Xiangshui’ lemon transcriptome by de novo assembly to discover genes associated with self-incompatibility. Molecular Genetics & Genomics: Mgg, 2015, 290(1): 365-375.
[15] CHEN C J, XIA R, CHEN H, HE Y H. TBtools, a Toolkit for Biologists integrating various HTS-data handling tools with a user-friendly interface. 2018.
[16] WANG Y H, HE X H, YU H X, MO X, FAN Y, FAN Z Y, XIE X J, LIU Y, LUO C. Overexpression of fourgenes from mango delays the flowering time in transgenic Arabidopsis. BMC plant biology, 2021, 21(1): 407.
[17] LIN W, DO M , WEI M, HE X H, LIU Y, FAN Z Y, ZHANG S W, LUO C, HUANG G X, HU G B. ClPLD5, a phospholipase gene is involved in protection of cytoskeleton stability in pollen of self- imcompatible ‘Xiangshui’ Lemon (). Plant Cell, Tissue and Organ Culture, 2020, 143(1): 61-73.
[18] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative pcr and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[19] 劉海燕, 馮冬茹, 劉兵, 何炎明, 王宏斌, 王金發. 農桿菌介導的MpASR蛋白在洋蔥表皮細胞的定位研究. 熱帶亞熱帶植物學報, 2009, 17(3): 218-222.
LIU H Y, FENG D R, LIU B, HE Y M, WANG H B, WANG J F. Studies on subcellular localization of MpASR in onion epidermal cells mediated by agrobacterium. Journal of Tropical and Subtropical Botany, 2009, 17(3): 218-222. (in Chinese)
[20] AN J P, WANG X F, ESPLEY R V, WANG K L, BI S Q, YOU C X, HAO Y J. An apple B-Box protein MdBBX37 modulates anthocyanin biosynthesis and hypocotyl elongation synergistically with MdMYBs and MdHY5. Plant and Cell Physiology, 2020, 61(1): 130-143.
[21] 陳泠. Tritordeum花粉特異性啟動子的克隆與研究[D]. 武漢: 華中科技大學, 2005.
CHEN L. Cloning and study of Tritordeum pollen specific promoter [D]. Wuhan: Huazhong University of Science and Technology, 2005. (in Chinese)
[22] 孟冬. 蘋果MdABCF轉運S-RNase至花粉管影響自交不親和反應[D]. 北京: 中國農業大學, 2014.
MENG D. Apple ABCF transport S-RNase into pollen tube effecting self-incompatibility [D]. Beijing: China Agricultural University, 2014. (in Chinese)
[23] FILICHKIN S A, LEONARD J M, MONOGAKI A, LIU P P, NONGAKI H. A novel endo--Mannanase gene in tomato LeMAN5 is associated with anther and pollen development. Plant Physiology, 2004, 134(3):1080-1087.
[24] 魏巍, 黃蔚, 姚玲婭, 葛曉春. 一個水稻花發育特異性啟動子的克隆與活性分析. 復旦學報(自然科學版), 2014, 53(4): 529-534.
WEI W, HUANG W, YAN L Y, GE X C. Cloning and activity analysis of a rice floral development specific promoter. Journal of Fudan University (Natural Science Edition), 2014, 53(4): 529-534. (in Chinese)
[25] 李尉. 水稻OsWTF1和OsWTF2啟動子功能分析[D].長沙: 湖南農業大學, 2010.
LI W. Function analysis of OsWTF1 and OsWTF2 promoters in rice [D]. Changsha: Hunan Agricultural University, 2010. (in Chinese)
[26] WU J Z, QIN Y, ZHAO J. Pollen tube growth is affected by exogenous hormones and correlated with hormone changes in styles inL. Plant Growth Regulation, 2008, 55(2): 137-148.
[27] 許明, 白明義, 魏毓棠. 紫菜薹細胞質雄性不育系及其保持系在不同發育時期內源激素的變化. 西北農業學報, 2007, 16(3): 124-128.
XU M, BAI M Y, WEI Y T. Changes in endogenous hormone betweenssp.var.Hort. CMS lines and their maintainer line at different development stages. Acta Agriculturae Boreali-occidentalis Sinica, 2007, 16(3): 124-128. (in Chinese)
[28] CHEN D, ZHAO J. Free IAA in stigmas and styles during pollen germination and pollen tube growth of. Physiologia Plantarum, 2010, 134(1): 202-215.
[29] ZHANG S W, HUANG G X, FENG D, HE X H, PAN J C. Mechanism of seedlessness in a new lemon cultivar ‘Xiangshui’ [(L.) Burm. F.]. Sexual Plant Reproduction, 2012, 25(4): 337-345.
[30] MENG D, GU Z Y, WANG A D, YUAN Q, LI T Z. Apple MdABCF assists in the transportation of S-RNase into pollen tubes. The Plant Journal: For Cell and Molecular Biology 2014, 78(6): 990-1002.
[31] 呂換男, 馬聚澤, 郝艷, 左波, 黃佳, 王海靜, 武軍凱. ‘鴨梨’及其自交親和性芽變‘金墜梨’花粉ABC轉運蛋白家族分析. 河北科技師范學院學報, 2019, 33(2): 1-11.
Lü H N, MA J Z, HAO Y, ZUO B, HUANG J, WANG H J, WU J K. Proteomic analysis of ABC transporters from self-incompatible‘Yali‘ and its spontaneous self-compatible mutant ‘Jinzhuili’. Journal of Hebei Normal University of Science & Technology, 2019, 33(2):1-11. (in Chinese)
[32] 賀丹, 張佼蕊, 何松林, 劉紅利, 王政, 劉藝平. 芍藥屬遠緣雜交不親和PlABCF3基因克隆及表達分析. 華北農學報, 2020, 35(6): 81-89.
HE D, ZHANG J R, HE S L, LIU H L, WANG Z, LIU Y P. Cloning and expression analysis of distant hybridization incompatibilitygene from paeonia. Acta Agriculturae Boreali-Sinica, 2020, 35(6): 81-89. (in Chinese)
[33] CHOI H, JIN J Y, CHOI S , HWANG J U, KIM Y Y, SUH M C, LEE Y. An ABCG/WBC-type ABC transporter is essential for transport of sporopollenin precursors for exine formation in developing pollen. The Plant journal: For Cell and Molecular Biology, 2011, 65(2): 181-193.
[34] CECCHETTI V, BRUNETTI P, NAPOLI N, FATTORINI L, ALTAMURA M M, COSTANTINO P, CARDARELLI M. ABCB1 and ABCB19 auxin transporters have synergistic effects on early and lateanther development. Journal of Integrative Plant Biology, 2015, 57(12): 1089-1098.
Cloning and Interaction Protein Screening ofGene from Xiangshui Lemon

1College of Agriculture, Guangxi University/State Key Laboratory of Subtropical Agricultural Biological Resources Protection and Utilization/National Experimental Teaching Demonstration Center of Plant Science, Nanning 530004;2Institute of Subtropical Agriculture, Fujian Academy of Agricultural Sciences, Zhangzhou 363005, Fujian
Xiangshui lemon ((L.) Burm. F.) was used to study the expression of twogenes, and to screen and verify their interaction proteins by yeast two-hybrid technology and BiFC, so as to lay a foundation for further studying the molecular mechanism ofin the process of lemon self-incompatibility.Two E3 ubiquitin ligase(RING-H2 Zinc Finger2A) genes includingandof Xiangshui lemon were screened from the transcriptome and ubiquitin modification group, and their full-length sequences were cloned. The sequence and protein structure of twogenes were analyzed by bioinformatics to predict the cis acting elements of their promoters. 35S-RHF2A-GFP fusion protein expression vector was constructed for subcellular localization analysis. The temporal and spatial expression patterns of twowere analyzed by real-time fluorescence quantitative PCR. The yeast two-hybrid bait vector was constructed to screen the interaction proteins from the lemon yeast library. The BiFC vector was constructed to verify the interaction of the target protein in onion living cells.Theandgenes were obtained from ‘Xiangshui’ lemon, and the total length of ORF was 1 161 and 1 134 bp, respectively. NCBI domain prediction found that it had a Ring/U-box domain. Promoter analysis showed that there were POLLEN1LELAT52 and GTGANTG10 related to pollen specific expression elements. Tissue expression analysis showed thatgene was specifically expressed in pollen andwas specifically expressed in leaves; the results of temporal and spatial expression analysis showed that the expressed ofgene was involved in biological processes such as self-incompatibility ubiquitination reaction pathway, gametophyte development regulation and pollen growth and development. 72 clones were screened by yeast two-hybrid technology. After sequencing and blast comparison, the repetitive clones were excluded. Finally, 20 candidate interaction proteins such as ABCF3 were obtained. Through one-to-one interaction verification and BiFC, it was determined that there was an interaction relationship between RHF2A-1 and ABCF3-2.The temporal and spatial expression ofgene was consistent with the germination of pollen on pistil in the process of self-incompatibility; the interaction candidate proteins directly affecting pollen growth and development during the pollination were screened, which preliminarily proved thatgene played an important role in the process of self-incompatibility.
lemon; RHF2A; gene cloning; spatiotemporal expression; yeast two hybrid technology

2022-03-14;
2022-05-25
國家自然科學基金(31960585)、亞熱帶農業生物資源保護與利用國家重點實驗室自主課題(SKLCUSA-a201920)、亞熱帶農業生物資源保護與利用國家重點實驗室科教結合創新基地課題(SKLCUSA-c201901)
李雨澤,E-mail:1324700908@qq.com。通信作者何新華,E-mail:honest66222@163.com
(責任編輯 趙伶俐)

