水稻穗頂端退化突變體paa21的表型分析及基因克隆
赫磊,路凱,趙春芳,姚姝,周麗慧,趙凌,陳濤,朱鎮,趙慶勇,梁文化,王才林,朱麗,張亞東
水稻穗頂端退化突變體的表型分析及基因克隆

1江蘇省農業科學院糧食作物研究所/國家耐鹽堿水稻技術創新中心華東中心/江蘇省優質水稻工程技術研究中心/國家水稻改良中心南京分中心/江蘇省農業生物學重點實驗室,南京 210014;2中國水稻研究所/水稻生物學國家重點實驗室,杭州 310006
【】水稻穗頂端退化嚴重影響產量,鑒定與克隆水稻穗頂端退化相關基因,可以豐富水稻穗發育調控的分子機理,為水稻高產分子設計育種提供理論基礎和基因資源。【】從粳稻品種武運粳30號EMS突變體庫篩選到一份穩定遺傳的穗頂端退化突變體()。對退化一次枝梗比例、每穗退化粒數占比、每穗粒數、株高、穗長、單株產量等農藝性狀進行統計。使用臺盼藍和伊文思藍染色檢測頂端小穗是否發生程序性細胞死亡。測定WT和不同發育時期幼穗和不同穗部位的H2O2含量。分別與秈稻II-32B、9311正反交進行遺傳分析。利用與秈稻II-32B雜交構建的F2群體進行基因定位和克隆。使用SWISS-MODEL網站預測野生型和突變體蛋白的三維結構。利用RT-qPCR分析ROS響應標志基因、程序性細胞死亡相關基因、過氧化氫酶相關基因的表達量。突變體發生嚴重的穗頂端退化,統計所有一次枝梗退化情況,發現退化小穗主要位于頂端的一次枝梗上。與WT相比,的株高、每穗粒數、穗長和單株產量均降低。通過觀察不同發育時期的幼穗,發現在突變體幼穗發育至12 cm時,可見穗頂端退化表型。臺盼藍和伊文思藍染色結果表明突變體頂端小穗發生程序性細胞死亡。在退化的頂端小穗中觀察到更強烈的DAB染色;H2O2含量測定結果表明,與WT相比,穗中積累更高水平的ROS。遺傳分析表明突變表型受一對隱性核基因控制。圖位克隆結果發現中第二外顯子發生一個C到T的突變,導致丙氨酸突變為纈氨酸。該基因編碼一個鋁激活的蘋果酸轉運蛋白ALMT7。突變位點位于第4個跨膜螺旋上。SWISS-MODEL預測結果表明,該突變位點并未對突變體蛋白三維結構造成明顯影響。RT-qPCR結果表明,在幼穗發育至10 cm時,中ROS響應標志基因、和,程序性細胞死亡相關基因和,過氧化氫酶編碼基因、、的表達量較WT大幅升高。此外,10 cm幼穗中過氧化氫酶(CAT)的活性較WT明顯下降。幼穗在發育后期頂端小穗中積累過量的ROS,產生程序性細胞死亡,最終導致頂端小穗發生退化。
水稻;穗頂端退化;活性氧;程序性細胞死亡
0 引言
【研究意義】水稻是中國重要的糧食作物,在保障國家糧食安全方面具有重要作用。水稻產量由千粒重、每穗實粒數和單位面積有效穗數決定[1]。水稻穗部發育關系到產量,水稻穗的形成涉及復雜的生理生化過程,包括分生組織發育、花序建立和籽粒發育等。深入研究水稻穗發育相關基因對提高水稻產量具有重要意義。【前人研究進展】目前,已經報道了許多與穗發育相關的重要基因,涉及幼穗發育的不同階段,如腋生分生組織發育、分生組織之間的轉化、分枝伸長和末端小穗等的調控[2]。如,突變體()的枝梗數和每穗粒數的數量嚴重減少;相反,過量表達增加了枝梗和小穗的數目[3-5]。突變體()穗子顯著變大,分枝數和每穗小穗數也顯著增加[6]。()突變后分生組織活性增強,穗軸與分枝長度縮短,一次、二次枝梗數目增加[7]。()編碼一個ERF/AP2轉錄因子,在禾本科植物中高度保守。強突變體的穗子嚴重卷曲、末端小穗被更高階的輪狀分枝取代[8]。在水稻、玉米、谷子等作物的產量形成過程中,穗頂端退化對最終的產量形成有重要影響[9-11]。頂端小穗退化主要由遺傳因素調控,同時也受溫度和肥水等非生物脅迫的影響,是水稻生產中的重大問題之一[12-14]。目前,已經報道了一些與穗頂端退化相關的QTL,如—、、、等[14-17]。此外,利用穗頂端退化突變體已克隆數個涉及穗頂端退化的基因。()是第一個被克隆的水稻穗頂端退化的基因,編碼一個定位于細胞質的包含SHD和VCA結構域的SCAR/WAVE蛋白。與野生型相比,表現出株高變矮、葉尖枯萎、穗頂端嚴重退化、花藥花粉發育異常等多重表型[11]。Heng等[18]利用一個穗頂端退化突變體()克隆到一個控制穗頂端退化的顯性基因。該基因編碼一個具有轉運蘋果酸功能的質膜蛋白。細胞學分析發現,穗頂端退化是由發生在幼穗發育后期的程序性細胞死亡造成的。()編碼一個定位于線粒體的含有胱硫醚β-合酶結構域和DUF21結構域的蛋白,突變體表現為穗頂端小穗退化和穗中間小穗的育性降低。研究表明,DPS1能夠與線粒體硫氧還蛋白Trx1和Trx20互作,并參與ROS清除。突變以后,突變體中脂肪酸代謝和ROS穩態相關的生物過程受到影響,從而導致穗頂端退化[19]。Peng等[20]利用一個退化率高達60%的穗頂端退化突變體()克隆到另外一個控制水稻穗頂端退化的基因。編碼一個定位于細胞質的類鈣調神經磷酸酶B亞基互作蛋白激酶。的突變導致ROS在幼穗中積累,最終導致水稻穗細胞死亡產生頂端退化表型。編碼一個鈣氫離子交換蛋白,研究發現OsCAX1a參與Ca、Mn離子的轉運,突變后導致突變體中Ca、Mn等元素含量下降,產生葉尖枯和穗部頂端退化表型[21]。【本研究切入點】目前,已克隆的水稻穗頂端退化相關基因涉及多種調控途徑,但仍不能完全解釋水稻穗頂端退化相關的分子機理。因此,穗頂端退化的分子機理仍需深入研究。【擬解決的關鍵問題】本研究以粳稻品種武運粳30號EMS誘變得到的穗頂端退化突變體為研究對象,通過對其進行表型考察、組織化學分析、遺傳分析、基因定位以及基因表達分析,以期解析調控水稻穗頂端退化的分子機制,為提高水稻產量奠定基礎。
1 材料與方法
1.1 試驗材料
利用EMS(甲基磺酸乙酯)處理粳稻品種武運粳30號,田間篩選得到一份穗頂端退化的材料,經多年種植穗頂端退化表型能穩定遺傳,命名為(,)。將突變體分別與秈稻9311、II-32B雜交構建F2分離群體,用于遺傳分析與基因定位。
在水稻抽穗后,WT和分別取10株主穗,統計每穗退化粒數等表型。于成熟期統計株高、每穗粒數、穗長等表型。利用Excel和GraphPad Prism 8軟件統計、分析數據。
1.2 臺盼藍、伊文思藍和DAB染色
將WT和的小穗放入0.4%臺盼藍染液中,100℃染色10 min,然后,用2.5 mg·mL-1水合氯醛溶液脫色。將WT和的小穗放入0.25%伊文思藍染液中,室溫染色過夜。之后用無水乙醇脫色,掃描拍照保存。將WT和突變體小穗置于DAB染液(1 mg·mL-1)中,室溫染色8 h,染色完成后使用無水乙醇脫色,掃描拍照保存。
1.3 H2O2含量、CAT酶活性測定
取不同發育時期的WT和的小穗0.1—0.2 g,按1﹕1 000比例分別加入H2O2、CAT提取液冰浴勻漿(每個樣品3次重復)。8 500 r/min離心10 min,取上清放置冰上待測。分別使用蘇州科銘公司的H2O2含量測定試劑盒和CAT酶活性測定試劑盒測定H2O2含量、CAT酶活性。
1.4 遺傳分析及基因定位
將與秈稻II-32B、9311進行正反交,獲得F1株系和F2群體,分別統計F1、F2中穗發育正常和穗頂端退化表型分離比進行遺傳分析。采用CTAB法提取葉片DNA。利用水稻生物學國家重點實驗室保存的均勻分布于12條染色體上的標記引物分析親本多態性。在與秈稻II-32B構建的F2群體中選取與表型一致的植株,利用多態性好的標記對目的基因進行連鎖分析。將目的基因初步定位于染色體某個區間。
利用RAP-DB(https://rapdb.dna.affrc.go.jp/)網站分析定位區間內的開放閱讀框(open reading frame,ORF),在Primer-Blast網站(https://www.ncbi.nlm.nih. gov/tools/primer-blast/)設計引物對WT和的候選基因測序。利用seqman軟件分析測序結果。
1.5 蛋白三維結構分析
將WT和的氨基酸序列在SWISS-MODEL網站(https://swissmodel.expasy.org/)進行同源建模,分析WT和的蛋白結構。
1.6 實時熒光定量PCR
水稻組織提取RNA后,使用ReverTra Ace qPCR PCR試劑盒反轉獲得cDNA備用。使用AceQ qPCR SYBR Green Master Mix和熒光定量PCR儀(Applied Biosystems 7900HT)進行RT-qPCR檢測,以作為內參基因,利用2–ΔΔCt計算基因的表達量。
2 結果
2.1 paa21表型分析
2.1.1表現為嚴重的穗部頂端退化(,)多年種植,穗部頂端退化性狀穩定,抽穗后,的頂端小穗發白、不能夠正常發育、開花,在成熟期后,頂端小穗風干、脫落(圖1-A—C)。統計所有一次枝梗退化情況,發現絕大多數退化小穗位于頂端一次枝梗,約35%的一次枝梗發生退化,約20%的小穗發生退化(圖1-D—G)。此外,的株高低于WT,每穗粒數、穗長、單株產量均下降(圖1-H—K)。
2.1.2 頂端小穗的退化發生在穗發育的后期 在種植過程中,發現其頂端小穗是在幼穗發育后期產生的退化現象。為了明確頂端小穗發生退化的時期,從幼穗發育1 cm時開始觀察,在幼穗生長至12 cm之前,的頂端小穗與WT沒有區別(圖2-A—D)。當幼穗生長至12 cm時,能夠觀察到明顯的頂端小穗退化現象(圖2-E)。隨著幼穗后續不斷發育至成熟,這些小穗停止發育,逐漸萎縮干癟,在穗子成熟以后,十分容易脫落(圖2-F)。
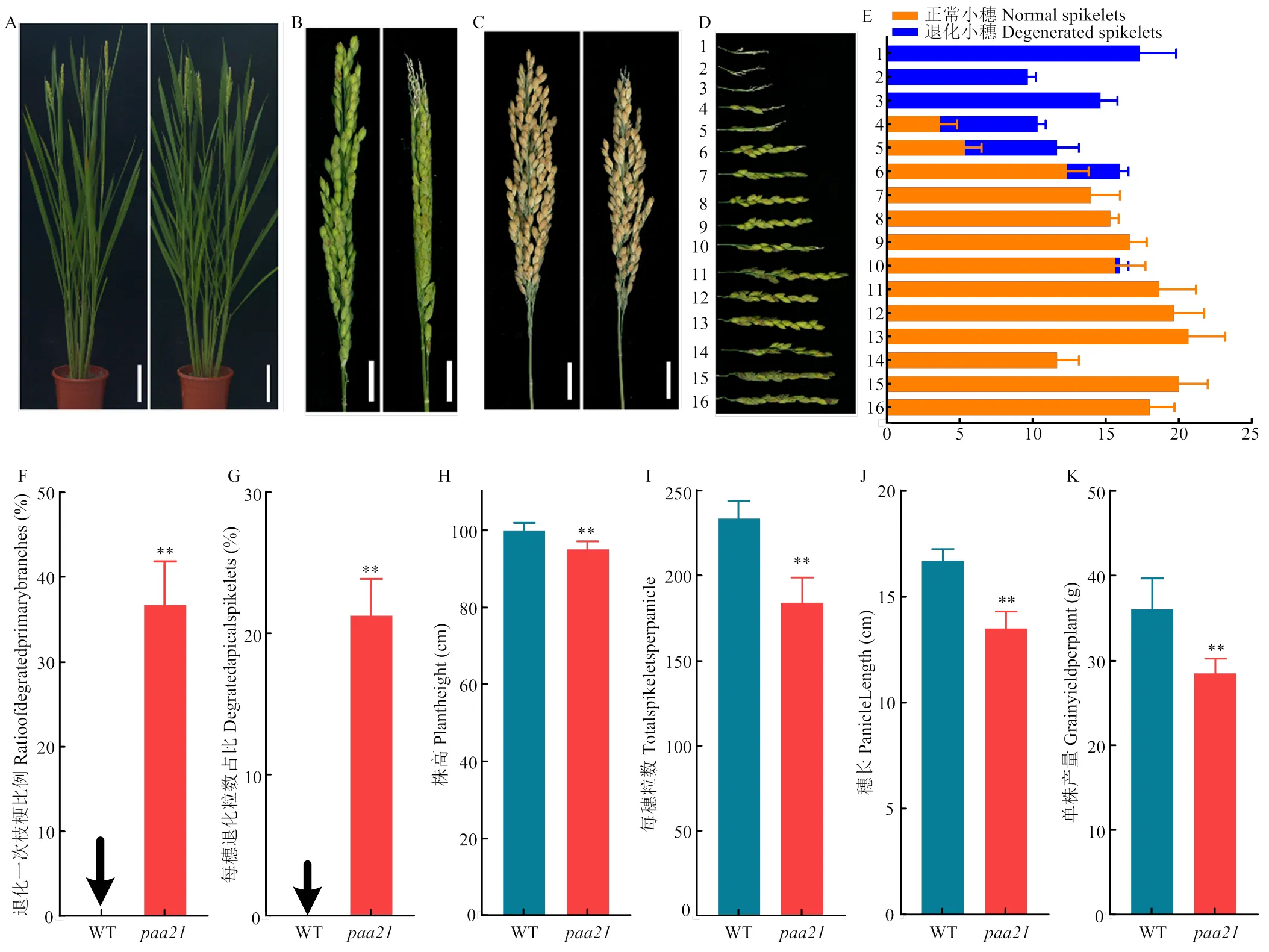
A:WT(左)和paa21突變體(右)的株型,bars=10 cm;B:WT(左)和paa21突變體(右)抽穗期的穗子,bars=2 cm;C:WT(左)和paa21突變體(右)成熟的穗子,bars=2 cm;D:來自一個穗子的一次枝梗,1—16表示paa21中從穗頂部到底部的一次枝梗。E:D圖中對應枝梗的正常小穗和退化小穗統計,F:WT與paa21突變體退化一次枝梗數目所占比例;G:每穗退化粒數所占比例;H:株高;I:每穗粒數;J:穗長;K:單株產量。數據是均值±標準誤;**表示t檢驗下顯著差異(P≤0.01)。下同

A—F:WT(左)和paa21(右)穗發育不同時期的表型。依次為1、2、5、7、12和17 cm。bars=1 cm
2.2 突變體小穗發生程序性細胞死亡
由上述結果可知,的穗頂端正常發育出小穗,但是頂端小穗生長到后期的時候停止生長,種子成熟后風干脫落。據此,推斷頂端小穗的細胞發生了程序性細胞死亡(programmed cell death,PCD)。為了驗證這個猜測,利用臺盼藍和伊文思藍對WT和10—11 cm穗的頂端小穗進行染色。結果發現,與WT相比,突變體頂端小穗著色變深(圖3)。表明突變體的頂端小穗發生了程序性細胞死亡。
活性氧(reactive oxygen species,ROS)被認為是PCD的重要觸發因素,較高濃度的ROS能夠誘導植物和動物組織中的細胞死亡[22-23]。H2O2是ROS的一種,據報道,水稻穗頂部退化多數是由H2O2積累導致[18-19]。使用DAB染色檢測頂端小穗中H2O2的含量。與WT相比,在退化的頂端小穗中觀察到更強烈的DAB染色(圖4-A),表明穗中的H2O2含量更高(圖4-A)。
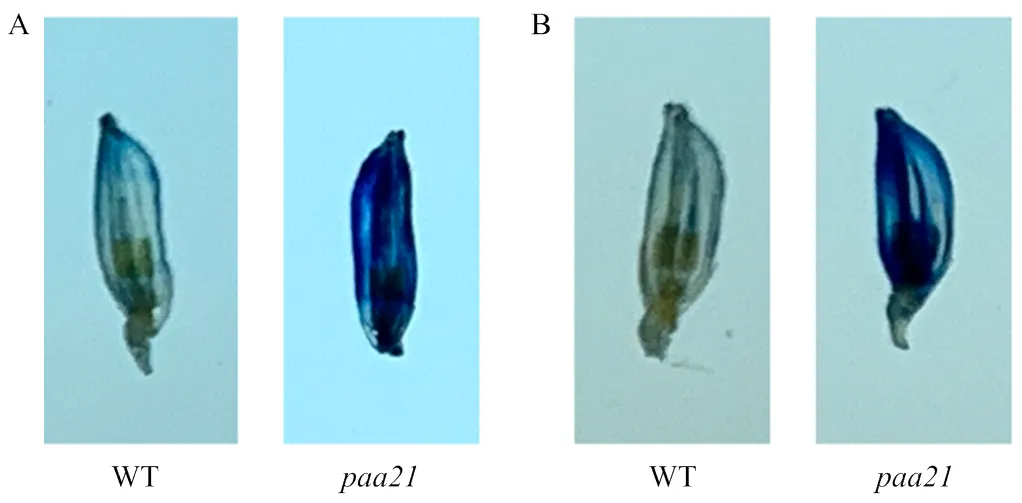
A:臺盼藍染色;B:伊文思藍染色
對幼穗不同發育階段的H2O2含量進行測定,結果表明,5 cm長的幼穗中,WT和的H2O2含量沒有明顯差異,但是,隨著幼穗的發育,幼穗中的H2O2含量較WT逐漸升高。特別是在10和15 cm長的幼穗中(圖4-B)。該結果與之前的觀察結果一致,即當穗長達到12 cm時,穗頂端退化開始(圖2),表明ROS水平與穗退化之間可能存在相關性。
對的10 cm幼穗不同穗部的H2O2進一步測定,與基部小穗相比,退化的頂端小穗和中間小穗的H2O2含量更高(圖4-C)。表明頂端小穗中積累的過量ROS是導致其發生PCD的原因。
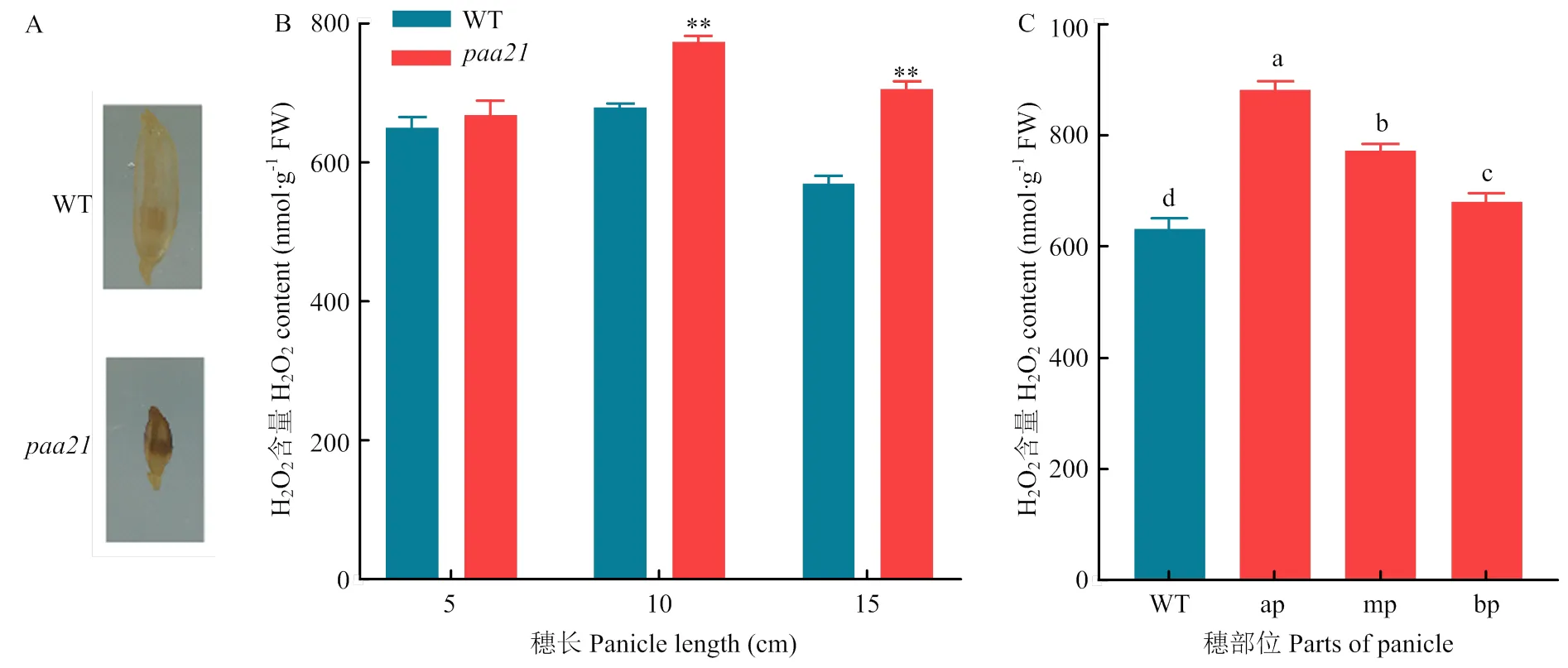
A:WT和paa21頂端小穗DAB染色;B:不同發育時期WT和paa21頂端小穗中過氧化氫含量的測定;C:水稻穗不同部位小穗中過氧化氫含量的測定,不同字母表示通過方差分析和LSD測試進行平均值比較的結果存在顯著差異(p<0.05),ap:穗頂端部分,mp:穗中間部分,bp:穗底部
2.3 穗頂端退化性狀的遺傳分析及PAA21的基因定位
為了確定的顯隱性以及是否受單基因控制,利用秈稻品種II-32B、9311與突變體進行雜交,所有F1植株均表現出野生型表型。F1自交產生的F2群體中出現了野生型表型和穗頂端退化的表型。通過對F2群體中野生型和突變型的個體數目進行統計,4個群體中χ2值均小于3.84,符合3﹕1的分離比(表1),表明穗頂端退化的性狀由一對隱性核基因控制。
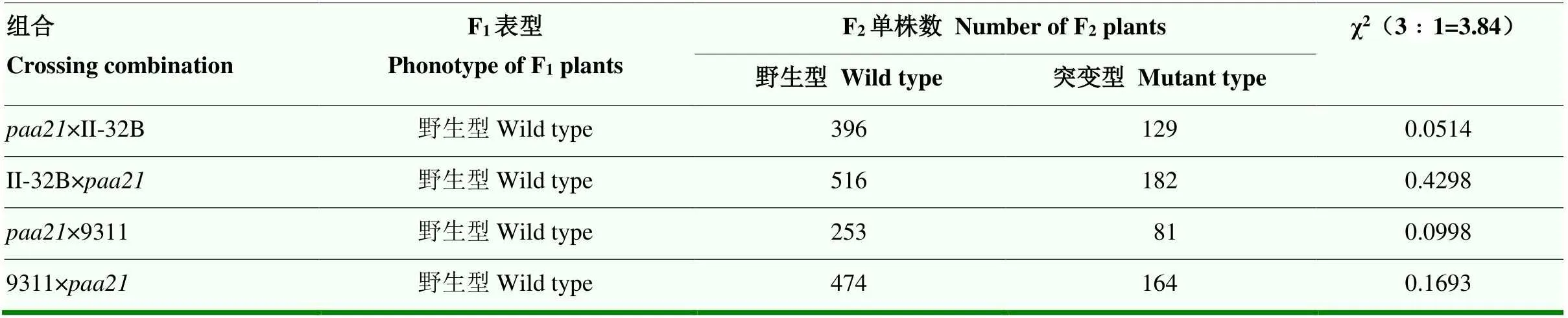
表1 paa21遺傳分析
為了克隆,利用和II-32B構建的F2群體對進行定位。從F2群體中選取21個表型個體,利用本實驗室保存的232對SSR、InDel標記將其初步定位于第2染色體上的標記B2-19和B2-21之間。
為進一步精細定位,利用418株單株,運用新開發的分子標記,最終將其定位于H-2-6和H-2-13之間102 kb區間內,包含11個開放閱讀框(open reading frame,ORF),對其測序比對,發現基因第二外顯子發生一個C到T的突變,導致丙氨酸突變為纈氨酸(圖5)。RAP-DB網站注釋編碼一個鋁激活蘋果酸轉運蛋白(aluminum-activated malate transporter,ALMT),是的等位基因[18]。
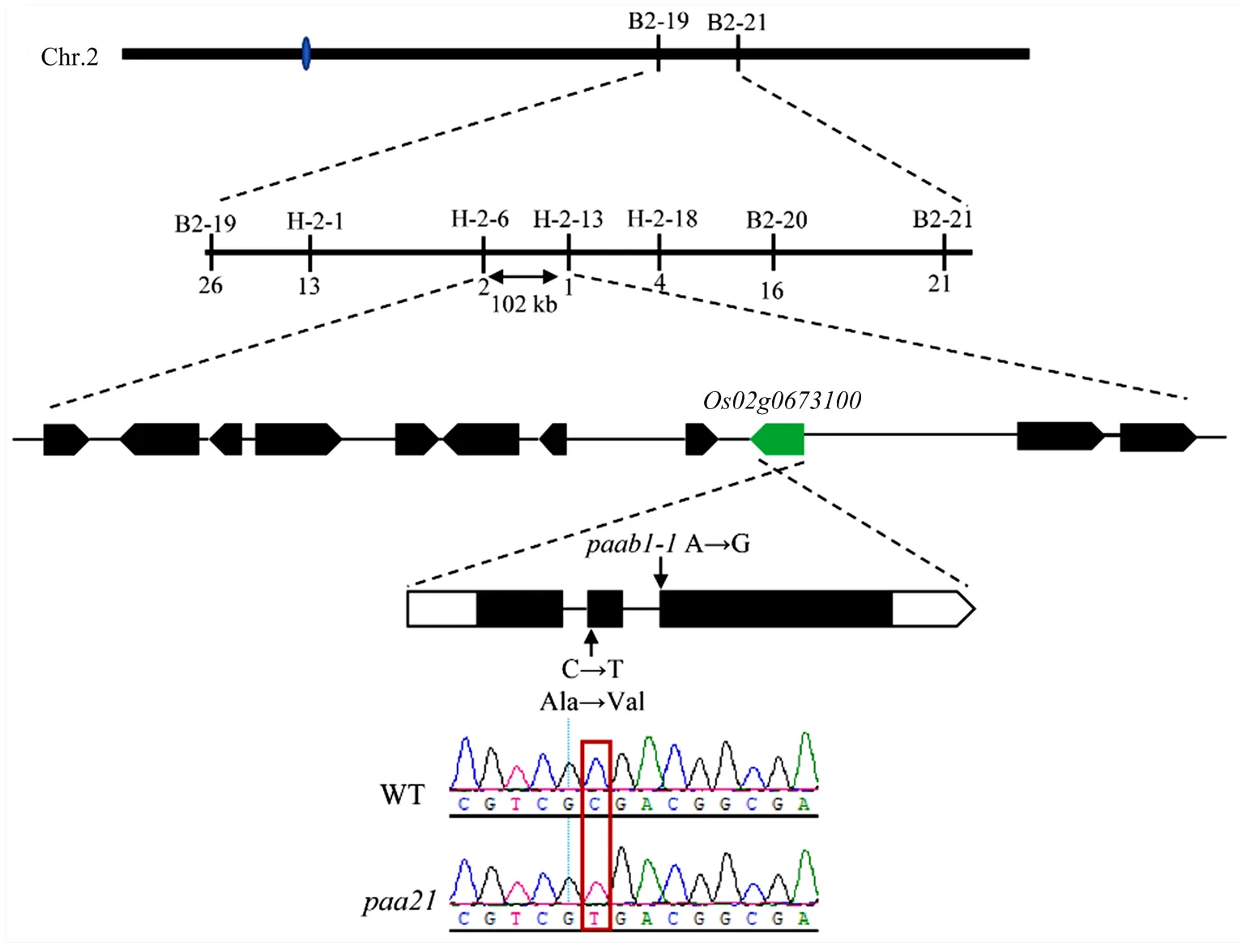
圖5 PAA21的圖位克隆
ALMT7蛋白有7個跨膜螺旋[18],通過分析WT和蛋白氨基酸序列,結果表明,突變位點在第4個跨膜螺旋上(圖6-A)。此外,利用SWISS-MODEL網站對蛋白三維結構進行分析。結果表明,第二外顯子C到T的突變并未對蛋白三維結構造成明顯影響(圖6-B—C)。
2.4 paa21中ROS相關基因的表達受到影響
由于的穗中積累大量的ROS,為了研究ROS產生的分子效應,對3個ROS響應標志基因、和的表達進行分析。這些基因屬于WRKY轉錄因子家族,在水稻、擬南芥中受ROS的強烈誘導表達[24-25]。在幼穗發育至10 cm時,中3個基因的表達量較WT大幅升高(圖7-A—C)。
、編碼液泡加工酶(vacuolar processing enzymes,VPE),是植物程序性細胞死亡的關鍵調控因子[26-27]。RT-qPCR結果表明,幼穗發育至10 cm時,中和的表達量較WT顯著升高(圖7-D—E)。
、、編碼過氧化氫酶,過氧化氫酶能夠催化H2O2形成H2O和O2,在ROS清除系統中發揮重要作用。檢測發育至5和10 cm的幼穗中這3個基因的表達情況。結果表明,5 cm幼穗中,3個基因在突變體和WT之間的表達量相似(圖7-F—H)。而在10 cm幼穗中,3個基因的表達量較WT明顯上升(圖7-F—H)。
此外,還對10 cm幼穗中過氧化氫酶(CAT)的活性進行了測定。發現中CAT的活性明顯下降。說明突變體中ROS的清除能力下降(圖7-I)。
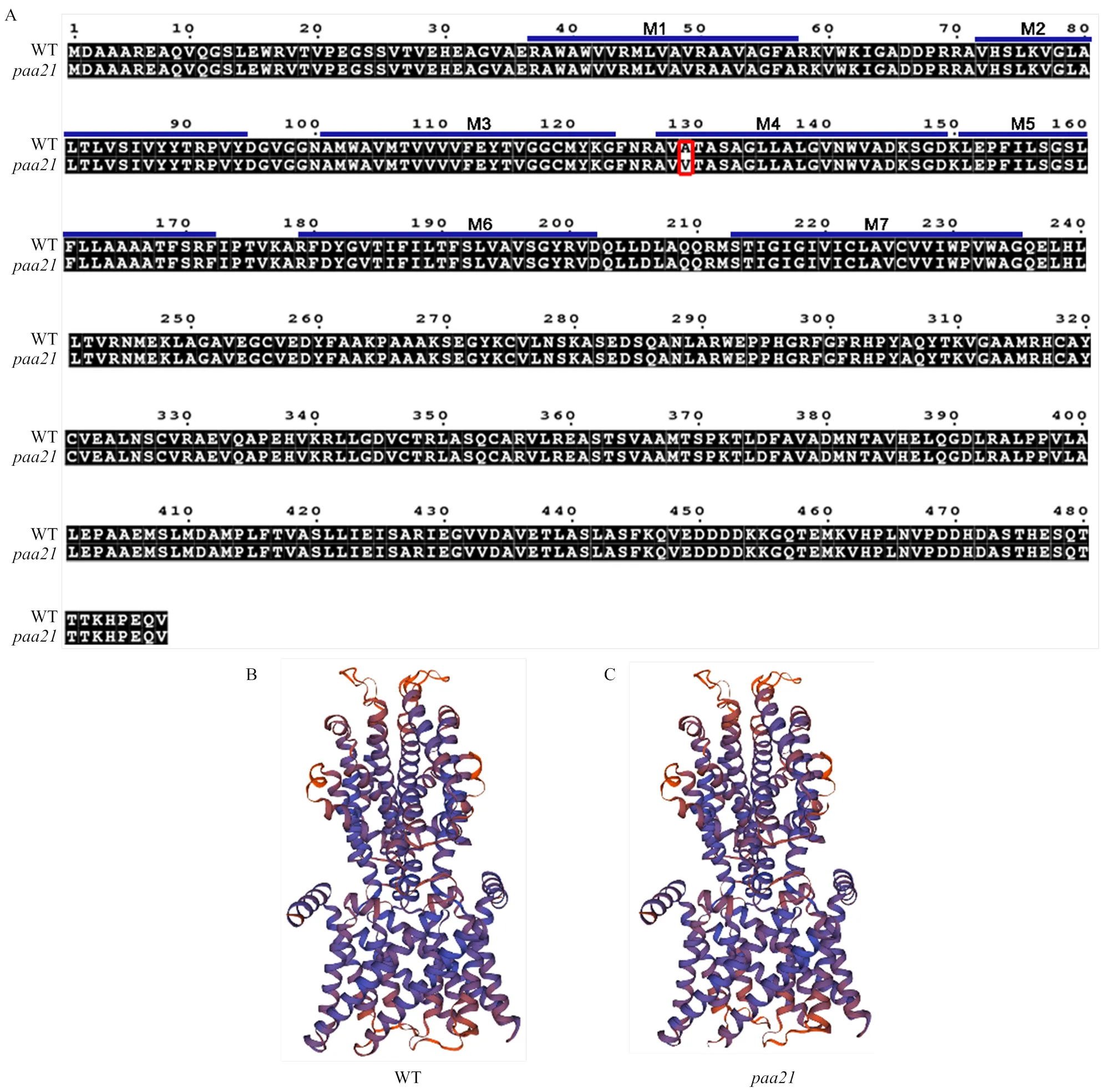
M1—M6表示PAA21蛋白的跨膜螺旋結構,紅框指示突變位點
綜上所述,幼穗在發育后期頂端小穗中積累過量的ROS,產生程序性細胞死亡,最終導致頂端小穗發生退化。
3 討論
3.1 paa21是paab1-1新的等位突變體
水稻穗頂端退化會造成產量上的損失。迄今為止,已經報道了多個導致水稻穗部頂端退化的基因,如、、、、、和[11, 18-20, 28-31]。這些基因涉及內質網應激、營養物質運輸、ROS穩態調節等多個生理過程,穎花退化的分子機制和生理機理還有待進一步豐富[32]。
本研究在EMS突變體庫中篩選獲得一個以武運粳30號為背景的穗頂端退化突變體。的穗頂端會發生嚴重的退化現象,導致其穗子變短、每穗粒數減少、單株產量下降(圖1)。退化小穗數占每穗總穎花數的比例約為20%,退化小穗主要分布在穗頂端,并且處于穗軸上部的一次枝梗退化的穎花占比大(圖1)。發現的幼穗發育到12 cm時,頂端小穗發生退化,表明參與維持水稻穗發育(圖2)。遺傳分析結果表明,表型受一對隱性核基因控制(表1)。基因定位結果表明,突變體在的第二個外顯子中具有單核苷酸替換(C突變A),導致在PAA21第129個殘基處丙氨酸(Ala)被纈氨酸(Val)替換,但并沒有造成蛋白三維結構發生明顯改變(圖5和圖6)。編碼一個鋁激活的蘋果酸轉運蛋白,預測有7個跨膜螺旋。的突變位點在第4個跨膜螺旋上(圖6-A),推斷該突變可能導致跨膜結構改變,無法正常轉運蘋果酸,產生了穗頂端退化的表型。
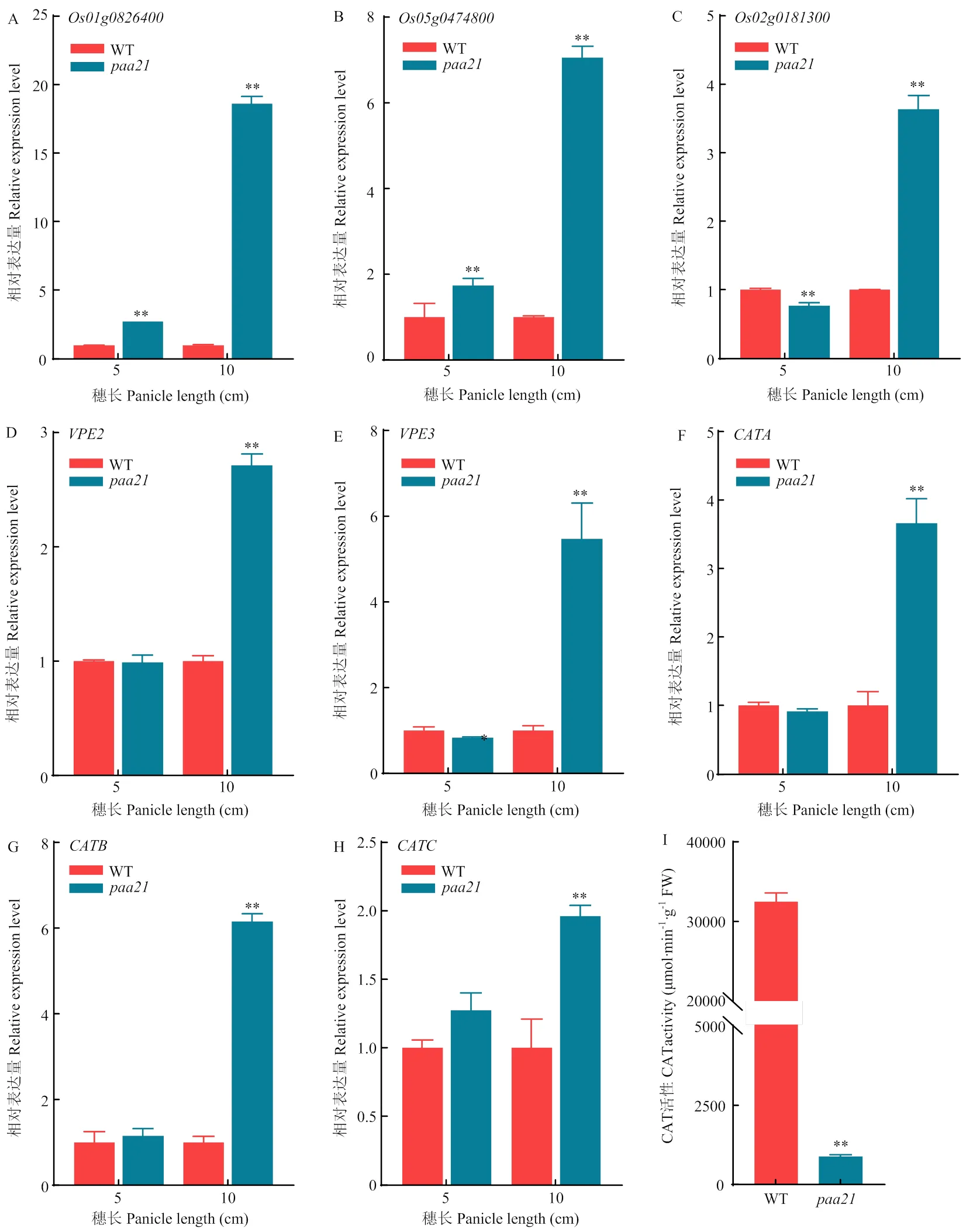
圖7 活性氧、PCD相關基因的表達量及過氧化氫酶活性
RA-PDB網站注釋編碼一個鋁激活的蘋果酸轉運蛋白OsALMT。Heng等[18]利用以Kittake為背景的穗頂端退化突變體研究了該基因通過參與蘋果酸的轉運維持穗發育的功能,并將其命名為。因此,是新的等位基因。與本研究不同的是,是一個顯性突變,而本研究中的則是一個隱性突變。的突變位點位于第二個內含子和第三個外顯子之間的剪接位點,導致mRNA剪接發生改變,產生了2種錯誤的轉錄本[18]。而的突變位點則是第二外顯子上,僅造成一個氨基酸的替換。此外,彭永彬[33]利用穗頂端退化突變體,與本研究類似,也是一個隱性突變。在第三外顯子上發生了一個單堿基替換,導致對應編碼氨基酸由精氨酸變為賴氨酸。因此,、和中顯隱性的差異可能是突變方式不同導致的。
3.2 ROS過度積累引起的PCD是paa21穗頂端退化的原因
活性氧是PCD的重要觸發因素,ROS的過度積累使細胞膜高度氧化,進而影響細胞通透性,最終導致細胞死亡[23, 34-35]。本研究臺盼藍和伊文思藍染色結果表明,頂端退化小穗中發生了PCD(圖3)。DAB染色、H2O2含量測定發現,頂端退化小穗中積累了大量的ROS(圖4)。此外,穗部的PCD相關基因和ROS清除相關基因的表達水平顯著增加,過氧化氫酶的活性也大幅下降(圖7)。結果表明,由于ROS在穗頂端的過度積累而引起的PCD可能是穗頂端退化的原因。綜上所述,推測的突變導致ROS過度積累,最終誘導細胞死亡。
4 結論
EMS誘變獲得一個水稻穗頂端退化突變體,突變表型受一對隱性核基因控制,為突變所致。穗發育后期積累大量ROS,誘導細胞死亡,產生穗頂端退化表型。
[1] XING Y, ZHANG Q. Genetic and molecular bases of rice yield. Annual Review of Plant Biology, 2010, 61: 421-442.
[2] TEO Z W N, SONG S, WANG Y Q, LIU J, YU H. New insights into the regulation of inflorescence architecture. Trends in Plant Science, 2014, 19(3): 158-165.
[3] IKEDA-KAWAKATSU K, YASUNO N, OIKAWA T, IIDA S, NAGATO Y, MAEKAWA M, KYOZUKA J. Expression level ofdetermines rice inflorescence form through control of cell proliferation in the meristem. Plant Physiology, 2009, 150(2): 736-747.
[4] IKEDA K, ITO M, NAGASAWA N, KYOZUKA J, NAGATO Y. Rice, encoding an F-box protein, regulates meristem fate. The Plant Journal, 2007, 51(6): 1030-1040.
[5] IKEDA K, NAGASAWA N, NAGATO Y.temporally regulates meristem identity in rice. Developmental Biology, 2005, 282(2): 349-360.
[6] LI M, TANG D, WANG K, WU X, LU L, YU H, GU M, YAN C, CHENG Z. Mutations in the F-box geneimprove the panicle architecture and enhance the grain yield in rice. Plant Biotechnology Journal, 2011, 9(9): 1002-1013.
[7] HUANG X, QIAN Q, LIU Z, SUN H, HE S, LUO D, XIA G, CHU C, LI J, FU X. Natural variation at thelocus enhances grain yield in rice. Nature Genetics, 2009, 41(4): 494-497.
[8] KOMATSU M, MAEKAWA M, SHIMAMOTO K, KYOZUKA J. Theandgenes determine the inflorescence architecture of rice by controlling rachis-branch and spikelet development. Developmental Biology, 2001, 231(2): 364-373.
[9] WANG H, TANG S, ZHI H, XING L, ZHANG H, TANG C, WANG E, ZHAO M, JIA G, FENG B, DIAO X. The boron transporter SiBOR1 functions in cell wall integrity, cellular homeostasis, and panicle development in foxtail millet. the Crop Journal, 2022, 10(2): 342-353.
[10] PEI Y, DENG Y, ZHANG H, ZHANG Z, LIU J, CHEN Z, CAI D, LI K, DU Y, ZANG J, XIN P, CHU J, CHEN Y, ZHAO L, LIU J, CHEN H. EAR APICAL DEGENERATION1 regulates maize ear development by maintaining malate supply for apical inflorescence. The Plant Cell, 2022, 34(6): 2222-2241.
[11] BAI J, ZHU X, WANG Q, ZHANG J, CHEN H, DONG G, ZHU L, ZHENG H, XIE Q, NIAN J, CHEN F, FU Y, QIAN Q, ZUO J. Riceencodes a suppressor of cAMP receptor-like protein that is important for actin organization and panicle development. Plant Physiology, 2015, 169(2): 1179-1191.
[12] 陳惠哲, 朱德峰, 林賢青, 張玉屏. 穗肥施氮量對兩優培九枝梗及穎花分化和退化的影響. 浙江農業學報, 2008, 20(3): 181-185.
CHEN H Z, ZHU D F, LIN X Q, ZHANG Y P. Effect of nitrogen levels in spike stage on differentiation and degeneration of branches and spikelet of hybrid rice cultivar Liangyoupeijiu. Acta Agriculturae Zhejiangensis, 2008, 20(3): 181-185. (in Chinese)
[13] 王亞梁, 張玉屏, 朱德峰, 向鏡, 武輝, 陳惠哲, 張義凱. 水稻穗分化期高溫脅迫對穎花退化及籽粒充實的影響. 作物學報, 2016, 42(9): 1402-1410.
WANG Y L, ZHANG Y P, ZHU D F, XIANG J, WU H, CHEN H Z, ZHANG Y K. Effect of heat stress on spikelet degeneration and grain filling at panicle initiation period of rice. Acta Agronomica Sinica, 2016, 42(9): 1402-1410. (in Chinese)
[14] 張興元, 羅勝, 王敏, 叢楠, 趙志超, 程治軍. 與SP1互作的水稻穗頂部退化基因的精細定位. 中國農業科學, 2015, 48(12): 2287-2295.
ZHANG X Y, LUO S, WANG M, CONG N, ZHAO Z C, CHENG Z J. Fine mapping of rice panicle apical abortion geneinteracting with. Scientia Agricultura Sinica, 2015, 48(12): 2287-2295. (in Chinese)
[15] TAN C J, SUN Y J, XU H S, YU S B. Identification of quantitative trait locus and epistatic interaction for degenerated spikelets on the top of panicle in rice. Plant Breeding, 2011, 130(2): 177-184.
[16] 徐華山, 孫永建, 周紅菊, 余四斌. 構建水稻優良恢復系背景的重疊片段代換系及其效應分析. 作物學報, 2007, 33(6): 979-986.
XU H S, SUN Y J, ZHOU H J, YU S B. Development and characterization of contiguous segment substitution lines with background of an elite restorer line. Acta Agronomica Sinica, 2007, 33(6): 979-986. (in Chinese)
[17] CHENG Z J, MAO B G, GAO S W, ZHANG L, WANG J L, LEI C L, ZHANG X, WU F Q, GUO X P, WAN J M. Fine mapping of, a gene controlling panicle apical development in rice. Journal of Integrative Plant Biology, 2011, 53(9): 710-718.
[18] HENG Y, WU C, LONG Y, LUO S, MA J, CHEN J, LIU J, ZHANG H, REN Y, WANG M, TAN J, ZHU S, WANG J, LEI C, ZHANG X, GUO X, WANG H, CHENG Z, WAN J. OsALMT7 maintains panicle size and grain yield in rice by mediating malate transport. The Plant Cell, 2018, 30(4): 889-906.
[19] ZAFAR S A, PATIL S B, UZAIR M, FANG J, ZHAO J, GUO T, YUAN S, UZAIR M, LUO Q, SHI J, SCHREIBER L, LI X.() encodes a cystathionine β-synthase domain containing protein required for anther cuticle and panicle development in rice. New Phytologist, 2020, 225(1): 356-375.
[20] PENG Y B, HOU F X, BAI Q, XU P Z, LIAO Y X, ZHANG H Y, GU C J, DENG X S, WU T K, CHEN X Q, ALI A, WU X J. Rice calcineurin b-like protein-interacting protein kinase 31 (OsCIPK31) is involved in the development of panicle apical spikelets. Frontiers in Plant Science, 2018, 9.
[21] 王中豪. 水稻鈣氫離子交換蛋白基因的圖位克隆和功能分析[D]. 北京: 中國農業科學院, 2021.
WANG Z H. Map-based cloning and functional analysis of the Ca2+/H+exchanger genein rice[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021. (in Chinese)
[22] LOOR G, KONDAPALLI J, SCHRIEWER J M, CHANDEL N S, VANDEN HOEK T L, SCHUMACKER P T. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine, 2010, 49(12): 1925-1936.
[23] MITTLER R. ROS are good. Trends in Plant Science, 2017, 22(1): 11-19.
[24] LI Z, MO W, JIA L, XU Y C, TANG W, YANG W, GUO Y L, LIN R. Rice FLUORESCENT1 is involved in the Regulation of Chlorophyll. Plant Cell Physiology, 2019, 60(19): 2307-2318.
[25] SU T, WANG P, LI H, ZHAO Y, LU Y, DAI P, REN T, WANG X, LI X, SHAO Q, ZHAO D, ZHAO Y, MA C. Thecatalase triple mutant reveals important roles of catalases and peroxisome- derived signaling in plant development. Journal of Integrative Plant Biology, 2018, 60(7): 591-607.
[26] DENG M, BIAN H, XIE Y, KIM Y, WANG W, LIN E, ZENG Z, GUO F, PAN J, HAN N, WANG J, QIAN Q, ZHU M. Bcl-2 suppresses hydrogen peroxide-induced programmed cell death via OsVPE2 and OsVPE3, but not via OsVPE1 and OsVPE4, in rice. The FEBS Journal, 2011, 278(24): 4797-4810.
[27] LU W Y, DENG M J, GUO F, WANG M Q, ZENG Z H, HAN N, YANG Y N, ZHU M Y, BIAN H W. Suppression ofenhances salt tolerance by attenuating vacuole rupture during programmed cell death and affects stomata development in rice. Rice, 2016, 9.
[28] DAI D, ZHANG H, HE L, CHEN J, DU C, LIANG M, ZHANG M, WANG H, MA L. Panicle apical abortion 7 regulates panicle development in rice (L.). International Journal of Molecular Sciences, 2022, 23(16): 9487.
[29] HU P, TAN Y Q, WEN Y, FANG Y X, WANG Y Y, WU H, WANG J G, WU K X, CHAI B Z, ZHU L, ZHANG G H, GAO Z Y, REN D Y, ZENG D L, SHEN L, XUE D W, QIAN Q, HU J. LMPA regulates lesion mimic leaf and panicle development through ROS-induced PCD in rice. Frontiers in Plant Science, 2022, 13.
[30] YANG F, XIONG M, HUANG M, LI Z, WANG Z, ZHU H, CHEN R, LU L, CHENG Q, WANG Y, TANG J, ZHUANG H, LI Y. Panicle apical abortion 3 controls panicle development and seed size in rice. Rice, 2021, 14(1): 68.
[31] WANG Q L, SUN A Z, CHEN S T, CHEN L S, GUO F Q. SPL6 represses signalling outputs of ER stress in control of panicle cell death in rice. Nature Plants, 2018, 4(5): 280-288.
[32] ALI A, XU P, RIAZ A, WU X. Current advances in molecular mechanisms and physiological basis of panicle degeneration in rice. International Journal of Molecular Sciences, 2019, 20(7): 1613.
[33] 彭永彬. 水稻穗頂退化突變體和的基因克隆與功能分析[D]. 成都: 四川農業大學, 2018.
PENG Y B. Cloning and functional charactization ofand
[34] WASZCZAK C, CARMODY M, KANGASJ?RVI J. Reactive oxygen species in plant signaling. Annual Review of Plant Biology, 2018, 69(1): 209-236.
[35] MHAMDI A, VAN BREUSEGEM F. Reactive oxygen species in plant development. Development, 2018, 145(15).
Phenotypic analysis and gene cloning of rice panicle apical abortion mutant
HE Lei1, LU Kai1, ZHAO ChunFang1, YAO Shu1, ZHOU LiHui1, ZHAO Ling1, CHEN Tao1, ZHU Zhen1, ZHAO QingYong1, LIANG WenHua1, WANG CaiLin1, ZHU Li2, ZHANG YaDong1
1Institute of Food Crops, Jiangsu Academy of Agricultural Sciences/East China Branch of National Center of Technology Innovation for Saline-Alkali Tolerant Rice/Jiangsu High Quality Rice R&D Center/Nanjing Branch of China National Center for Rice Improvement/Key laboratory of Jiangsu Province for Agrobiology, Nanjing 210014;2China National Rice Research Institute/State Key Laboratory of Rice Biology, Hangzhou 310006
Rice panicle apical abortion affects yield. Identification and cloning of genes related to rice panicle apical abortion can enrich the molecular mechanism of rice panicle development regulation, and provide theoretical basis and genetic resources for rice high-yield molecular design breeding.Here, a stably inherited() mutant was screened from EMS mutant library of the japonica rice variety "Wuyunjing 30". Agronomic traits, such as ratio of degraded primary branches, degraded apical spikelets, grains per panicle, plant height, panicle length, and grain yield per plant, were statistically analyzed. Trypan blue and Evans blue staining were used to detect whether programmed cell death occurred in the apical spikelets. H2O2content in young panicles at different development stages and different panicle parts of WT andwas determined. Genetic analysis was carried out by reciprocal cross ofwith indica rice II-32B and 9311 respectively. The F2population constructed by crossingwith indica rice II-32B was used for gene mapping and cloning. The three-dimensional structure of wild-type andproteins were predicted using SWISS-MODEL website. The expression levels of ROS response marker genes, programmed cell death related genes and catalase related genes were analyzed by RT-qPCR.produced panicle apical abortion phenotype and the degenerated spikelets were mainly located on the primary branches at the apical panicle. The plant height, grain number per panicle, panicle length and grain yield per plant ofwere lower than those of WT. After observing the young panicles at different development stages, we found that themutant had a panicle apical abortion phenotype when panicle developed to 12 cm. Trypan blue and Evans blue staining results showed that the apical spikelets of themutant had programmed cell death. Stronger DAB staining was observed in the degenerated apical spikelets ofthan WT. The results of H2O2content determination showed that higher level of ROS was accumulated in panicle ofcompared with WT. Genetic analysis suggested thatmutant phenotype is controlled by a pair of recessive nuclear genes. The results of map-based cloning showed that a C to T mutation occurred in the second exon of, resulting in the mutation of alanine to valine. This gene encodes an aluminum activated malate transporter, ALMT7. The mutation site was located at the fourth transmembrane helix. SWISS-MODEL prediction results showed that the mutation site did not significantly affect the three-dimensional structure of the mutant protein. The expression level of ROS response marker genes,andwas significantly higher than that in WT when the young spike developed to 10 cm. Compared with WT, the expression level of programmed cell death related genesandincreased significantly in. The expression level of,andwhich encode catalase in 10 cm young panicle ofwas significantly higher than that of WT. The activity of CAT in10 cm young spikelet was significantly lower than that of WT.accumulate excess ROS in the apical spikelet at late stage of panicle development, resulting in programmed cell death, which eventually leads to the degeneration of the apical spikelet. These results lay a good foundation for further enriching the genetic regulatory network of panicle development.
rice; panicle apical abortion; reactive oxygen species; programmed cell death

2022-09-27;
2022-10-24
江蘇省種業振興揭榜掛帥項目(JBGS[2021]001)、江蘇省重點研發計劃(BE2022336)、現代農業產業技術體系建設專項資金(CARS-01)
赫磊,E-mail:helei@jaas.ac.cn。通信作者朱麗,E-mail:zhuli05@caas.cn。通信作者張亞東,E-mail:zhangyd@jaas.ac.cn
(責任編輯 李莉)

