基于Wnt通路下調微小RNA-130a對顱腦損傷模型大鼠神經功能的修復作用▲
鄭細良 祁占寧 張 亮 方治軍 孫智宏
(1 北京市大興區人民醫院神經外科,北京市 100026,電子郵箱:zfpvtr@163.com;2 延安大學咸陽醫院神經外科,陜西省延安市 712000)
隨著生活節奏的加快,交通事故頻繁發生,使得顱腦損傷發生率呈上升趨勢,顱腦損傷易導致神經功能缺失,從而影響患者的認知功能,甚至對患者的生命健康產生威脅,嚴重影響患者生活質量。因此,治療顱腦損傷時進行神經功能修復尤為重要[1]。Wnt信號通路是在各種生物體中廣泛存在的一種保守信號通路,參與調控細胞增殖、分化、遷移以及凋亡等多種過程[2]。顱腦損傷后,損傷部位釋放大量的自由基及炎癥因子,使得腦細胞進一步壞死,加重病情[3]。微小RNA(microRNA,miRNA)-130a在顱腦損傷部位高度表達,參與氧化應激及炎癥反應損傷的過程[4]。本研究探討基于Wnt通路下調miRNA-130a的表達對顱腦損傷模型大鼠神經功能的修復作用。
1 材料與方法
1.1 實驗動物 30只SD健康雄性大鼠,購自上海斯萊克公司,許可證號:SYXK(冀)2020-009,月齡7~10 (8.5±0.8)個月,體重220~232 (226.8±3.9)g。在濕度為50%~55%、溫度為(24.1±2.1)℃、充足光照(光照12 h/d)的環境下適應性喂養大鼠1周。本研究經我院倫理委員會批準。
1.2 主要試劑 單唾液酸四己糖神經節甘酯鈉注射液(齊魯制藥有限公司,國藥準字:H20046213);Wnt3a mRNA、β-聯蛋白(β-catenin)mRNA提取試劑盒購自大連Takara生物工程有限公司;miRNA-130a試劑盒由武漢華美生物工程公司提供;兔抗小鼠單抗細胞趨化蛋白1(monocyte chemotactic protein 1,MCP-1)抗體(艾美捷科技有限公司,批號:A-AO1014a);小鼠抗小鼠白細胞介素(interleukin,IL)-6、腫瘤壞死因子(tumor necrosis factor,TNF)-α抗體(上海臻科生物科技有限公司,批號:48T96T、AB24781);小鼠抗小鼠超氧化物歧化酶(superoxide dismutase,SOD) 、丙二醛、神經元特異性烯醇化酶(neuron-specific enolase,NSE)、腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)抗體(武漢博士德生物工程有限公司,批號:AB24156、AB15874、AB57841、AB26348)。
1.3 方法
1.3.1 分組與建模:大鼠適應性飼養1周后,將大鼠按照隨機數字表法分為正常組(10只)和干預組(20只),正常組不做處理,采用Feeney自由落體硬膜外撞擊法[5]對干預組大鼠建立顱腦損傷模型。建模方法為,給予大鼠腹腔注射2%戊巴比妥鈉(0.2 mL/100 g)麻醉后,將大鼠頭部固定,剪去頭頸皮毛,消毒皮膚,沿中線右側將頭皮切開,分離骨膜至顱骨,暴露硬腦膜,再以直徑為4.5 mm、重量為25 g的砝碼,造成30 cm高空墜落的打擊力,使大鼠出現顱腦損傷。建模后大鼠表現出瞳孔縮小、肢體抽搐等癥狀,即表示建模成功。本實驗共有19只大鼠建模成功,將建模成功的大鼠按照隨機數字表法分為模型組(9只)和下調miRNA-130a組(10只)。給予下調miRNA-130a組大鼠經尾靜脈注射單唾液酸四己糖神經節甘酯鈉注射液30 mg/kg,1次/d,共3天,以進行基于Wnt通路下調miRNA-130a的干預[6],正常組、模型組大鼠每日給予腹腔注射同等劑量的生理鹽水。3組大鼠均連續注射7 d。
1.3.2 標本采集:所有大鼠連續干預1周后取心臟血液3 mL,2 000 r/min離心20 min,分離上清液,置于-80℃冰箱保存。腹主動脈采血5 mL后麻醉并斷頭處死大鼠,分離腦組織,取右側海馬組織于液氮中快速冷凍,置于-80℃冰箱保存。
1.3.3 蘇木精-伊紅染色:取大鼠左側海馬區腦組織,4%甲醛固定24 h后行常規石蠟包埋及連續切片,將切片烤干后進行脫蠟處理,之后依次置入不同濃度(95%、80%、70%)的酒精中,3 min/次。使用蘇木精染色15 min后清洗3次,30 s/次,使用鹽酸酒精分化處理30 s,充分清洗之后使用1%伊紅染色,使用酒精脫水處理后進行脫蠟處理,封片后在顯微鏡下觀察蘇木精-伊紅(hematoxylin-eosin,HE)染色結果。
1.3.4 miRNA-130a、Wnt3a mRNA、β-catenin mRNA相對表達水平的測定:采用實時熒光定量PCR技術法檢測miRNA-130a,以及Wnt3a mRNA、β-catenin mRNA的相對表達水平。首先提取海馬細胞總RNA,檢測其RNA純度及濃度后,進行反轉錄處理,獲得cDNA,以甘油醛-3-磷酸脫氫酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參,行PCR擴增,采用Primer Premier 6.0軟件設計引物序列,由Invitrogen公司合成引物。引物序列見表1。反應條件為96℃ 6 min;94℃ 15 s、65℃ 45 s,60個循環。以2-△△Ct方法計算miRNA-130a、Wnt3a mRNA、β-catenin mRNA相對表達水平,實驗重復3次,取平均值。

表1 引物序列
1.3.5 大鼠血清中的SOD、丙二醛、IL-6、TNF-α、神經生長因子、BDNF、NSE、MCP-1水平的檢測:(1)采用分光光度法檢測SOD水平,采用硫代巴比妥酸熒光法測定丙二醛水平。(2)采用酶聯免疫吸附測定法檢測IL-6、TNF-α及神經生長因子(nerve growth factor,NGF)、BDNF、NSE、MCP-1水平。
1.4 統計學分析 采用SPSS 19.0軟件進行統計分析。計量資料以(x±s)表示,多組比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。以P<0.05為差異具有統計學意義。
2 結 果
2.1 3組大鼠海馬區腦組織HE染色結果 正常組海馬區腦細胞排列整齊密集,且細胞大小、形態正常,胞核完整;模型組大鼠海馬區腦細胞間隙較寬,細胞腫脹,且神經元萎縮及腫脹,出現核固縮;與模型組比較,下調miRNA-130a組大鼠海馬區腦組織的病理改變明顯減輕。見圖1。

正常組 模型組 下調miRNA-130a組
2.2 3組大鼠海馬組織Wnt3a mRNA、β-catenin mRNA及miRNA-130a相對表達水平的比較 與正常組相比,模型組、下調miRNA-130a組Wnt3a mRNA、β-catenin mRNA相對表達水平均升高(P<0.05);與模型組相比,下調miRNA-130a組Wnt3a mRNA、β-catenin mRNA及miRNA-130a相對表達水平均降低(P<0.05)。見表2。
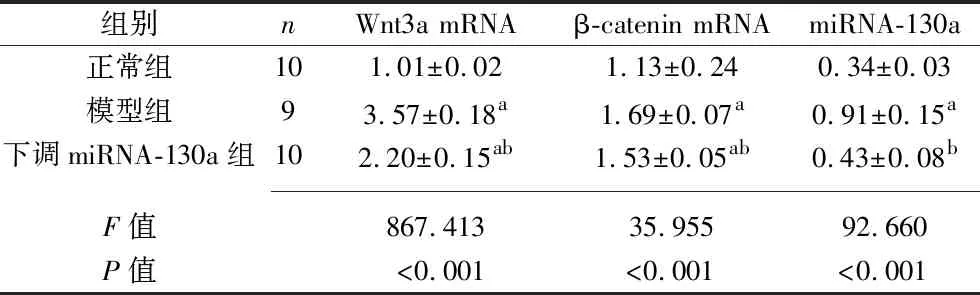
表2 3組大鼠海馬組織Wnt3a mRNA、β-catenin mRNA及miRNA-130a相對表達水平的比較(x±s)
2.3 3組大鼠血清SOD、丙二醛水平的比較 與正常組相比,模型組、下調miRNA-130a組的SOD水平降低,丙二醛水平升高(P<0.05);與模型組相比,下調miRNA-130a組的SOD水平升高,丙二醛水平降低(P<0.05)。見表3。
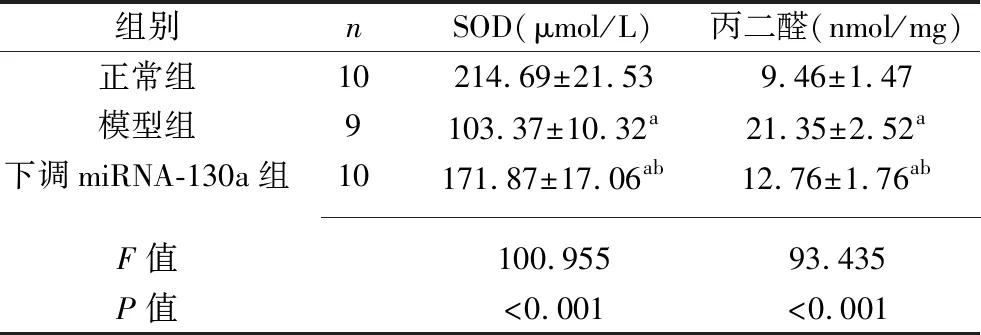
表3 3組大鼠血清SOD、丙二醛水平的比較(x±s)
2.4 3組大鼠血清IL-6、TNF-α及MCP-1水平的比較 與正常組相比,模型組、下調miRNA-130a組的IL-6、TNF-α及MCP-1水平均升高(P<0.05);與模型組相比,下調miRNA-130a組的IL-6、TNF-α、MCP-1水平降低(P<0.05)。見表4。

表4 3組大鼠血清IL-6、TNF-α及MCP-1水平的比較(x±s)
2.5 3組大鼠血清NSE、BDNF及NGF 水平的比較 與正常組相比,模型組、下調miRNA-130a組的NSE水平升高、BDNF及NGF 水平降低(P<0.05);與模型組相比,下調miRNA-130a組NSE水平降低,BDNF、NGF水平升高(P<0.05)。見表5。

表5 3組大鼠血清NSE、BDNF及NGF 水平的比較(x±s)
3 討 論
顱腦損傷作為臨床上較為常見的一種創傷,常表現為意識障礙、頭痛以及嘔吐等,給患者的生活帶來嚴重的影響[5]。研究顯示,顱腦損傷常導致腦組織缺血缺氧、炎癥反應以及神經細胞凋亡等,使得病情進一步發展,引發腦缺血及腦梗死,嚴重者可導致死亡[6]。多數顱腦損傷患者可出現神經功能障礙,尤其是由鈍器或銳器外力所致的顱腦損傷患者,常留有不同程度的神經功能障礙[7]。探尋有效治療顱腦損傷所致神經功能障礙的方法是臨床研究的熱點[8]。
Wnt信號通路是神經干細胞增殖分化過程中較為關鍵的調控通路[9]。正常情況下,Wnt/β-catenin通路表達水平較低,但發生顱腦損傷時該通路將會被激活。其中Wnt3a為Wnt/β-catenin通路的起始蛋白,其表達升高將會激活Wnt信號通路[10]。β-catenin為Wnt/β-catenin通路中的信號轉導因子,正常組織細胞中β-catenin以磷酸化的降解復合物形式存在,且含量較低。miRNA在真核細胞中廣泛存在,參與各種生理、病理過程[11]。miRNA-130a為miRNA-130具有代表性的因子,研究發現在宮頸癌、肺癌等多種惡性腫瘤中miRNA-130a均呈高表達,其通過細胞內多個信號通路參與腫瘤細胞的增殖及侵襲過程[12]。研究顯示,在顱腦損傷中,下調miRNA-130a相對表達水平,可有效減輕炎癥反應及氧化應激,提示下調miRNA-130a的表達可能對顱腦損傷具有保護作用[14]。本研究結果顯示,下調miRNA-130a組海馬區腦組織病理改變較模型組減輕,且與模型組相比,下調miRNA-130a組的Wnt3a mRNA、β-catenin mRNA及miRNA-130a相對表達水平均降低(P<0.05),說明通過Wnt通路下調miRNA-130a能夠減輕顱腦損傷模型大鼠的腦組織損傷。
顱腦損傷時氧自由基大量釋放,腦組織中的SOD水平下降,丙二醛水平升高[14]。研究顯示,在顱腦受到損傷后,氧化應激將會加重腦損傷過程,導致大量氧自由基的產生,進而促進蛋白質氧化、脂質過氧化等,引發腦水腫、顱內壓升高的發生[15]。SOD、丙二醛水平或活性高低與氧自由基導致的腦損傷具有密切聯系[16]。例如,血清中SOD水平降低會導致腦細胞破壞程度增加,對氧自由基的滅活作用減弱,加劇病情進展;丙二醛水平上升會加劇氧自由基的攻擊損害[17]。本研究結果顯示,與模型組相比,下調miRNA-130a組的SOD水平升高,丙二醛水平降低(P<0.05),說明通過Wnt通路下調miRNA-130a的表達水平能夠減輕顱腦損傷大鼠的氧化應激水平。
在顱腦損傷患者腦內神經元受損、變性及凋亡的過程中,均有炎癥反應的參與,且炎癥反應為多種創傷后共有的病理過程。炎癥反應能改變顱腦損傷患者血-腦屏障的通透性,使腦血流紊亂,進而加重患者的缺氧、缺血,使腦組織受損程度增加[18]。IL-6為促炎因子,當其水平顯著上升時,血管內皮細胞通透性增大,加重繼發性腦損傷[19]。TNF-α是活化巨噬細胞的小分子,當其水平過度升高可促進其他炎癥因子釋放,同時會加劇組織細胞損傷。MCP-1是一種單核細胞特異性趨化因子,在炎癥反應中發揮重要作用。本研究結果顯示,與模型組相比,下調miRNA-130a組的IL-6、TNF-α、MCP-1水平降低(P<0.05),提示通過Wnt通路下調miRNA-130a表達水平能夠降低顱腦損傷大鼠炎癥反應水平。
顱腦損傷常伴有神經損傷,導致患者出現神經功能障礙,影響其生活質量[20]。血清中NSE能反映神經損傷程度,當神經系統受到損傷后,其水平將會顯著升高。BDNF與NGF均能夠促進神經功能重建。BDNF為神經營養因子家族成員,由腦組織合成,主要分布在腦皮質、紋狀體區以及海馬區,在神經細胞軸突生長,神經元存活,促進神經康復,抵抗神經細胞凋亡及增加突觸可塑性中發揮重要作用[21]。NGF具有促進神經突起生長的生物效應,參與神經系統的發育、分化以及損傷修復等過程[22]。本研究結果顯示,與模型組相比,下調miRNA-130a組的NSE水平降低,BDNF、NGF水平升高(P<0.05),說明通過Wnt通路下調miRNA-130a表達水平能夠減輕顱腦損傷模型大鼠的神經損傷程度,促進神經功能修復。
綜上所述,基于Wnt通路下調miRNA-130a表達水平對顱腦損傷大鼠進行干預,能夠降低炎癥反應和氧化應激水平,減輕腦組織損傷,促進神經功能修復。

