老年晚期宮頸癌患者貝伐珠單抗治療后外周血miR-21、miR-130表達水平變化及臨床意義
買衛紅 吳 寧 王 霞 張曉慧
宮頸癌是女性常見的生殖系統惡性腫瘤,其發病常與多種因素相關,不潔性生活、多次分娩、早婚是宮頸癌的常見危險因素[1],而人乳頭瘤病毒感染是誘發宮頸癌的主要原因[2]。早期宮頸癌癥狀隱匿,常無特征臨床表現而易被忽視,多數患者初診即為晚期。大多數晚期宮頸癌患者由于全身擴散等原因失去手術機會,且治療后復發率高,因此晚期宮頸癌患者5年生存率不足30%[3]。近年來關于腫瘤靶向治療的相關研究趨于熱門,貝伐珠單抗是一種血管內皮生長因子(VEGF)抑制劑,通過抑制腫瘤血管生成發揮抗腫瘤作用[4],但其治療效果受多種因素影響,且缺乏相關評估指標,因此亟需相關標志物對貝伐珠單抗治療效果進行預測評估。miRNA與多種腫瘤疾病的發生發展密切相關[5],miR-21、miR-130已被證實能夠促進腫瘤增殖轉移,其高表達多與患者預后不良相關[6-7]。但miR-21、miR-130水平與貝伐珠單抗治療效果的關系尚不完全明確。本研究采用RT-PCR技術檢測貝伐珠單抗治療后宮頸癌患者外周血中miR-21、miR-130表達水平,旨在為患者療效及預后評估提供相關依據。
1 材料與方法
1.1 一般資料
選取2017年9月至2019年9月本院收治的化療耐藥的老年晚期宮頸癌患者63例為研究組,診斷標準參照NCCN腫瘤學臨床實踐指南-宮頸癌(2019年第3版)[8]。患者年齡65~79歲,平均年齡(74±8.14)歲。納入標準:①患者經陰道鏡檢查、經病理科確診為Ⅲb~Ⅳ期宮頸癌;②患者均為多線含鉑藥物化療后耐藥或腫瘤進展;③患者無重要臟器功能損傷。排除標準:①合并其他惡性腫瘤患者;②合并肝臟、心臟、肺等臟器功能嚴重異常患者;③對貝伐珠單抗治療過敏患者。納入對象及家屬均簽署研究知情同意書,本研究并經醫院醫學倫理委員會審核通過。
1.2 治療方法及評估
患者靜脈注射安維汀,單次用量為7.5 mg/kg,每3周注射1次,治療3~6個周期,平均4個周期。治療結束后采用RECIST標準[9]評估患者治療效果,分為完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)及疾病進展(PD)。
1.3 RT-PCR技術檢測患者外周血miR-21、miR-130表達水平
于患者空腹時無菌采集外周靜脈血3 ml,加入1 ml Trizol后保存于-80 ℃。提取外周血中總RNA,樣本使用NanoDrop 2000進行檢測,OD260/OD280>1.8證明所提取RNA合格。使用TaKaRa逆轉錄試劑盒(大連寶生物公司)將所提取到的RNA逆轉錄成cDNA,使用RT-PCR技術檢測外周血中miR-21、miR-130表達。采用美國索萊寶公司通用RT-PCR試劑盒(M-MLV),包含10×PCR Buffer 5 μl,dNTPs 1 μl,上、下游引物各1 μl,模板cDNA 2 μl,Taq Polymerase 0.5 μl,加入ddH2O至50 μl反應體系。94 ℃預變性5 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 60 s,共35個循環。采用2-??Ct法測定miR-21、miR-130相對表達量。??Ct=(CTmiRNA-CTU6RNA)實驗組-(CTmiRNA-CTU6RNA)對照組。所有引物均使用Primer 6.0設計,委托上海生工生物公司合成。miR-21:F:5’-ACGTTGTGCAGCTTATCAGACTG-3’,R:5’-AATGGTTGTTCTCCACACTCTC-3’;miR-130:F:5’-GGGGCAGTGCAATGTTAAAA-3’,R:5’-GTGCAGGGTCCGA-3’。
1.4 統計分析
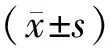
2 結果
2.1 治療前后外周血中miR-21、miR-130水平變化
檢測結果發現63例患者經貝伐珠單抗治療后外周血miR-21、miR-130水平較治療前明顯降低,差異具有統計學意義(P<0.001),見表1。
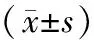
表1 治療前后患者外周血中miR-21、miR-130水平比較
2.2 外周血中miR-21、miR-130水平與治療效果的關系
63例患者經貝伐珠單抗治療后根據療效分為:CR組8例、PR組17例、SD組22例、PD組16例。不同治療效果患者外周血中miR-21、miR-130水平具有明顯差異(P<0.001),且CR組、PR組外周血中miR-21、miR-130水平明顯低于PD組(P<0.05),見表2。
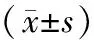
表2 不同療效患者外周血中miR-21、miR-130水平比較
2.3 外周血中miR-21、miR-130水平與患者預后的關系
Kaplan-Meier生存分析顯示治療后外周血miR-21高表達老年晚期宮頸癌患者經貝伐珠單抗治療后36個月生存率明顯低于低表達患者,差異具有統計學意義(P<0.05),見圖1A;外周血miR-130高表達患者生存率同樣低于低表達患者(P<0.05),見圖1B。

圖1 外周血miR-21、miR-130水平與患者生存率的關系
3 討論
有研究表明我國宮頸癌發病率呈上升趨勢,且發病年齡趨于年輕化,而宮頸癌早期發病隱匿難以診斷,晚期患者常伴隨腫瘤轉移和復發,導致宮頸癌成為我國致死率最高的女性生殖系統惡性腫瘤[10]。目前針對宮頸癌的治療方法以手術為主,但晚期宮頸癌治療手段極為有限,導致患者生存率較低[11]。近年來靶向藥物治療惡性腫瘤的研究趨于熱門,重組抗HER2單克隆抗體曲妥珠單抗(Trastuzumab)逐漸成為治療乳腺癌的一線藥物[12];程序性死亡分子抑制劑納武利尤單抗(Nivolumab)已被證實能夠有效延長晚期胃癌患者無病生存期[13];而貝伐珠單抗(Bevacizumab)是一種VEGF抑制劑,通過抑制腫瘤血管生成發揮抗腫瘤作用,研究表明貝伐珠單抗在治療晚期非小細胞肺癌(NSCLC)及各種婦科腫瘤時效果較好[14-15],但目前臨床缺乏相關療效預測標志物,無法對患者療效及預后進行預測,不利于實現腫瘤的精準治療。
本研究發現患者外周血中miR-21、miR-130水平與貝伐珠單抗治療老年晚期宮頸癌患者療效及預后相關。經貝伐珠單抗治療后患者外周血中miR-21、miR-130水平明顯下降,且不同治療效果組的患者外周血miR-21、miR-130水平各不相同,獲得CR及PR的患者外周血miR-21、miR-130水平明顯低于SD組患者。miRNA是一種短鏈非編碼RNA,參與基因表達水平轉錄后調控[16],miRNA的異常表達與多種疾病的發生發展相關,而在腫瘤相關疾病中尤為顯著[17]。miR-21是一種促瘤miRNA,相關研究表明其通過抑制PTEN基因的表達促進腫瘤的增殖和轉移。進一步研究顯示miR-21調節激酶磷酸化水平和基質金屬蛋白酶MMP-2和MMP-9的表達促進腫瘤的生長[18],下調miR-21的表達能夠顯著抑制結腸癌、肝癌、白血病等多種惡性腫瘤的進展[19]。肝癌及卵巢癌患者外周血miR-130水平與腫瘤發病及耐藥相關,對miR-130的深入研究發現其特異性靶基因也為PTEN,轉染miR-130的乳腺癌細胞株PTEN mRNA的水平明顯下降[20],提示miR-130通過下調PTEN表達促進腫瘤發展,但其機制尚不完全明確。結合本研究結果,miR-21、miR-130常在腫瘤患者外周血中高表達,而貝伐珠單抗治療后其表達水平下降且與療效相關,提示外周血miR-21、miR-130水平可能作為預測貝伐珠單抗治療效果的評價指標發揮作用。
miR-21、miR-130水平還能夠一定程度反映患者預后,研究表明miR-130可通過下調RUNX3表達水平導致胃癌患者預后不良的發生[21],而miR-21的高表達與乳腺癌、結腸癌、食管癌[22-23]等多種惡性腫瘤患者的預后不良相關。本研究發現外周血miR-21、miR-130高表達的患者經貝伐珠單抗治療后生存率明顯低于低表達患者,提示外周血miR-21、miR-130水平能夠作為貝伐珠單抗治療后患者預后的相關評估指標。國內學者Chen等[24]的研究發現miR-21能夠調節細胞中拓撲異構酶活性參與腫瘤耐藥的發生,可能與其導致的預后不良相關,而miR-130導致老年晚期宮頸癌患者預后不良的原因仍需進一步研究。
綜上所述,老年晚期宮頸癌患者經貝伐珠單抗治療后外周血miR-21、miR-130水平明顯下降,miR-21、miR-130水平與治療效果相關,且miR-21、miR-130高表達患者治療后死亡率較高。外周血miR-21、miR-130水平可能作為貝伐珠單抗治療老年晚期宮頸癌療效及預后的預測指標,為腫瘤精準治療提供依據。但本研究檢測樣本有限,且相關機制尚不明確,這些需要在后續研究中進一步改進和探討。

