原發性肝癌患者CT表現及其與VEGF及預后的關系
寧建東 彭懷斌 張海峰
原發性肝癌是我國常見的惡性腫瘤之一,發病率及死亡率較高[1],目前多采用CT等進行診斷,有研究指出,CT征象中腫瘤大小、強化類型等均與腫瘤組織增殖及浸潤有關[2]。新生血管形成是腫瘤組織增殖及浸潤的前提,血管內皮細胞生長因子(vascular endothelial growth factor,VEGF)是一種重要的促血管生成因子,與血管形成密切相關[3]。近年來,較多研究顯示實體腫瘤組織中多存在VEGF異常表達的現象[4],VEGF可在一定程度上反映腫瘤血管的生成速度,但尚無報道明確指出,原發性肝癌患者CT征象中腫瘤大小、強化類型等與VEGF表達的關系。故本研究通過分析不同VEGF表達及預后患者的CT表現,旨在探究原發性肝癌患者CT表現及其與VEGF及預后的關系,現報告如下。
1 材料與方法
1.1 臨床資料
經我院倫理委員會審核通過,以2015年1月至2017年11月收治的86例原發性肝癌患者為研究對象,其中男性46例,女性40例;年齡42~69歲,平均(59.25±4.79)歲;TNM分期:Ⅰ期15例、Ⅱ期28例、Ⅲ期30例、Ⅳ期13例;分化程度:低、中分化65例,高分化21例;病理類型:肝細胞癌54例,膽管細胞癌32例。
納入標準:①根據《原發性肝癌規范化病理診斷指南(2015年版)》[5]診斷為原發性肝癌,并經病理學確診者;②患者均知情本研究的研究目的,且已簽署同意書;③均行手術治療。排除標準:①嚴重心腦血管疾病患者;②入組前已接受手術、放化療治療者;③合并其他惡性腫瘤疾病患者;④臨床資料不完整者。
1.2 方法
CT掃描:應用Siemens volum zoom 多層螺旋CT掃描儀進行檢查,行肝臟多期連續容積掃描,層厚8 mm,螺距1.5∶1,應用高壓注射器于前壁靜脈處注射80~100 ml歐乃派克,注射速率為2.5 ml/s,于注射開始后20~25 s(動脈期)、45~60 s(門靜脈期)、180~300 s(延遲期)進行掃描,掃描參數:層厚5~10 mm,螺距5 mm,管電壓120 kv,管電流200~250 mA,矩陣512×512,主要觀察腫瘤大小,包膜完整性等。
VEGF水平測定:應用邁新生物技術公司的免疫組化試劑盒,采用免疫組化Elivision plus法檢測肝癌組織VEGF表達情況,用10%中性福爾馬林固定標本,石蠟包埋,連續切片。常規脫蠟水化處理,在室溫下用3%H2O2孵育15 min后,將樣本置于檸檬酸緩沖液中,放入高壓鍋內進行抗原修復,然后用PBS液沖洗樣本3次,加羊血清后在室溫下孵育30 min,滴加鼠抗人VEGF一抗在4 ℃下孵育8 h。用PBS液沖洗樣本3次,甩去PBS液后滴加聚合增強物,在室溫下孵育20 min,用PBS液再次沖洗樣本3次,滴加酶標抗鼠聚合物后在室溫下孵育30 min,DAB顯色,蘇木精復染30 s。用PBS作陰性對照。陽性判斷[6]:如細胞質內出現棕黃色顆粒為陽性細胞,陽性細胞數≥30%為陽性組,<30%及無著色組為陰性組。
1.3 觀察指標
(1)比較VEGF陽性組及VEGF陰性組的CT表現,并分析影響VEGF表達的相關因素。(2)根據術后3年生存情況將肝癌患者分為生存組及死亡組,比較2組的CT表現,分析影響患者預后的相關因素,并采用ROC曲線分析各危險因素對預后的預測價值。(3)比較VEGF陽性組及VEGF陰性組的3年生存率。
1.4 統計學處理
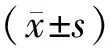
2 結果
2.1 VEGF陽性組及VEGF陰性組的CT表現比較
VEGF陽性組在腫瘤形態不規整、無腫瘤包膜、有門靜脈血栓及動脈期不均勻強化方面的人數比例高于VEGF陰性組(P<0.05),見表1。

表1 VEGF陽性組及VEGF陰性組的CT表現比較(例,%)
2.2 影響VEGF表達的相關因素分析
腫瘤形態不規整、無腫瘤包膜、有門靜脈癌栓、動脈期不均勻強化是影響患者肝癌組織VEGF表達的危險因素(P<0.05),見表2。

表2 影響VEGF表達的相關因素分析
2.3 生存組和死亡組的CT表現比較
死亡組在腫瘤形態不規整、無腫瘤包膜、有門靜脈血栓及動脈期不均勻強化方面的人數比例高于生存組(P<0.05),見表3。

表3 生存組和死亡組的CT表現比較(例,%)
2.4 影響原發性肝癌患者預后的危險因素分析
腫瘤形態不規整、無腫瘤包膜、動脈期不均勻強化是影響患者原發性肝癌患者預后的危險因素(P<0.05),見表4。

表4 影響原發性肝癌患者預后的危險因素分析
2.5 各危險因素對預后的預測價值
腫瘤形態不規整、無腫瘤包膜、動脈期不均勻強化聯合預測患者預后的AUC大于0.75,見表5、圖1。

表5 各危險因素對預后的預測價值

圖1 各危險因素對預后預測價值的ROC曲線分析
2.6 VEGF陽性組及VEGF陰性組的預后比較
VEGF陽性組、VEGF陽性組術后3年生存率分別為62.75%(32/51)、71.43%(25/35),2組生存率對比無明顯差異(χ2=0.700,P=0.403)。
3 討論
腫瘤新生血管的形成是腫瘤生長和轉移的病理基礎[7]。相關報道指出,VEGF表達水平可反映肝癌血管內皮細胞增殖、遷移和血管構建水平,與肝癌的生長速度和轉移傾向密切相關[8-9]。VEGF是腫瘤組織中特異性最高的血管調控因子,不僅能增加血管通透性,還能促進內皮細胞增殖[10]。而腫瘤的生長方式和生長速度決定腫瘤周邊及內部結構的影像學表現,肝癌的腫瘤大小、包膜、強化類型等CT表現均與癌組織的血供、增殖及浸潤有關[11]。本研究發現,腫瘤形態不規整、無腫瘤包膜、有門靜脈癌栓、動脈期不均勻強化是影響患者肝癌組織VEGF表達的危險因素,表明患者肝癌組織VEGF表達情況與腫瘤形態、有無腫瘤包膜等有關。其原因在于,VEGF的過表達可促進血管生成,改善局部血供,使腫瘤細胞能夠得到充足的營養供應,讓其向周圍正常組織浸潤,進而形成不完整的包膜。另外VEGF的異常表達會使腫瘤的快速生長與營養供應之間出現異常,腫瘤內部液化、壞死,使其向周圍正常肝組織的浸潤增加,導致腫瘤邊界不清[12-13]。
原發性肝癌患者的死亡率居于我國腫瘤死亡率的第二位,其死亡率在近些年來有不斷增高的趨勢,該病易侵犯門靜脈分支,并侵犯周圍組織器官,影響患者預后[14]。經CT診斷可觀察患者肝臟病理性特征,或有助于醫師對患者預后進行初步判斷。本研究結果顯示,腫瘤形態不規整、無腫瘤包膜、動脈期不均勻強化是影響患者原發性肝癌患者預后的危險因素,說明腫瘤形態不規整等可能會影響患者術后生存,這主要是因為強化不均勻的腫瘤內部結構異常,新生血管較多,出現遠處轉移的可能性也較大,故而導致其預后變差;而腫瘤形態不規整、包膜不完整的肝癌呈現快速侵襲性生長時,癌細胞向周圍組織浸潤,進而導致不良預后的發生[15]。提示或可通過觀察各CT征象來判斷患者預后。但本研究結果顯示,各CT征象單獨檢測對患者預后的預測價值較低,而聯合預測患者預后的AUC大于0.75,表明可通過CT征象聯合檢測的方式來預測患者術后3年生存情況。VEGF表達水平可反映腫瘤血管的形成速度、腫瘤生長速度及轉移傾向,隨著腫瘤體積增大,所需血供增加,腫瘤組織中VEGF水平升高,腫瘤快速增長導致內部缺血缺氧,組織壞死,進而影響患者預后[16],提示其或與患者預后存在某種關聯。本研究結果顯示,VEGF陽性組、VEGF陽性組術后3年生存率對比無明顯差異,與既往研究結果存在差異[17],這主要與樣本量少,且2組患者人數比例不均有關。
綜上所述,原發性肝癌患者的VEGF表達及預后與腫瘤形態不規整、無腫瘤包膜、動脈期不均勻等CT征象有關,并可通過觀察腫瘤形態不規整、無腫瘤包膜、動脈期不均勻等CT征象來判斷患者預后,但患者癌組織VEGF表達情況與預后無關。

