HPLC法對注射用右蘭索拉唑中有關物質的測定
張余霞,譚定淵,史朝暉
(海南碧凱藥業有限公司,海口 570311)
隨著社會經濟的發展,人們生活水平提高以及生活方式的改變,胃腸道疾病的發病率越來越高。2015年在我國城市醫院住院患者前10位疾病構成中,消化系統疾病位列第2(占10.14%),而在縣級醫院中比例達11.10%[1]。消化性潰瘍發病原因與胃黏膜屏障受損、黏膜防御/修復機制失衡等因素有關。消化性潰瘍在侵蝕胃黏膜血管后,會造成消化道出血或穿孔甚至危及生命[2]。上消化道出血的最常見病因是消化性潰瘍,消化性潰瘍出血占全部上消化道出血病因的47.43%[3]。
右蘭索拉唑為蘭索拉唑的右旋單一光學異構體,屬于質子泵抑制劑(proton pump inhibitor,PPI),具有生物活性,為抑制胃酸分泌的新型藥物。其結構為苯并咪唑類衍生物,作用于二硫鍵與質子泵(H+-K+-ATP)酶,阻斷H+的轉運,從而減少胃酸分泌。主要用于非糜爛性胃食管反流病(non-erosive reflux disease,NERD)的“燒心”癥狀的控制、各種程度的糜爛性食管炎(erosion esophagitis,EE)和糜爛性食管炎愈合期的維持治療。質子泵抑制劑是目前抑制胃酸分泌強效藥物[4]。
2009年,美國FDA批準日本武田制藥公司研發的右蘭索拉唑緩釋膠囊上市[5](商品名為Dexilant?)。2016年,美國FDA批準武田制藥美國有限公司的右蘭索拉唑緩釋口服崩解片上市[6](商品名為Dexilant Solutab)。
右蘭索拉唑制劑的質量控制相關方法的報道較少。曾垂宇等[7]建立高效液相色譜法(HPLC)測定右蘭索拉唑緩釋膠囊的含量測定及其有關物質。對含量和有關物質的分析方法進行方法學驗證,結果提示右蘭索拉唑與有關物質分離度良好,且空白輔料不干擾檢測。郭俊平[8]采用反相高效液相色譜法對右旋蘭索拉唑控釋膠囊中左旋和右旋異構體進行拆分并測定其中左旋異構體含量,驗證結果顯示該方法可用于右旋蘭索拉唑控釋膠囊中左旋異構體的含量測定。張莉華等[9]采用正相高效液相色譜法測定注射用右旋蘭索拉唑中左旋異構體的含量,結果提示其方法學驗證可行。
本研究在注射用右蘭索拉唑處方工藝的基礎上,參考《歐洲藥典》蘭索拉唑有關物質的測定方法[10],建立了注射用右蘭索拉唑的高效液相色譜法。
1 材料
1.1 藥品與試劑
注射用右蘭索拉唑(海南碧凱藥業有限公司,批號20160601,規格15 mg,純度99.8%);右蘭索拉唑對照品(加拿大TRC公司,批號2-DXX-95-1,規格100 mg,純度99.6%);雜質A~E對照品(LGC英國政府化學家實驗室,批號:30193、33121、11914、37957、35254,規格100 mg,純度98.7%、98.4%、95.8%、99.9%、99.9%);三乙胺(羅恩試劑,色譜純,規格500 ml,純度99.0%);乙腈(ThermoFisher公式,色譜純,規格4 L,純度99.9%);磷酸(廣州化學試劑廠,色譜純,規格500 ml,純度85.0%)。
1.2 儀器
LC-20AT液相色譜儀(日本島津儀器設備有限公司,PDA檢測器);XS205DU電子分析天平(瑞士梅特勒-托利多公司)。
2 方法與結果
2.1 色譜條件
色譜柱:Agilent Extend-C18柱(250 mm×4.6 mm,5 μm);流動相:三乙胺-水(用磷酸調節至pH 6.2)-乙腈(1∶60∶40);檢測波長:285 nm;流速:1.2 ml/min;進樣量:10 μl。
2.2 溶液制備
供試品溶液:取注射用右蘭索拉唑適量,精密稱定,用稀釋劑[三乙胺-水(用磷酸調節至pH 10.5)-乙腈(1∶60∶40)]溶解并稀釋制成每1 ml中含右蘭索拉唑1 mg的溶液,作為供試品溶液。
自身對照品溶液:精密量取供試品溶液適量,用稀釋劑定量稀釋制成每1 ml中含右蘭索拉唑2 μg的溶液,作為對照品溶液。
系統適用性溶液:取右蘭索拉唑、雜質B對照品適量,精密稱定,加稀釋劑超聲溶解并稀釋制成每1 ml中含右蘭索拉唑1 mg及雜質B 40 μg的溶液,作為系統適用性溶液。
2.3 系統適用性試驗
取系統適用性溶液10 μl注入液相色譜儀,記錄色譜圖至主成份峰保留時間的3倍。右蘭索拉唑峰與雜質B峰之間的分離度應>3.0。見圖1。
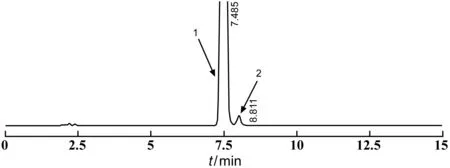
1:右蘭索拉唑;2:雜質B圖1 系統適用性色譜圖
2.4 專屬性試驗
2.4.1空白輔料干擾試驗
精密稱取空白輔料適量,置于10 ml量瓶中,加稀釋劑溶解并稀釋至刻度,搖勻,精密量取10 μl注入液相色譜儀。空白輔料溶液在保留時間3 min后無色譜峰出現,不干擾本品的有關物質測定。見圖2。

圖2 空白輔料色譜圖
2.4.2供試品溶液
取注射用右蘭索拉唑適量,精密稱定,用稀釋劑溶解并稀釋制成每1 ml中含右蘭索拉唑1 mg的溶液,作為供試品溶液。在“2.1”的色譜條件下進樣,記錄色譜圖。見圖3。
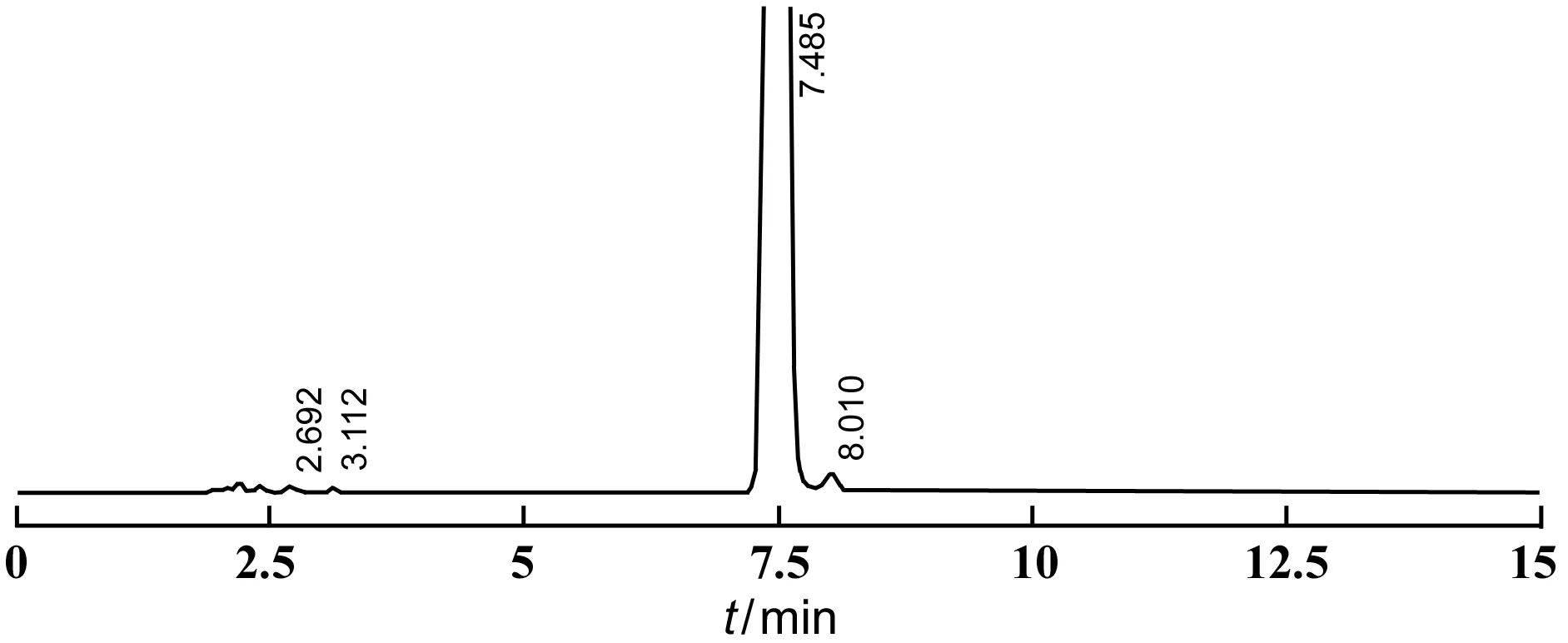
圖3 注射用右蘭索拉唑供試品圖譜
2.4.3已知雜質對照品混合溶液
精密稱取右蘭索拉唑、起始物料(氯化物,見圖4“6”注釋)、雜質A~E對照品適量,分別加少量稀釋劑超聲溶解并用稀釋劑稀釋至刻度,搖勻,作為儲備液;精密移取各儲備液1 ml置同一10 ml量瓶中,加稀釋劑稀釋至刻度,搖勻,作為混合對照品溶液,取10 μl注入液相色譜儀,記錄色譜圖。結果顯示,各雜質峰、起始物料峰、右蘭索拉唑峰之間的分離度均>1.5,達到系統適用性要求。見圖4。
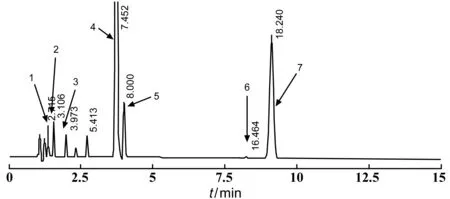
1:雜質D;2:雜質E;3:雜質A;4:右蘭索拉唑;5:雜質B;6:氯化物[2-氯甲基-3-甲基-4-(2,2,2-三氟乙氧基)-2-吡啶鹽酸鹽];7:雜質C圖4 混合對照品溶液色譜圖
2.5 檢測限和定量限
分別取右蘭索拉唑與雜質A~E對照品適量,精密稱定,用稀釋劑超聲溶解并用稀釋劑稀釋制成一定濃度的溶液作為儲備液。采用逐步稀釋法進行試驗,以信噪比不小于10為定量限,信噪比不小于3為檢測限。測定結果見表1。
2.6 線性和范圍
精密稱取雜質A~E、右蘭索拉唑對照品各約10 mg,分別置于50 ml量瓶中,精密稱取雜質B約10 mg,置于20 ml量瓶中,加稀釋劑適量溶解并稀釋至刻度,搖勻,分別作為雜質A~E、右蘭索拉唑對照品的儲備液;分別精密量取雜質A、C、D、E、右蘭索拉唑對照品儲備液1 ml,雜質B對照品儲備液2 ml,置同一10 ml量瓶中,加稀釋劑稀釋至刻度,搖勻,作為混合對照品儲備液。分別精密量取混合對照品儲備液適量,用稀釋劑稀釋成溶液雜質A~E 20、40、20、20和20 μg/ml,分別精密量取上述溶液各 10 μl 注入液相色譜儀,記錄色譜圖,測量峰面積。以峰面積y為縱坐標,進樣濃度x為橫坐標,做線性回歸曲線(線性回歸時以定量限結果為線性起始點)。測定結果見表2~3。
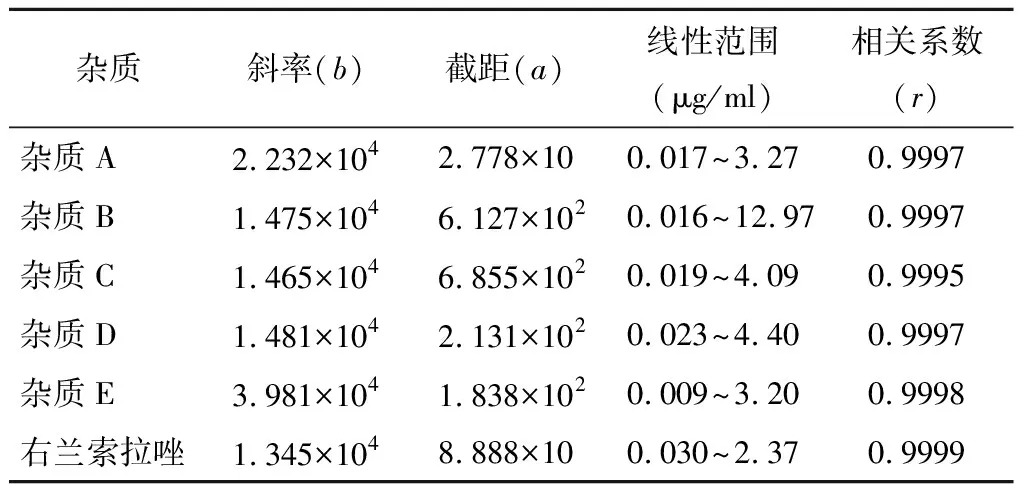
表2 標準曲線 n=6

表3 雜質的校正因子
校正因子=Slope主藥/Slope雜質
結果可知,雜質B~D的校正因子在0.9~1.1范圍內,可以用主成份自身對照法計算含量;雜質A和E的校正因子分別為0.60和0.34,可用加校正因子的主成份自身對照法計算雜質A和E的含量。
采用主成份自身稀釋對照法計算有關物質含量,計算公式:

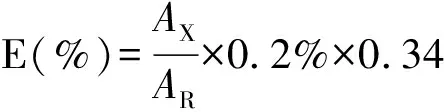
總雜質計算公式:總雜質(%)=雜質A(%)+雜質B(%)+雜質C(%)+雜質D(%)+雜質E(%)+其他雜質(%)
其中,AX:供試品中雜質的峰面積;AR:對照品溶液中主峰的峰面積。
2.7 準確度試驗
精密稱定雜質A~E對照品各適量,用稀釋劑分別溶解并稀釋,制成雜質A、C、D、E濃度為200 μg/ml的溶液,雜質B為400 μg/ml的溶液,搖勻,作為各雜質對照品儲備液;分別精密量取各雜質對照品儲備液0.8、1和1.2 ml,置于10 ml量瓶中,同時精密量取供試品適量(相當于右蘭索拉唑10 mg),分別置于上述10 ml量瓶中,加稀釋劑稀釋至刻度,作為80%、100%和120%回收率樣品溶液;每個濃度平行制備3份。精密量取雜質對照品儲備液1 ml,置于10 ml量瓶中,加稀釋劑稀釋至刻度,搖勻,作為對照品溶液。
分別取上述雜質對照品溶液、供試品溶液及回收率樣品溶液各10 μl,注入液相色譜儀,記錄色譜圖,采用外標法計算雜質回收率。回收率測定結果見表4~8。
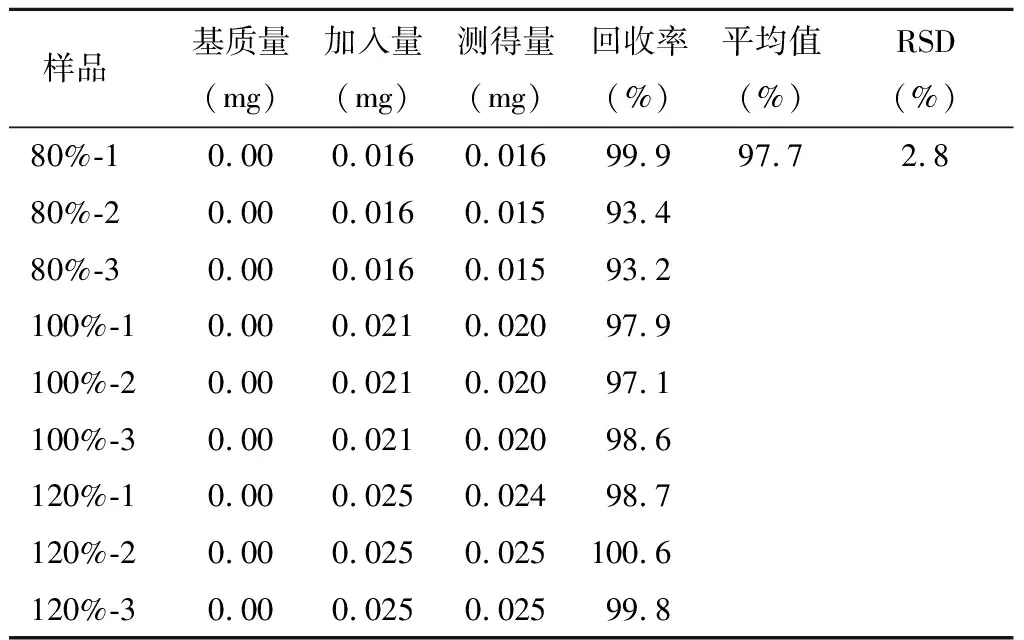
表4 雜質A回收率測定結果 n=9
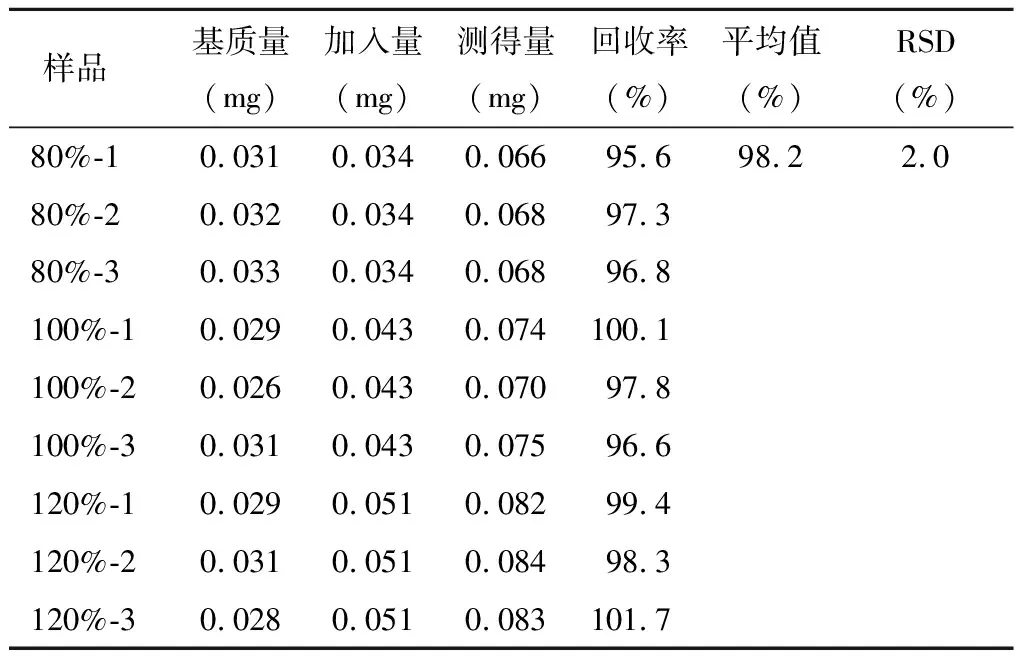
表5 雜質B回收率測定結果 n=9
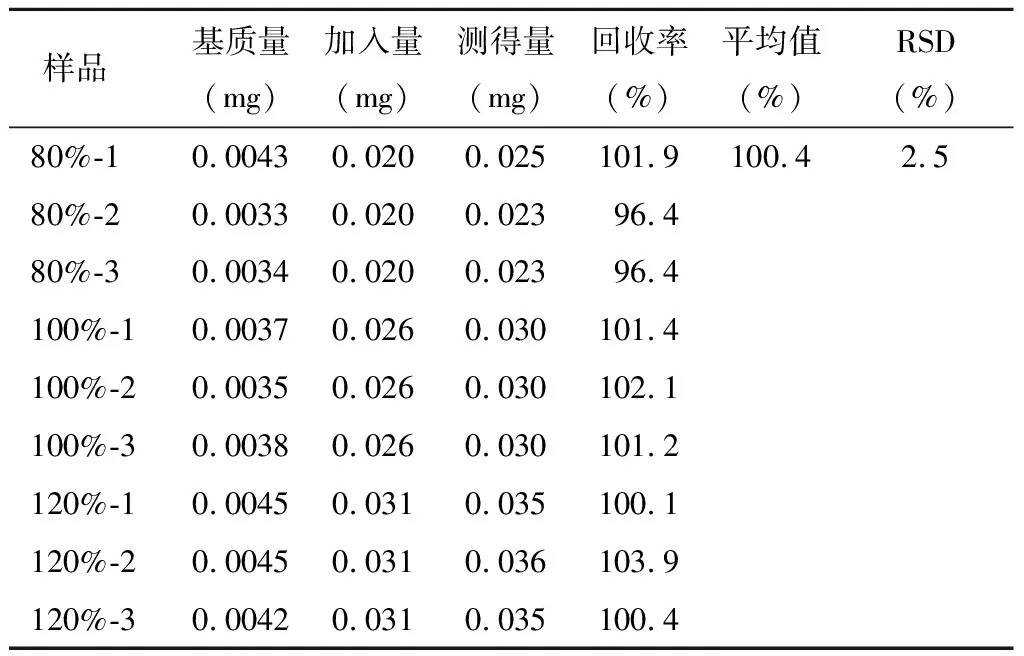
表6 雜質C回收率測定結果 n=9
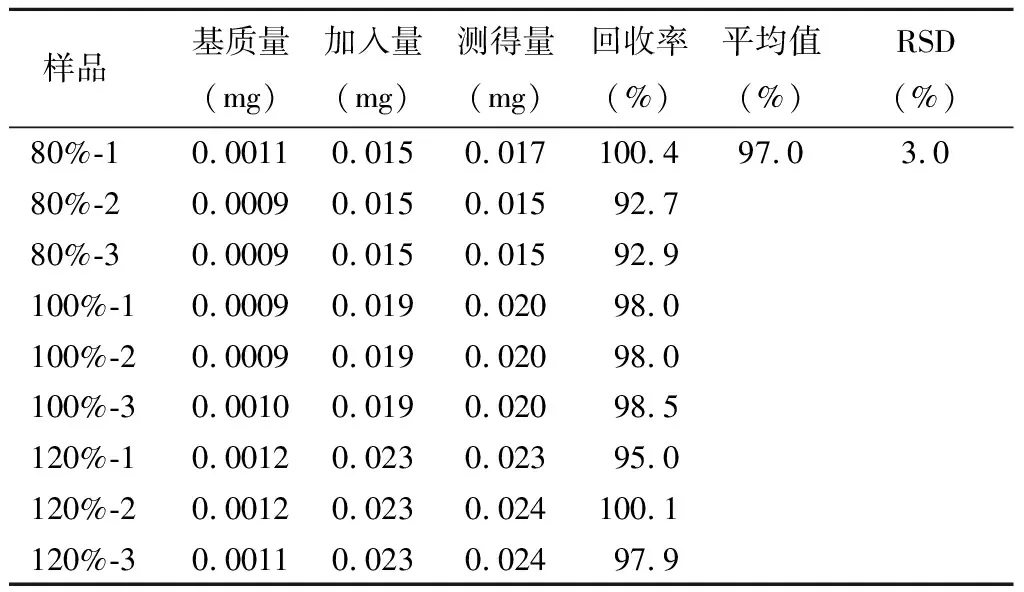
表8 雜質E回收率測定結果 n=9
結果顯示,各雜質的回收率均符合要求,準確度良好。
2.8 精密度試驗
2.8.1重復性
取注射用右蘭索拉唑10瓶,取出內容物,混勻,精密稱定粉末(相當于右蘭索拉唑10 mg),加適量稀釋劑溶解,并稀釋制成每1 ml含右蘭索拉唑約 1 mg 的溶液,搖勻,濾過,取續濾液作為供試品溶液。精密量取適量,用稀釋劑稀釋成每1 ml中含右蘭索拉唑 2 μg 的溶液作為對照品溶液,平行配制6份。取上述方法制備的對照品溶液和供試品溶液各10 μl,進樣測定,記錄色譜圖,計算雜質含量,測定結果見表9。
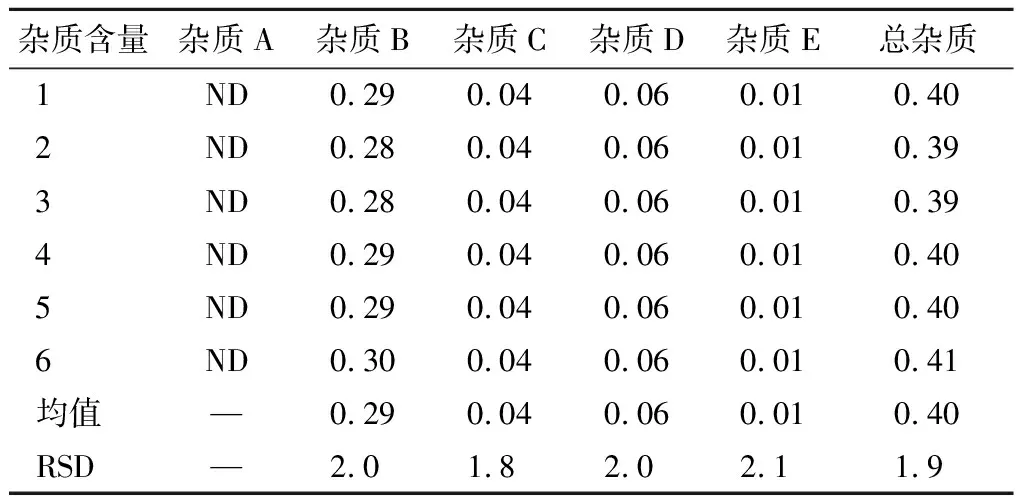
表9 重復性測定結果 %
ND:未檢出。下表同。
結果顯示,本方法的重復性良好。
2.8.2中間精密度
由不同分析人員在不同日期、不同儀器上測定同一批注射用右蘭索拉唑樣品雜質的含量,考察中間精密度。見表10。
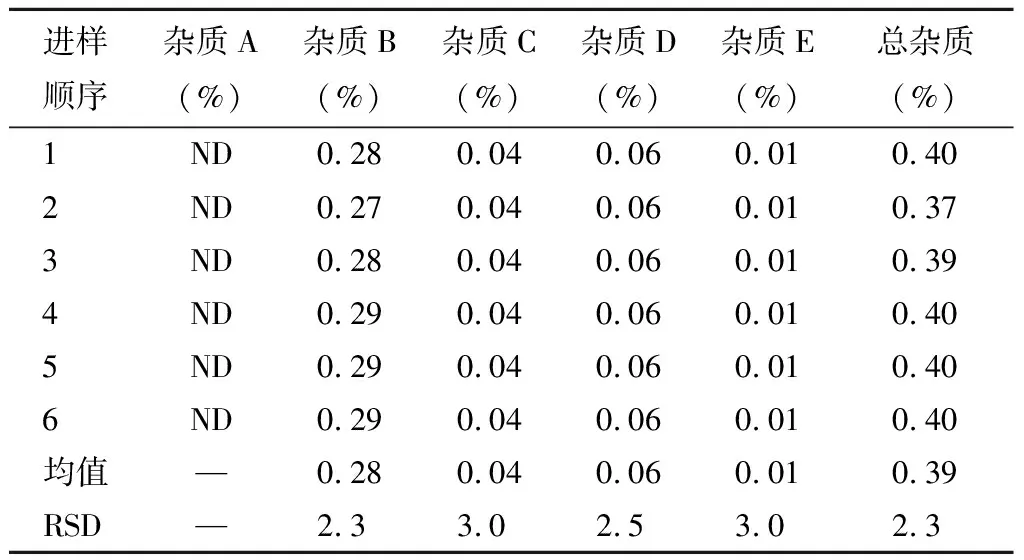
表10 中間精密度測定結果 %
中間精密度:儀器二、分析人員B
結果顯示,12個樣品的雜質A均未檢出;雜質B的平均值為0.28%,RSD為2.3%;雜質C的平均值為0.04%,RSD為3.0%;雜質D的平均值為0.06%,RSD為2.5%;雜質E的平均值為0.01%,RSD為3.0%;總雜質的平均值為0.39%,RSD為2.3%。表明本方法中間精密度良好。
2.9 溶液穩定性試驗
取重復性第1份樣品,作為供試品溶液;精密量取適量,用稀釋劑稀釋制成每1 ml中含右蘭索拉唑2 μg的溶液作為對照品溶液。在室溫條件下放置0、2、4、6和8 h,分別精密吸取供試品溶液與對照品溶液各10 μl,注入高效液相色譜儀,計算雜質含量。見表11。
結果表明,供試品溶液在室溫條件下放置8 h,穩定性良好。
2.10 耐用性試驗
取注射用右蘭索拉唑10瓶,取出內容物,混勻,精密稱定粉末(相當于右蘭索拉唑10 mg),加適量稀釋液,超聲溶解后,用稀釋溶液稀釋成每1 ml含右蘭索拉唑約1 mg的溶液,搖勻,過濾,取續濾液作為供試品溶液;精密量取適量供試品溶液,用稀釋溶液稀釋成每1 ml中含右蘭索拉唑2 μg的溶液作為對照品溶液。分別考察乙腈比例變化±2%,流速變化±0.1 ml/min,流動相pH±0.2,柱溫變化±5 ℃及不同品牌色譜柱條件下,雜質B與主峰的分離度。見表12。
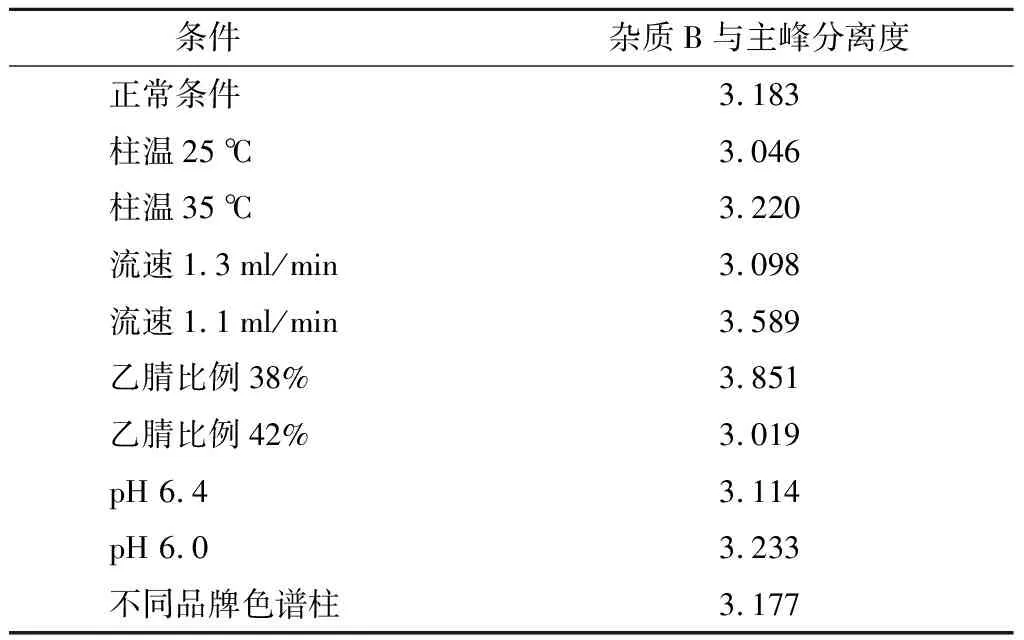
表12 耐用性試驗結果
結果顯示,各條件下主成份峰與雜質B峰分離度均>3.0。表明該方法的耐用性良好。
2.11 樣品測定
取3批注射用右蘭索拉唑(批號20160601、20160602、20160701),按“2.2”項下方法制備供試品溶液,按“2.1”項下色譜條件進樣分析。見表13。
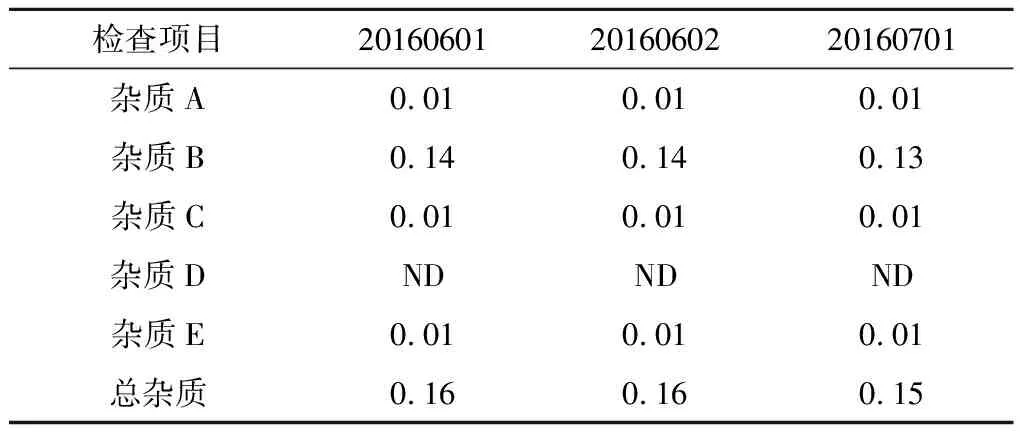
表13 有關物質測定結果 %
經方法學驗證,有關物質的檢查方法可行。
3 討論
本研究建立了HPLC法測定注射用右蘭索拉唑有關物質的方法,確定色譜條件并進行了方法學考察。經方法學驗證,表明方法專屬性強、準確度高、重復性好,適用于注射用右蘭索拉唑中有關物質的檢測。
有關物質分析方法考慮的雜質間及與主峰間分離度需達到有關要求,通過系統的方法開發,考慮到雜質B與右蘭索拉唑主峰的相對保留時間較為接近,故系統適用性溶液以右旋蘭索拉唑與雜質B的分離度應>3.0作為系統通過的判定條件。
取適量注射用右蘭索拉唑用稀釋液溶解并稀釋成含右蘭索拉唑10 μg/ml的溶液,在紫外200~400 nm的波長下進行掃描,其在210及285 nm附近均有最大吸收,但在285 nm波長處時,供試品檢出雜質個數及量均高于210 nm,且制劑中其他輔料峰位于低紫外210 nm波長處干擾明顯高于285 nm波長,所以最終285 nm作為本品有關物質的控制檢測波長。
流動相參考《中國藥典》[11]蘭索拉唑標準,選擇水及乙腈作為主要溶劑,通過加入三乙胺及磷酸調節pH來控制供試品中各物質存在的離子形式,避免峰型拖尾,確保積分準確。

