大鼠癲癇持續(xù)狀態(tài)后海馬神經(jīng)傳遞環(huán)路CB1R表達特征
孟憲棟, 張海鋒
大麻素Ⅰ型受體(CB1R)在中樞神經(jīng)系統(tǒng)廣泛分布,主要存在于興奮性和抑制性突觸終末,內(nèi)源性大麻素(endocannabinoids,EC)在神經(jīng)元活動加強時,可以在突觸后神經(jīng)元合成、釋放,抑制谷氨酸和GABA釋放[1],對神經(jīng)傳導進行調(diào)控。近年來,CB1R 介導的信號機制被認為在控制癲癇急性發(fā)作上發(fā)揮重要作用[2,3],因此推測CB1R可能與癲癇發(fā)生有關,并且在癲癇發(fā)生中對CB1R表達進行了探討。海馬內(nèi)部存在由內(nèi)嗅區(qū)-齒狀回-CA3區(qū)-CA1區(qū)-下托皮質(zhì)-內(nèi)嗅區(qū)的單向神經(jīng)傳遞環(huán)路[4],SE后海馬神經(jīng)傳遞閉合環(huán)路上CB1R表達特征未見報道。因此,我們對大鼠SE后,海馬神經(jīng)傳遞閉合環(huán)路上CB1R進行光密度測定,觀察各區(qū)域CB1R表達的時空特征,探討CB1R在癲癇發(fā)生中的作用。
1 材料與方法
1.1 材料
1.1.1 實驗動物 3月齡SD大鼠(空軍軍醫(yī)大學動物實驗中心),清潔級,不限雌雄,實驗獲空軍軍醫(yī)大學動物倫理委員會批準。
1.1.2 主要試劑 CB1R抗體(Abcam),GFAP抗體(Sigma),NeuN抗體(Sigma)。
1.1.3 主要儀器 冰凍切片機(Leica),正置顯微鏡(Olympus)。
1.2 方法
1.2.1 氯化鋰-匹羅卡品建立慢性癲癇模型 SD大鼠隨機分成實驗組和對照組,建立氯化鋰-匹羅卡品癲癇模型。給大鼠腹腔注射氯化鋰(127 mg/kg),18~20 h后,甲溴東莨菪堿 (1 mg/kg) 腹腔注射,30 min后,腹腔注射匹羅卡品(30 mg/kg),對發(fā)作進行分級[5]:Ⅰ級:肢體和面部自動癥;Ⅱ級:點頭和咀嚼;Ⅲ級:前肢痙攣;Ⅳ級:伴直立的前肢痙攣;Ⅴ級:摔倒。≥Ⅳ級判定為癲癇持續(xù)狀態(tài)(status epilepticus,SE),發(fā)作持續(xù)1 h,腹腔注射地西泮(10 mg/kg)終止。依據(jù)SE后不同時間點,分為SE1 w、2 w、3 w、4 w,每組4只,各時間點設立對照組,對照大鼠腹腔注射0.9%NaCl溶液,其他操作與實驗組相同。
1.2.2 海馬組織標本制備 SE后1 w、2 w、3 w、4 w組SD大鼠以及對照組大鼠,進行10%水合氯醛麻醉,灌注固定。生理鹽水灌注1 min,然后4%多聚甲醛固定液灌注固定30 min,30%蔗糖溶液后固定,4 ℃過夜。行腦冠狀切片,片厚12 μm固定于載玻片。將所有切片行CB1R/NeuN/GFAP免疫組化染色。
1.2.3 海馬CB1R、NeuN、GFAP免疫組化檢測 血清封閉液封閉切片2 h,加一抗兔抗大鼠CB1R抗體(1∶300),4 ℃過夜。PBS洗片,加生物素化抗兔抗體(1∶300),室溫3 h,加鏈霉素-生物素-過氧化物酶復合物,4 ℃過夜,DAB顯色。脫水、封片,Olympus正置顯微鏡觀察、拍照。神經(jīng)元染色加一抗小鼠抗NeuN單抗(1∶500)孵育,二抗為生物素化羊抗小鼠IgG(1∶300)。星形膠質(zhì)細胞染色加一抗小鼠抗GFAP單抗(1∶2000),二抗為生物素化羊抗小鼠IgG(1∶300)。
1.2.4 免疫組化定量分析 每只大鼠海馬取4張冠狀切片行CB1R定量分析。在CA1區(qū)放射層、CA3區(qū)透明層,以及齒狀回分子層,利用Image-Pro Plus軟件進行CB1R染色光密度測量,并計算分析區(qū)域平均光密度(MIOD)。
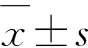
2 結 果
2.1 SE后不同時間點大鼠海馬CB1R表達 在對照組和SE后不同時間點,海馬CB1R呈點、線狀分布,考慮與CB1R在抑制性突觸前膜和軸突末端分布有關(見圖1)。在CA1區(qū)放射層(S. R),測量各時間點MIOD,CB1R表達均高于對照(P<0.05),且CB1R表達在SE后4 w(0.0311±0.00451),高于SE后1 w(0.0205±0.00102)、2 w(0.0229±0.00219)、3 w(0.0209±0.00209)(P<0.05)(見圖2A);在CA3區(qū)透明層,SE后各時間點CB1R表達均高于對照(P<0.05),CB1R表達在SE后4 w(0.0279±0.00252),高于SE后1 w(0.0194±0.00385)(P<0.05)(見圖2B);在海馬分子層,SE后各時間點CB1R表達均高于對照(P<0.05),但是CB1R表達在SE后1 w(0.0276±0.00413)、2 w(0.0326±0.00264)、3 w(0.0321±0.00380)、4 w(0.0334±0.00427)之間無統(tǒng)計學差異(P>0.05)(見圖2C)。

A:對照大鼠海馬,A中1位于CA1區(qū)、2位于CA3區(qū)、3位于齒狀回,A1、A2、A3為圖A中1、2、3區(qū)域放大;B:SE后1 w大鼠海馬,B中1位于CA1區(qū)、2位于CA3區(qū)、3位于齒狀回,B1、B2、B3為圖B中1、2、3區(qū)域放大;C:SE后2 w大鼠海馬,C中1位于CA1區(qū)、2位于CA3區(qū)、3位于齒狀回,C1、C2、C3為圖C中1、2、3區(qū)域放大;D:SE后3 w大鼠海馬,C中1位于CA1區(qū)、2位于CA3區(qū)、3位于齒狀回,C1、C2、C3為圖C中1、2、3區(qū)域放大;E:SE后4 w大鼠海馬,E中1位于CA1區(qū)、2位于CA3區(qū)、3位于齒狀回,E1、E2、E3為圖E中1、2、3區(qū)域放大。S. O:始層;S. P:錐體細胞層;S. R:放射層;S. L:透明層;S. M:分子層;S. G:顆粒細胞層;H:門區(qū)。圖標=200 (A、B、C、D、E) μm;圖標=20 (A1~A3、B1~B3、C1~C3、D1~D3、E1~E3) μm

A:對照(CON)和SE后1 w、2 w、3 w、4 w,CA1區(qū)放射層(S. R)CB1R平均光密度(MIOD)比較;B:對照(CON)和SE后1 w、2 w、3 w、4 w,CA3區(qū)透明層(S. L)MIOD比較;C:對照(CON)和SE后1 w、2 w、3 w、4 w,分子層(S. M)MIOD比較;數(shù)值以表示。*P<0.05表示和對照組比較具有統(tǒng)計學差異,**P<0.05表示多重組間比較具有統(tǒng)計學差異
2.2 大鼠SE后4W海馬神經(jīng)元和星形膠質(zhì)細胞變化特征 SE后4 w,海馬錐體細胞層神經(jīng)元排列紊亂,密度明顯降低(見圖3),星形膠質(zhì)細胞增生肥大(見圖4),因此,本研究建立的癲癇模型,具備海馬硬化的兩個基本特征,即神經(jīng)元的大量丟失和星形膠質(zhì)細胞增生、肥大[6]。

A:對照大鼠海馬NeuN表達,A1為圖A中矩形框內(nèi)區(qū)域放大。B:SE后4W大鼠海馬NeuN表達,B1為圖B中矩形框內(nèi)區(qū)域放大。S. O:始層;S. P:錐體細胞層;S. R:放射層。圖標=200 (A、B) μm;圖標=20 (A1、B1) μm

A:對照大鼠CA1區(qū)放射層GFAP表達,A1為圖A中矩形框內(nèi)區(qū)域放大。B:對照大鼠海馬CA4區(qū)GFAP表達,B1為圖B中矩形框內(nèi)區(qū)域放大。C:SE后4 w大鼠CA1區(qū)放射層GFAP表達,C1為圖C中矩形框內(nèi)區(qū)域放大。D:SE后4 w大鼠海馬CA4區(qū)GFAP表達,D1為圖D中矩形框內(nèi)區(qū)域放大。S. O:始層;S. P:錐體細胞層;S. R:放射層;S. G:顆粒細胞層。圖標=200 (A、B)μm;圖標=20 (A1、B1)μm
3 討 論
CB1R位于神經(jīng)元軸突和突觸終末,內(nèi)源性大麻素在神經(jīng)傳遞增強時合成增加,綁定突觸前膜CB1R,抑制神經(jīng)傳導[7]。興奮性神經(jīng)遞質(zhì)和抑制性神經(jīng)遞質(zhì)的平衡決定神經(jīng)網(wǎng)絡的興奮性,CB1R激活對二者釋放皆有抑制作用,因此,CB1R信號通路對神經(jīng)網(wǎng)絡的影響,是由不同細胞上CB1R活化的綜合效果決定。此外存在CB1R的非逆行調(diào)控,例如星形膠質(zhì)細胞以及線粒體CB1R信號通路,使內(nèi)源性大麻素信號傳導復雜化[8]。大麻素受體在海馬中高度表達,慢性應激會調(diào)節(jié)海馬CB1受體的表達和內(nèi)源性大麻素水平[9]。大麻二酚等多種CB1R激動劑具有抗癇作用[10],純化的植物性大麻二酚用于治療小兒難治性癲癇[11],CB1R阻斷劑可以導致癲癇發(fā)作[12]。CB1R激活后的信號通路與癲癇急性發(fā)作的終止密切相關,癲癇持續(xù)狀態(tài)后CB1R表達發(fā)生改變,CB1R的這種抗癇作用是否會發(fā)生改變呢?SE后大鼠海馬CB1R表達增加[2]。人腦海馬對照研究顯示,癲癇患者CB1RmRNA下調(diào),硬化海馬始層、錐體細胞層、放射層、分子層CB1R表達下降[13]。我們認為,這種下調(diào)可能與海馬硬化晚期,神經(jīng)元細胞大量死亡導致突觸密度減低有關。
除了SE后CB1R變化之外,EC的變化也對CB1R信號通路產(chǎn)生影響。大鼠SE后海馬2-AG、AEA產(chǎn)生增加。然而,癲癇患者腦脊液AEA濃度較對照下降[14]。癲癇發(fā)生過程中,EC如何變化?研究結果不甚一致,說明EC在癲癇發(fā)生的不同階段存在波動,提示EC調(diào)控具有復雜性。EC降解酶抑制劑及合成酶抑制劑對癲癇發(fā)生的作用尚不清楚。CB1R阻斷劑利莫那班可以防止大鼠腦外傷后期神經(jīng)網(wǎng)絡興奮性增高[15]。CB1R阻斷劑阻止熱性驚厥導致的后期邊緣系統(tǒng)興奮性增強[12]。大麻二酚可有效調(diào)節(jié)癲癇持續(xù)狀態(tài)(SE)誘發(fā)的癲癇[16]。內(nèi)源性大麻素系統(tǒng)激活不能阻止SE后癲癇發(fā)生[17]。這些關于癲癇發(fā)生的研究結果本身存在矛盾,并且與CB1R激動劑阻斷癲癇急性發(fā)作不全一致,提示CB1R調(diào)控的復雜性,以及其在控制癲癇急性發(fā)作和阻斷癲癇發(fā)生中,所發(fā)揮的作用不同。探討CB1R在癲癇發(fā)生中分布的變化,為其所產(chǎn)生功能改變奠定形態(tài)學基礎。
在海馬內(nèi)部存在一個由內(nèi)嗅區(qū)-齒狀回-CA3區(qū)-CA1區(qū)-下托皮質(zhì)-內(nèi)嗅區(qū)的單向神經(jīng)傳遞環(huán)路。研究顯示SE后海馬CB1R表達增加,但是尚未見關于海馬單向神經(jīng)傳遞環(huán)路CB1R動態(tài)變化的定量分析。海馬神經(jīng)元突觸密集,尤其CA1區(qū),多種突觸傳遞最終經(jīng)CA1區(qū)傳出海馬,其突觸的可塑性,因此具有致癇性[18]。放射層內(nèi)錐體細胞的頂樹突有規(guī)則的伸展以及與其連接的軸突相互交織,包含來自CA3區(qū)的Schaffer側支。齒狀回分子層含有從內(nèi)嗅區(qū)來的海馬傳入纖維,從鄰近神經(jīng)元發(fā)來的軸突,以及顆粒細胞的樹突。苔蘚纖維是齒狀回顆粒細胞軸突,主要在CA3區(qū)錐體細胞頂樹突起始段之間穿行,與之形成大量的突觸,形成了CA3區(qū)特有的透明層。因此,我們選取CA1區(qū)放射層、CA3區(qū)透明層,以及分子層等突觸傳遞密集的區(qū)域作為觀察對象,定量分析其CB1R的動態(tài)變化,探討SE后海馬CB1R改變在癲癇發(fā)生中的作用。我們發(fā)現(xiàn)本研究中所建立的癲癇模型,SE后4 w,出現(xiàn)明顯的海馬硬化特征,表現(xiàn)為神經(jīng)元的大量丟失和星形膠質(zhì)細胞增生。在海馬硬化形成過程中,我們對海馬各區(qū)進行CB1R表達進行定量分析,發(fā)現(xiàn)在CA1區(qū)放射層,SE后各時間點CB1R表達均高于對照,CB1R表達在SE后4W明顯增高,高于SE后1 w、2 w、3 w,在CA3區(qū)透明層,SE后各時間點CB1R表達均高于對照,CB1R表達在SE后4 w,高于SE后1 w,在海馬分子層,SE后各時間點CB1R表達均高于對照,但是CB1R表達在SE后1 w、2 w、3 w、4 w之間無統(tǒng)計學差異。這些結果提示,在SE后海馬內(nèi)部單向信息傳遞環(huán)路中,CB1R均出現(xiàn)不同程度增加,但是以齒狀回分子層CB1R表達增加最早,且以后數(shù)周變化不大,CA3區(qū)透明層在SE后,CB1R表達增加,隨后增加緩慢,在SE后4 w達到高峰,而CA1區(qū)放射層,在SE后CB1R表達增加,此后2~3 w變化不大,在SE后4 w CB1R明顯增加。說明從齒狀回-CA3區(qū)-CA1區(qū)的信息傳遞環(huán)路中,在SE后CB1R增加,但是會出現(xiàn)增加延遲,齒狀回分子層變化最早,CA1區(qū)放射層變化最晚。有學者在顳葉癲癇患者硬化海馬中,發(fā)現(xiàn)神經(jīng)元胞體周圍出現(xiàn)表達CB1R的GABA能抑制性神經(jīng)元出芽,認為這種增強的抑制信號可能會增加錐體細胞同步性,有助于癲癇發(fā)生和間期放電[19]。在本研究中,我們發(fā)現(xiàn)放射層和錐體細胞交界區(qū),CB1R陽性表達明顯增強,無論是對照還是SE后各時間點,提示CB1R陽性突觸大量位于錐體細胞胞體周圍。海馬大麻素敏感細胞信號是導致網(wǎng)絡振蕩可能原因,與癲癇發(fā)生密切相關[20]。SE后傳導環(huán)路CB1R在時間上增加的并不同步,對癲癇的發(fā)生有何影響尚不清楚,但是這種非同步性變化,與生理狀態(tài)下CB1R分布不同,提示其在癲癇形成過程中,海馬CB1R對神經(jīng)傳遞的調(diào)節(jié)平衡發(fā)生改變,這種變化對于癲癇發(fā)生的意義值得進一步探討。

