急性缺血性卒中患者動態血糖參數與臨床預后的相關性
吳 瀅, 劉學源, 李土明, 鐘 萍
急性缺血性卒中(acute ischemic stroke,AIS)患者中約有高達三分之一伴有高血糖癥[1]。高血糖癥可能導致腦組織損傷加重的原因包括增加乳酸酸中毒、導致細胞毒性水腫加重、降低腦血管舒縮反應性、破壞血腦屏障等[2]。已有多項研究結果表明,高血糖是較大梗死面積、不良臨床結局和較高死亡風險的獨立預測因子[3,4],與靜脈溶栓、機械取栓等再通治療后發生癥狀腦出血、死亡等其他不良臨床事件相關[5]。因此,血糖與卒中后轉歸的關系和機制仍需進一步研究。本研究對AIS患者進行72 h動態血糖監測并隨訪臨床預后,分析系列性血糖指標與不同臨床終點事件指標之間的相關性,以期為臨床治療提供更多的依據。
1 對象與方法
1.1 研究對象 選擇2018年2月至2019年10月在上海市中西醫結合醫院神經內科住院的AIS患者。納入標準:(1)符合中華醫學會神經病學分會制定的《2018中國急性缺血性腦卒中診治指南》診斷要點,并經頭部CT/MRI確診;(2)年齡≥45歲;(3)發病在14 d內;(4)住院時間>3 d;(5)具備動態血糖監測結果。排除標準:(1)合并l型糖尿病或糖尿病酮癥酸中毒;(2)患有慢性感染性疾病及近期急性感染;(3)伴有嚴重肝、腎功能損害。所有患者均接受卒中常規治療,血糖控制目標為7.8 mmol/L~10.0 mmol/L。本研究經上海市中西醫結合醫院倫理委員會批準(2019-097-1),所有患者均簽署知情同意書。
1.2 研究方法 所有患者在入院后開始安裝美奇動態血糖檢測儀,該系統每5 min記錄1次平均血糖值,每天可監測288次,監測范圍在1.7 mmol/L~24 mmol/L,每天輸入三餐前及睡前血糖進行血糖值校正,患者連續佩戴72 h后拆卸,最終獲得72 h的血糖圖譜。所有血糖參數指標通過動態血糖檢測儀獲得,包括測量期間的:(1)血糖最大值;(2)血糖最小值;(3)血糖平均值;(4)高血糖(血糖>11.1 mmol/L)時間比;(5)高血糖(血糖>7.8 mmol/L)時間比;(6)低血糖(血糖<3.9 mmol/L)時間比;(7)血糖波動系數;(8)空腹血糖平均值;(9)早餐后血糖平均值;(10)午餐后血糖平均值;(11)晚餐后血糖平均值。
1.3 臨床資料收集 記錄患者的基線特征,包括人口統計學資料(年齡、性別)、既往病史(高血壓、糖尿病、高脂血癥、冠心病、既往卒中、吸煙和飲酒史、降糖藥物使用史)等。其中高血壓定義為血壓≥140/90 mmHg;使用抗高血壓藥或以前診斷為高血壓。糖尿病定義為空腹血糖≥7.0 mmol/或隨機血糖≥11.1 mmol/L;口服糖耐量試驗2 h血糖≥11.1 mmol/L;服用抗糖尿病藥物;或糖尿病的先前診斷。高脂血癥定義為血清總甘油三酯≥1.7 mmol/L,血清總膽固醇≥5.18 mmol/L,血清低密脂膽固醇≥3.37 mmol/L,降血脂藥物使用史或以前的血脂異常診斷。既往卒中史包括缺血性卒中和出血性卒中。吸煙史定義為每天吸煙1支以上,連續或累計6 m。飲酒史定義為男性平均每周飲用白酒超過500 g,女性為350 g,連續5 y以上。降糖藥物使用包括胰島素和口服降糖藥物。
1.4 血生化指標 所有患者在入院2 d空腹12 h采肘靜脈血,進行常規血生化檢查包括,總膽紅素、直接膽紅素、甘油三酯、總膽固醇、低密度脂蛋白膽固醇、高密度脂蛋白膽固醇、糖化血紅蛋白、糖化白蛋白、同型半胱氨酸、纖維蛋白原、肌酐、尿素氮、尿酸。
1.5 隨訪 每3 m進行一次隨訪,隨訪至卒中后6 m。結局指標:(1)卒中復發。卒中復發的診斷參照Sacco標準[6]:①患者在原神經系統缺損癥狀和體征好轉或消失的基礎上,再次出現同側或對側新的神經系統缺損癥狀和體征;②復發卒中也包括隨訪中因卒中復發導致死亡的患者;③頭部CT或MRI檢查發現新的病灶(同側或對側)。(2)卒中事件發生6 m后的功能恢復情況,采用改良Rankin量表(modified Rankin Scale,mRS)評價功能轉歸,0~2分定義為轉歸良好,>2分定義為轉歸不良。(3)全因死亡情況。
2 結 果
2.1 人口統計學和基線資料 研究期間共納入AIS患者96例,其中8例因血糖資料不完整、失訪而排除,最終88例納入分析。其中男性50例,女性38例,平均年齡(68.4±12.0)歲。轉歸不良組16例(18.18%),轉歸良好組72例(81.82%),兩組之間在年齡、既往卒中史、總膽紅素之間有顯著差異(P<0.05)。再發卒中組13例(14.77%),非再發卒中組75例(85.23%),兩組間在既往卒中史、糖化血紅蛋白、糖化白蛋白之間有明顯差異(P<0.05)。其他人口統計學和基線臨床資料差異均無統計學意義。(見表1)
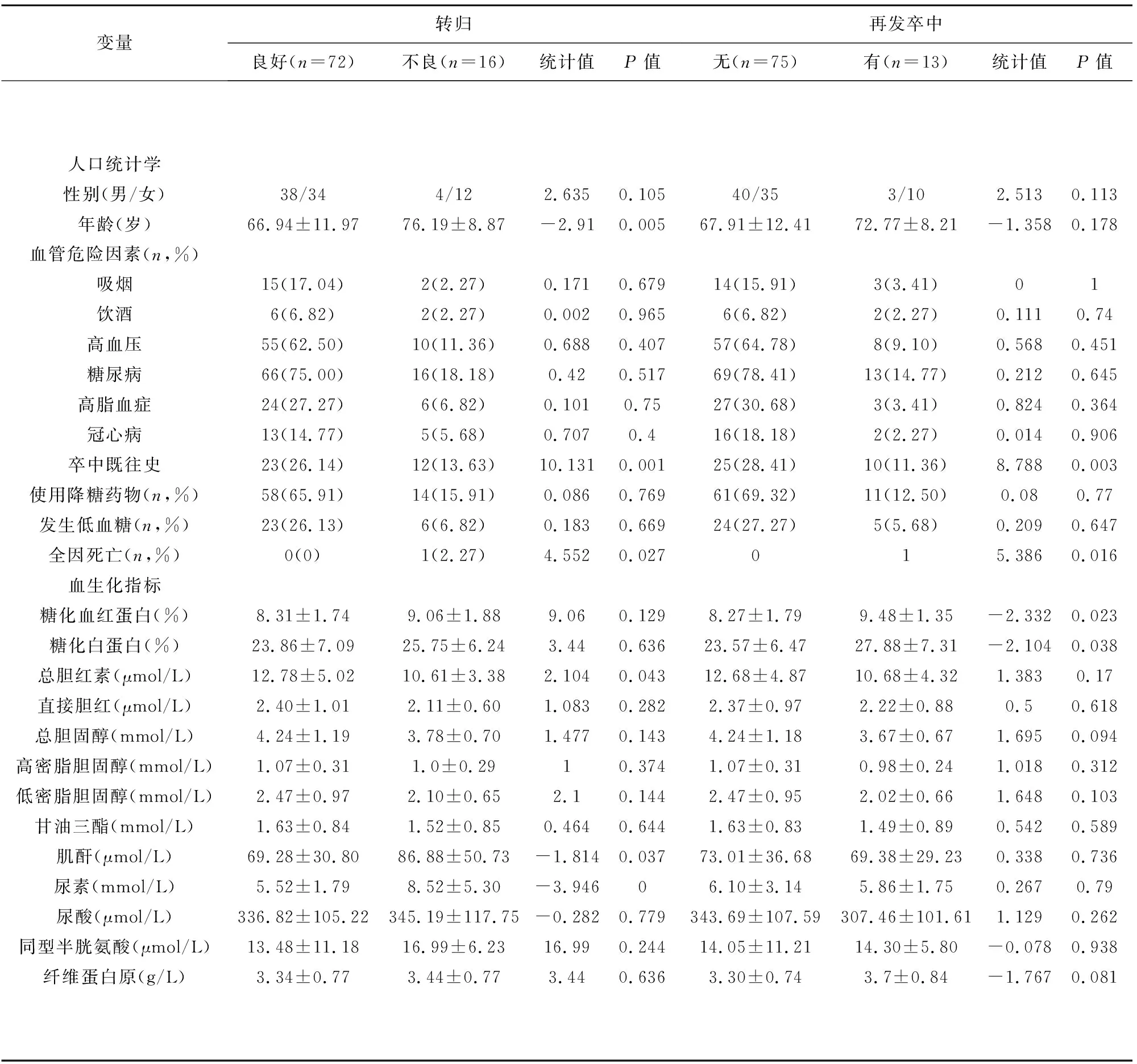
表1 研究對象的人口統計學和臨床資料
2.2 AIS患者動態血糖參數與不良預后的單變量分析 轉歸良好組和不良轉歸組在血糖最大值、低血糖時間比、血糖波動系數、午餐后血糖平均值之間有顯著差異(P<0.05),其他血糖參數之間無統計學差異。再發卒中組和非再發卒中組動態血糖各項參數之間無統計學差異(見表2)。
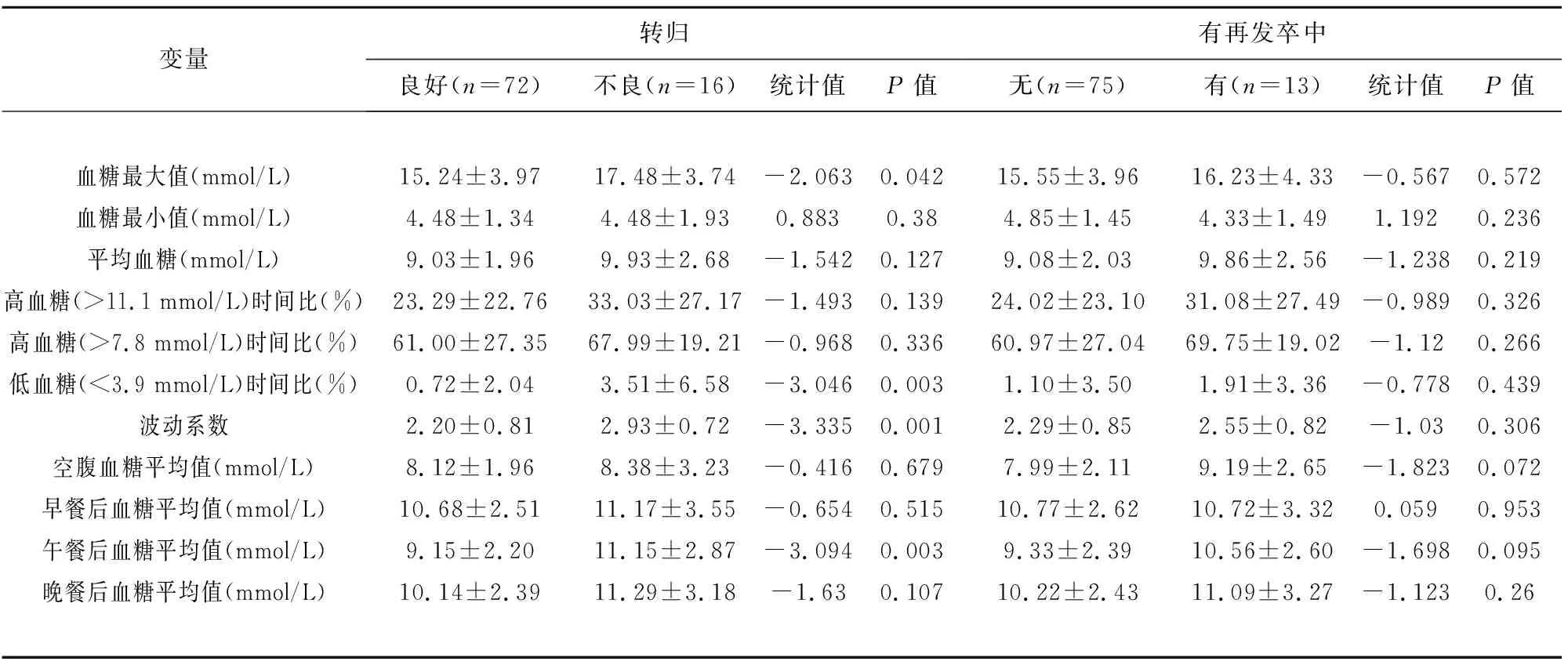
表2 研究對象的動態血糖參數與臨床轉歸、再發卒中的相關性
2.3 預后不良和再發卒中獨立危險因素的多變量Logistic回歸分析 對單變量分析中具有統計學意義的因素進行多變量Logistic回歸分析顯示,預后不良的的獨立影響因素包括既往卒中史(OR7.36,95%CI1.69~32.06;P<0.05)和低血糖時間比(OR1.6,95%CI1.01~2.55,P<0.05);再發卒中的獨立危險因素包括既往卒中史(OR7.36,95%CI1.69~32.06,P<0.05)(見表3)。
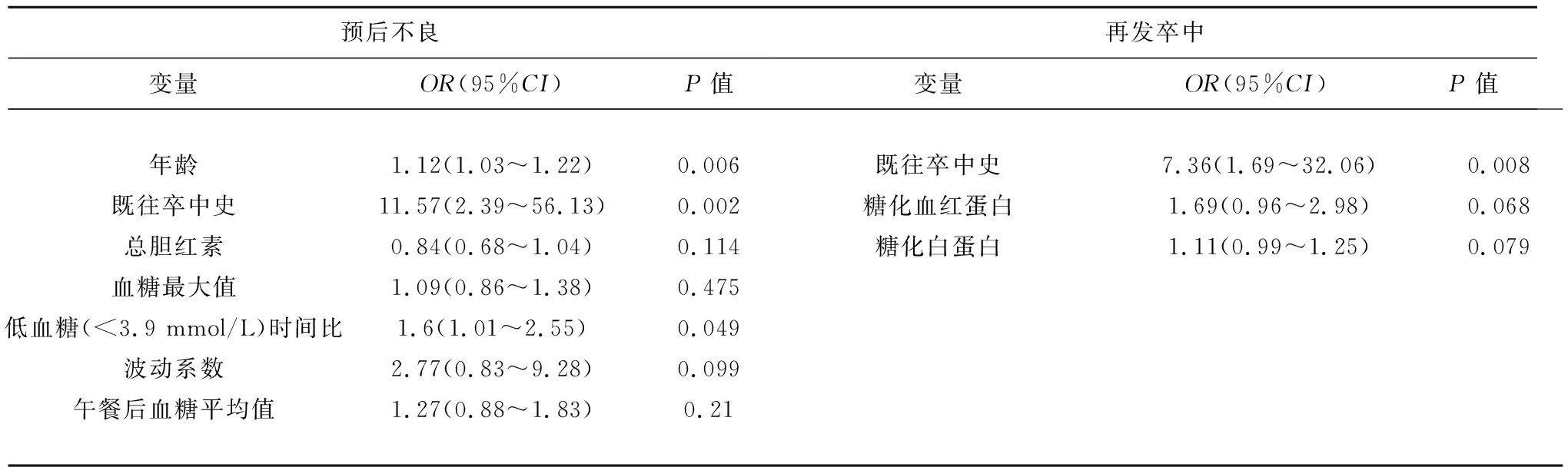
表3 預后不良和再發卒中獨立危險因素的多變量Logistic回歸分析結果
3 討 論
AIS患者的高血糖是較大梗死面積、不良預后和高死亡率風險的獨立預測因素[7]。過去對患者血糖的監測多通過單次的血糖測量,對詳細的動態血糖狀態是未知的。利用動態血糖監測儀記錄急性缺血性卒中患者的血糖參數有利于連續記錄血糖的動態變化并發現無癥狀性低血糖。近年來有學者提出,利用血糖變異性即血糖的波動范圍,來反應血糖的異常。Chiu等[8]納入28354例臺灣華裔糖尿病患者隨訪7.5 y的研究發現,血糖變異性是2型糖尿病患者發生缺血性卒中的預測因子。有糖尿病的AIS患者血糖變異性與較差的功能預后相關[9]。國內邸衛英等[10]回顧性分析了急性缺血性卒中患者3 m內病死率情況,發現血糖波動范圍大提示轉歸不良,且平均血糖變異性比平均血糖水平能更好地預測患者 3 m內病死率。
在本研究中,對AIS患者的基線資料及動態血糖參數的單因素分析顯示,預后不良組在年齡、既往卒中史、總膽紅素、血糖最大值、低血糖時間比、波動系數及午餐后血糖平均值之間有顯著高于預后良好組;再發卒中組在既往卒中史、糖化血紅蛋白、糖化白蛋白顯著高于非再發卒中組。而平均血糖水平在預后情況及再發卒中的比較中均無統計學差異。進一步的多變量Logistic回歸分析結果顯示,既往卒中史是預后不良和再發卒中的獨立危險因素。年齡和低血糖時間比是預后不良的獨立危險因素。結果顯示,血糖波動系數與卒中患者的不良結局相關,血糖波動范圍大提示轉歸不良血糖波動系數比平均血糖水平能更好地預測患者轉歸。這也與既往的研究結果相符。
AIS患者由于體內糖代謝情況紊亂,極易出現低血糖的情況。在本研究中,預后不良組有6例(31.25%)發生低血糖,再發卒中組有5例(38.46%)發生低血糖其中3例出現出冷汗、心慌、胸悶的低血糖癥狀,其他人低血糖多發生在21點~0點、3~6點,未發現明顯的癥狀性低血糖表現,說明動態血糖檢測儀能夠發現無癥狀的低血糖。不良預后組和再發卒中組在低血糖發生數的之間無統計學差異,而不良預后組低血糖時間比之間有統計學差異,進一步的多變量Logistic回歸分析低血糖時間比是預后不良的獨立危險因素。
近年來,大量的臨床試驗證實了對AIS患者進行強化降糖后未獲得功能結局或生存的任何顯著的益處。同時,嚴格的血糖控制導致低血糖的風險增加。最新的SHINE研究是一項多中心隨機雙盲的研究,其顯示,強化降糖方案不改善患者90 d功能預后,且增加嚴重低血糖發作風險[11]。因此,在對AIS患者急性血糖控制時,高血糖、低血糖和血糖波動性都是需要考慮的重要因素,我們的研究結果也與此相符。
有關AIS后高血糖的對腦組織的損傷機制包括以下幾個方面:(1)腦組織在缺血損傷后由于高糖分解導致氧化代謝的減少和厭氧糖酵解的相對增加,加重腦組織酸中毒[3]。(2)在腦組織缺血損傷的急性期,活化的小膠質細胞、星形膠質細胞和巨噬細胞會釋放促炎因子,加劇受損腦組織的損傷和壞死[12]。(3)增加細胞因子及蛋白酶活性,加重缺血/再灌注損傷后血腦屏障功能障礙,使腦梗死出血轉化風險增加[13]。(4)體內氧化應激水平增加,導致線粒體功能障礙,加重興奮性氨基酸毒性,促進神經元脂質、蛋白質和DNA過氧化損傷和促進炎癥反應[14]。(5)降低內皮祖細胞分化、增殖、粘附功能,集落單位數量形成減少,從而導致內皮修復和新血管形成不良[15]。
本研究的不足之處是數據來源于單中心急性缺血性卒中動態血壓監測資料庫,有一部分患者是頭部MRI發現的無癥狀的急性腦梗死患者,可能存在患者的選擇偏倚。其次,樣本量較小,仍需要大樣本、前瞻性的深入研究和干預研究及進一步的機制探討。此外,選擇的卒中患者病因存在大動脈粥樣硬化性、心源性及小動脈閉塞型等病因,故尚需要進一步對不同卒中類型進行分類探討。

