神經節細胞膠質瘤相關癲癇的外科治療
韓彥明 沈云娟 史 哲 劉亞麗 楊寶慧 王天成 張新定
神經節細胞膠質瘤(ganglioglioma,GG)相關癲癇占腫瘤相關癲癇的40%,多為藥物難治性癲癇(intractable epilepsy,IE)[1,2],為了有效治療,不僅要切除腫瘤,還要控制癲癇發作。如何確定致癇灶是癲癇手術的關鍵。GG為發育性腫瘤,周邊往往伴有皮質發育不良,明確GG和腫瘤邊緣皮質發育不良是制定手術方案的關鍵。目前,GG相關癲癇手術治療方案,爭議較多,尚未有統一的標準。2015年1月至2018年12月手術治療GG相關癲癇21例,取得良好的效果,現報道如下。
1 資料與方法
1.1 研究對象 納入標準:①GG診斷明確[3],影像學特征明顯且腫瘤位于幕上;②符合IE診斷;③具有手術指征。排除標準:①存在GG以外的遠隔致癇區或可能的致癇性病變;②合并顱內感染等神經系統疾病;③合并心功能不全或肝腎功能明顯異常等手術禁忌。
2015年1月至2018年12月前瞻性收集GG相關IE共21例,其中男8例,女13例;復雜部分性發作15例,復雜部分性發作繼發全面強直陣攣發作6例;癲癇起病年齡1~35歲,平均(10.5 ±8.0 )歲;癲癇病程4~34年,中位數為9年;腫瘤位于顳葉6例、枕葉4例、額葉5例、島葉1例、顳枕交界區2例、頂葉3例。
1.2 術前多模態癲癇綜合評估
1.2.1 Ⅰ期術前評估 包括詳細的病史采集、神經系統體格檢查,以及長程視頻腦電圖監測、頭顱MRI、神經心理學評估。經多學科討論后,若腫瘤為致癇灶,且位于非功能區,則在術中皮層腦電圖(electrocorticography,ECoG)監測下行腫瘤切除術;如果存在腫瘤以外的致癇灶,且位于重要功能區,則行立體定向顱內深部電極植入術。
1.2.2 Ⅱ期術前評估①顱內深部電極植入術:設計電極植入路徑,在LECKLELL頭架導航系統下精確植入后行CT掃描,并與術前MRI融合,以確定電極位置及每個觸點位置。②行長程視頻立體定向腦電圖(stereotactic electroencephalogram,SEEG)監測,記錄發作間期及發作期腦電信號并記錄到至少2次慣常發作。③多學科討論分析SEEG結果并提出手術切除方案。
1.3 腫瘤與致癇灶關系的判定 根據術中ECoG監測,將腫瘤與致癇灶的關系分為3種:①腫瘤為致癇灶,術中行ECoG監測,癲癇樣放電位于腫瘤及其邊緣1 cm內且腫瘤中心放電明顯;②腫瘤及腫瘤邊緣組織共為致癇灶,術中行ECoG監測,癲癇樣放電累及腫瘤及其邊緣1 cm以外且腫瘤內外放電強度無明顯差異;③腫瘤邊緣組織為致癇灶,術中行ECoG監測,腫瘤組織無癲癇樣放電,腫瘤邊緣1 cm以外腦組織可監測到癲癇樣放電。SEEG顯示腦電發作起始區最先累計部位為致癇灶,依據放電電極累及位置明確腫瘤與致癇灶的關系。
1.4 手術方式 未行SEEG的病人,根據術前影像學檢查資料定位并結合術中導航及術中超聲可以更好地判斷腫瘤邊界,且術中行ECoG監測可進一步明確腫瘤與致癇灶的關系,并在顯微鏡下結合術中腫瘤與正常腦組織顏色、質地的差異加強邊界判定,行腫瘤及致癇灶裁剪式切除。行SEEG的病人,因術前已明確腫瘤和致癇灶的關系,術中直接行腫瘤及致癇灶的裁剪式切除。
2 結果
2.1 術前多模態評估結果
2.1.1 Ⅰ期術前評估21例中,15例發作癥狀學、頭皮腦電圖與腫瘤位置相符合,致癇灶可定側定位,即腫瘤相關,在術中ECoG監測下行腫瘤并致癇灶切除術;其余6例中,2例致癇灶可能累及功能區(1例語言區,1例運動區),其余4例精準定位困難,行顱內深部電極植入術。
2.1.2 Ⅱ期術前評估6例完善SEEG評估,發作期腦電圖均能定位致癇灶,其中2例致癇灶累及功能區,行大腦皮層功能電刺激結果顯示1例與語言區無關,1例累及運動區。
2.2 腫瘤與致癇灶關系21例中,腫瘤等同于癲癇灶14例,腫瘤及邊緣組織共為致癇灶5例,腫瘤周邊組織為致癇灶2例。15例ECoG監測中,11例腫瘤即為致癇灶,3例腫瘤和腫瘤邊緣組織共為致癇灶,1例腫瘤邊緣2.6 cm范圍為致癇灶,即腫瘤邊緣組織為致癇灶;6例SEEG中,2例腫瘤和腫瘤邊緣組織共為致癇灶,1例腫瘤外邊緣范圍為致癇灶,3例腫瘤即為致癇灶。
2.3 術后癲癇控制結果21例術后病理均為GG,合并局灶性皮質發育不良(focal cortical dysplasia,FCD)Ⅲb型7例(6例位于腫瘤邊緣,1例位于腫瘤后緣2.6 cm處)。術后隨訪6~42個月,中位數為24個月,Engel分級Ⅰ級20例,Ⅱ級1例(因致癇灶累及運動區行部分切除)。2例典型病例SEEG植入術后影像及腦電分別見圖1、2。
3 討論
術前多模態癲癇綜合評估對癲癇病人的診治至關重要。本文21例均為GG相關癲癇,其中6例SEEG植入術后才診斷明確。林久攣等[4]認為術中ECoG監測不僅能明確致癇灶范圍,而且可以輔助界定腫瘤范圍。本文病例術中ECoG監測發現大多數癲癇樣放電最明顯部位往往是腫瘤所在部位,且在腫瘤周緣1 cm范圍內,因此,我們提出“依據術中ECoG定位腫瘤與致癇灶關系的標準”。依據此標準,本文15例術中ECoG監測腫瘤與致癇灶關系為:11例腫瘤即為致癇灶;3例腫瘤和腫瘤邊緣組織共為致癇灶;1例腫瘤后緣2.6 cm范圍為致癇灶,即腫瘤邊緣組織為致癇灶。另外,本文6例SEEG監測顯示,3例腫瘤即為致癇灶,2例腫瘤和邊緣組織共為致癇灶(圖2),1例腫瘤邊緣組織為致癇灶(圖1)。由此可以看出,GG相關癲癇中,大多數腫瘤本身致癇性很高,但也有例外,本文2例腫瘤不是致癇灶。此外,GG周緣往往伴有FCD,報道顯示高達76%[5],FCD具有高致癇性[6],但GG相關癲癇病人FCD是否參與致癇灶構成,目前尚未清楚。本文21例中,7例病理檢查顯示伴有FCD,均參與致癇灶的構成。Devaux等[7]評估150例GG手術療效,其中48例行SEEG檢查,結果顯示部分病人即使行腫瘤全切除,癲癇控制效果也不理想。Bonney等[8]回顧性分析GG相關癲癇手術的文獻,發現大多數癲癇控制效果良好均與腫瘤的擴大切除有關。這說明GG相關癲癇病人的腫瘤并不完全等同于致癇灶。
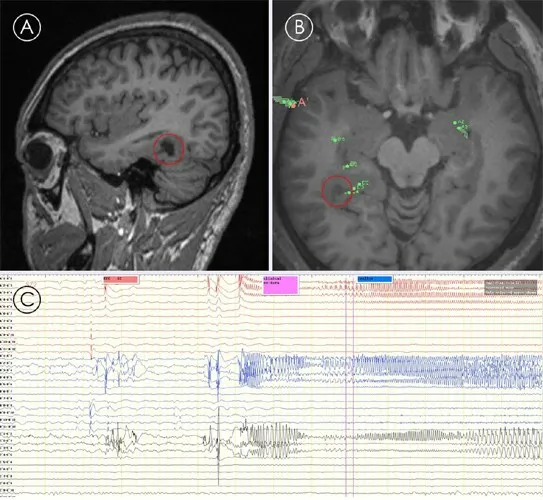
圖1 顳后枕葉神經節細胞膠質瘤合并癲癇病史11年影像
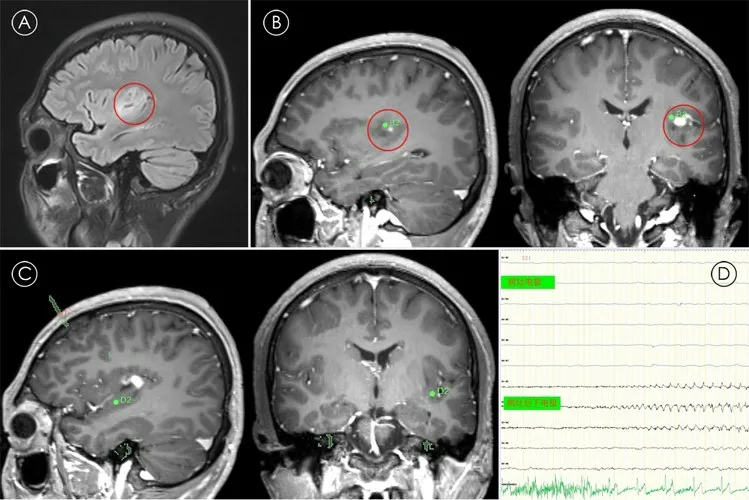
圖2 島葉神經節細胞膠質瘤合并癲癇病史10年影像
文獻報道的GG術后癲癇緩解率差別很大,Engel分級Ⅰ級比例在63%~100%[8],平均80%[9],術后仍有20%左右病人癲癇發作。本文隨訪結果顯示,21例中,20例達到Engel分級Ⅰ級,其中停藥無發作14例;僅1例因致癇灶累及運動區行部分切除,為Engel分級Ⅱ級。本文病例良好的療效得益于:①標準的、規范化的術前癲癇綜合評估,明確癲癇與腫瘤的關系,并非所有腫瘤都引起癲癇,切除與癲癇無關的腫瘤并不能改善癲癇發作;②術中ECoG監測的應用,不僅能明確致癇灶范圍,而且可以輔助界定腫瘤范圍;③SEEG的應用,可輔助定位致癇區,并分析致癇區與功能區及致癇灶的關系,評價手術治療的可行性,是新型癲癇外科術前精準評估的關鍵技術[10~12]。但也有學者報道術中未行ECoG監測,術后癲癇緩解率可達83.3 %[13],但納入的病例未區分難治性與非難治性癲癇,結果不可靠。
綜上所述,GG相關癲癇病人的腫瘤本身并不等同致癇灶,臨床需要從癲癇的角度,對腫瘤并發難治性癲癇病人行術前癲癇多模態的綜合評估,運用ECoG或SEEG明確腫瘤與致癇灶的關系,行精準個體化的切除術,既能避免遺漏致癇灶,又能防止盲目的切除無致癇性的腦組織,從而提高癲癇的手術療效。

