下調脂滴包被蛋白2抑制人胃癌細胞系NCI-N87增殖
劉煉玲,李 勇
(1.重慶市萬州區人民醫院 消化內科,重慶 404000; 2.重慶大學附屬三峽醫院 消化內科,重慶 404000)
胃癌(gastric cancer)是一種常見的消化道惡性腫瘤,發生于胃黏膜上皮,其發病率約占全球惡性腫瘤的7%,其病死率約占全球惡性腫瘤的9%[1]。手術切除聯合輔助化療是目前治療胃癌的主要手段,然而對于出現侵襲、轉移的病人其治療效果不佳[2]。脂滴包被蛋白2(perilipin2)是一種能夠調控脂質代謝的蛋白,保護脂肪組織,促進脂滴中三酰甘油(triglyceride,TG)的存儲,為細胞增殖提供能量,并在膀胱癌、腎透明細胞癌、結腸癌等惡性腫瘤發病過程中有非常重要的作用[3]。但是,目前國內關于perilipin2與胃癌關系的報道較少,為此,本研究分析了perilipin2在胃癌中的表達及對腫瘤生物學行為的調控機制,希望從胃癌發病的分子機制方面探尋更為有效的診療方法應用于臨床,現報告如下。
1 材料與方法
1.1 材料
1.1.1 細胞來源:人正常胃黏膜細胞系GES-1(杭州美森細胞生物科技有限公司);人胃癌細胞系NCI-N87(上海中喬新舟生物科技有限公司)。
1.1.2 主要試劑: BCA蛋白定量試劑盒(Pierce公司);兔抗perilipin2、p62、keap1、Nrf2單克隆抗體(1∶500稀釋,北京博爾西科技有限公司);HRP標記山羊抗兔IgG二抗(1∶2 000稀釋,Sigma-Aldrich公司);ECL發光試劑盒(上海翊圣生物科技有限公司);NC-shRNA、perilipin2-shRNA重組慢病毒質粒(Axygen公司);CCK-8溶液(北京華泰昕生物醫療技術有限公司)。
1.2 方法
1.2.1 細胞的分組及干預:將NCI-N87細胞分為對照組,轉染10 μg NC-shRNA重組慢病毒質粒和轉染10 μg perilipin2-shRNA重組慢病毒質粒,完成上述操作后繼續培養48 h,轉染操作按照LipofectamineTM2000轉染說明書進行。
1.2.2 CCK8法檢測細胞增殖率:將細胞接種于96孔細胞培養板中,每孔加入100 μL細胞懸液(濃度1×105個/mL),分別培養6、12、24、36 和48 h,每孔加入10 μL CCK-8溶液,培養2 h,用酶標儀測定450 nm吸光度(A)值。
1.2.3 Transwell小室法檢測細胞侵襲能力:將細胞制成細胞懸液,在Transwell小室的上室鋪入基質膠(每孔60 μL),37 ℃成膠,加入細胞懸液(濃度1×105個/mL),每孔200 μL,在Transwell小室的下室中加入600 μL DMEM培養液,培養24 h,棄上室液體、固定、風干、0.1%結晶紫染色,PBS漂洗,在顯微鏡下計數穿過小室膜的平均細胞數。
1.2.4 劃痕實驗檢測細胞遷移能力:將細胞制成細胞懸液接種于48孔板中,等到80%細胞貼壁后,用槍頭沿著與皿底垂直方向劃痕,PBS漂洗,加入無血清培養基,37 ℃培養24 h,觀察細胞遷移軌跡,拍照記錄,測量劃痕間距。
1.2.5 Western blot檢測perilipin2、p62、Kelch樣ECH相關蛋白1(kelch-like ECH-associated protein 1,keap1)、核轉錄因子E2相關因子2(nuclear factor E2-related factor-2,Nrf2)蛋白表達:取對數增殖期的GES-1細胞和NCI-N87細胞,勻漿、裂解、離心、取上清,測定蛋白濃度,取總蛋白上樣于10% SDS-PAGE膠,依次電泳、切膠、轉膜、封閉、洗膜、加一抗、孵育、洗膜、加二抗、孵育、洗膜、顯色、定影,分析perilipin2、p62、keap1、Nrf2蛋白表達量。
1.3 統計學分析
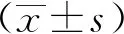
2 結果
2.1 NCI-N87細胞中的perilipin2蛋白表達
NCI-N87細胞中的perilipin2蛋白表達量顯著高于GES-1細胞(P<0.05)perilipin2在胃癌中呈高表達 (圖1)。

*P<0.05 compared with GES-1 cells
2.2 下調perilipin2表達能夠抑制胃癌細胞增殖
6、12、24、36和48 h時,perilipin2-shRNA組NCI-N87細胞增殖率較對照組、NC-shRNA組低(P<0.05)(圖2)。

*P<0.05 compared with control group; #P<0.05 compared with NC-shRNA group
2.3 下調perilipin2表達能夠抑制胃癌細胞侵襲
Perilipin2-shRNA組穿過小室膜的NCI-N87細胞數較對照、NC-shRNA組低(P<0.05)(表1,圖3)。
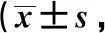
表1 各組NCI-N87細胞的侵襲和遷移能力

圖3 各組NCI-N87細胞的侵襲能力
2.4 下調perilipin2表達能夠抑制胃癌細胞遷移
Perilipin2-shRNA組劃痕間距較對照組、NC-shRNA組寬(P<0.05)(圖4)。

圖4 各組NCI-N87細胞的遷移能力
2.5 下調perilipin2表達能夠抑制p62-keap1-Nrf2通路相關蛋白表達
Perilipin2-shRNA組NCI-N87細胞中的perilipin2、p62、keap1、Nrf2蛋白表達量較對照組、NC-shRNA組低(P<0.05)(圖5)。

*P<0.05 compared with control group; #P<0.05 compared with NC-shRNA group
3 討論
Perilipin2是perilipin家族中的重要成員,存在于多種組織和細胞中,如脂肪、乳腺、胰腺、肝臟、小腸黏膜、肌肉等,能夠參與脂滴的代謝,在脂滴流出與貯存的平衡中發揮重要作用,并與心血管疾病、腫瘤等疾病有關。研究發現[4],perilipin2在病理狀態如缺氧、代謝損傷等造成的細胞環境異常變化的情況下的表達水平是上調的。文獻報道[5],低氧誘導因子2α(hypoxia inducible factor 2 α,HIF2α)可使perilipin2表達增加,加速脂肪堆積,促進腎透明細胞癌腫瘤生長。資料顯示[6],perilipin2在尿路上皮細胞癌患者中表達上調,且病理分期Ⅲ~Ⅳ患者perilipin2表達水平遠高于病理分期Ⅰ~Ⅱ期患者。研究發現[7],perilipin2與膀胱癌發病及進展有關,其能促進膀胱癌細胞增殖和轉移。
本研究結果提示perilipin2在胃癌中呈高表達,perilipin2可能參與了胃癌的發生。這其中可能的解釋為,高脂含量,即perilipin2過度表達,會造成細胞相對缺氧,抑制鐵死亡,從而促進胃癌腫瘤形成[8]。本研究通過perilipin2-shRNA重組慢病毒質粒轉染構建perilipin2下調的NCI-N87細胞系,Western blot結果表明轉染后的NCI-N87細胞中perilipin2蛋白表達量明顯降低,同時,NCI-N87細胞中perilipin2下調后其增殖、侵襲、遷移能力明顯下降。p62-keap1-Nrf2通路是一條與腫瘤細胞生物學行為關系密切的通路,p62-keap1-Nrf2在正常細胞中發揮保護作用,但在異常狀態下可誘導腫瘤發生。自噬缺陷時,過表達的p62可通過與Nrf2競爭性結合Keapl,促使Nrf2穩定活化[9]。已有研究報道[10],p62-keap1-Nrf2通路失調可見于胰腺癌、宮頸癌、膀胱癌、食管鱗癌等,該通路在上述腫瘤發生及進展過程中具有重要的作用,且Nrf2作為一個轉錄因子可以調控多種細胞保護基因的表達,而這些基因的表達對于胃癌的發生及發展也具有重要作用。本研究結果顯示NCI-N87細胞中perilipin2下調后其p62-keap1-Nrf2通路處于受阻狀態,提示perilipin2下調促進了p62表達的降低,從而減弱了其與Nrf2競爭性結合Keap1的作用,導致Nrf2被泛素化后進入蛋白酶體途徑降解,減少了Nrf2啟動的下游基因的轉錄,最終導致細胞增殖及遷移能力減弱。Perilipin2在胃癌臨床診斷和治療監測中有一定的應用潛力,有望成為抗胃癌的潛在靶標。
綜上所述,perilipin2在胃癌中呈高表達,下調perilipin2表達能夠抑制胃癌細胞增殖、侵襲及遷移,其機制可能與p62-keap1-Nrf2通路受阻有關,但其調控機制是否還有其他,有待研究。

