四倍體滋養層干細胞的分離培養與鑒定
王海豫,肖 翼,黃 粵
(中國醫學科學院基礎醫學研究所 北京協和醫學院基礎學院 醫學遺傳學系 醫學分子生物學國家重點實驗室,北京 100005)
干細胞(stem cells,SCs)是一類具有自我更新和分化能力的細胞,是早期胚胎研究中重要的體外模型。從小鼠囊胚的內細胞團、滋養外胚層和原始內胚層可得到胚胎干細胞(embryonic stem cells,ESCs)系[1]、滋養層干細胞(trophoblast stem cells, TSCs)系[2]和胚外內胚層(extraembryonic endoderm,XEN)細胞系[3]。滋養外胚層參與到胎盤形成,圍繞在內細胞團上部的滋養層干細胞發育成滋養外胚層和外胎盤錐,其余的則發育成滋養層巨細胞[4]。
多倍體細胞常見于植物中,但在哺乳動物的部分組織器官中也存在少量多倍體細胞。在人體內,不同的組織中出現多倍體細胞的概率是0.5%~2%[5],如骨髓的巨核細胞、胎盤中的滋養層細胞等[6]。在四倍體補償實驗(tetraploid complementation assay)中,將二倍體ESCs注射到四倍體囊胚中,經發育可以最終得到完全由二倍體ESCs發育而來的個體[7],四倍體胚胎發育成的胎盤等胚外組織,支持胎兒的發育。但四倍體細胞發育的胎盤與正常的二倍體細胞發育的胎盤有什么差異,目前尚不清楚。此外,四倍體ESCs系已經成功建立,與二倍體ESCs僅能嵌合到胎兒組織的發育潛能不同,四倍體ESCs可以嵌合到胚胎期第13.5天(embryonic day 13.5, E13.5)和第16.5天(E16.5)小鼠的胎盤、胎膜等胚外組織中[8]。然而,四倍體滋養層干細胞(trophoblast stem cells,TSCs)與二倍體TSCs相比,其發育潛能有哪些不同。以往報道的調控滋養層細胞功能的基因[9],在多倍體細胞中如何進行調控,尚未進行探究。四倍體滋養層干細胞(tetraploid TSCs, TTSCs)系將有助于解決這些問題。
1 材料與方法
1.1 材料
1.1.1 細胞:野生型小鼠ESCs系AB2.2,遺傳背景為129S7/SvEvBrd,由英國The Wellcome Trust Sanger研究所Allan Bradley教授惠贈。野生型小鼠TSCs系、 TTSCs系,遺傳背景為ICR(Institute of Cancer Research來源),由本實驗室自行建系獲得。小鼠胚胎成纖維細胞(mouse embryonic fibroblast, MEF)制作成飼養層細胞,由本實驗室制備。
1.1.2 實驗動物: 實驗用小鼠購自北京維通利華實驗動物技術有限公司,飼養于中國醫學科學院基礎醫學研究所實驗動物中心[許可證號:SYXK(京)2020-0025],環境符合SPF級動物飼養標準。
1.1.3 試劑:Knockout DMEM培養基、RPMI 1640培養基、GlutaMAXTM、丙酮酸鈉、MEM 非必需氨基酸溶液、青鏈霉素及β-巰基乙醇(Gibco公司);白血病抑制因子(leukemia inhibitory factor,LIF)(Millipore公司);血清(Hyclone公司);成纖維細胞生長因子4(fibroblast growth factor 4,FGF4)(Peprotech公司);肝素(heparin)、M2培養基(Sigma-Aldrich公司);Y27632(MCE公司);KSOM培養基(Merck公司);TB Green Taq(TaKaRa公司)。
1.2 方法
1.2.1 ESCs的培養:培養基M15L由Knockout DMEM、15% FBS、GlutaMAXTM、MEM NEAA、青鏈霉素、β-巰基乙醇、LIF(1 000 U/mL)配制而成。
1.2.2 TSCs的培養:培養基TS+F4H:先由RPMI1640、20% FBS、GlutaMAXTM、丙酮酸鈉、β-巰基乙醇、青鏈霉素組成TS培養基,再添加FGF4(25 ng/mL)、肝素(1 μg/mL)組成TS+F4H培養基。
1.2.3 TTSCs的培養:MEF條件培養基(condition-ed medium, CM):用TS培養基培養X-射線處理的MEF細胞,3 d后收集上清,2 300×g4 ℃離心20 min,0.45 μm濾器過濾,即為MEF-CM。TTSCs的培養基70CM+1.5×F4H+Y27632:70% MEF-CM、30% TS培養基、FGF4(37.5 ng/mL)、肝素(1.5 μg/mL)、Y27632(20 μmol/L)組成。
ESCs、TSCs和TTSCs均接種在X線處理的飼養層MEF細胞上培養。細胞匯合度達到70%~80%時,以1∶5 ~1∶10比例進行傳代。
1.2.4 TTSCs的分離:用M2培養基收集2-細胞期胚胎,清洗后置于電融合儀中,融合電壓30 V/ram,脈沖時程50 s,脈沖次數1次。1 h后選擇發生融合的胚胎在KSOM培養基中培養。3 d后每3枚囊胚移入到MEF細胞包被的12孔板的一個孔中,使用TS+F4H培養,胚胎貼壁后更換新的培養基。3~5 d后,外長細胞團(outgrowth)直徑達到600~800 μm,將其挑出消化成單細胞后,接入到MEF細胞包被的培養板中,使用70CM+1.5×F4H+Y27632培養。待長出單層上皮樣的克隆后,挑取克隆,傳代擴增。
1.2.5 實時熒光定量PCR:提取細胞的總RNA并反轉錄為cDNA,用TB Green Taq進行RT-qPCR反應。引物序列見表1,GAPDH為內參基因。
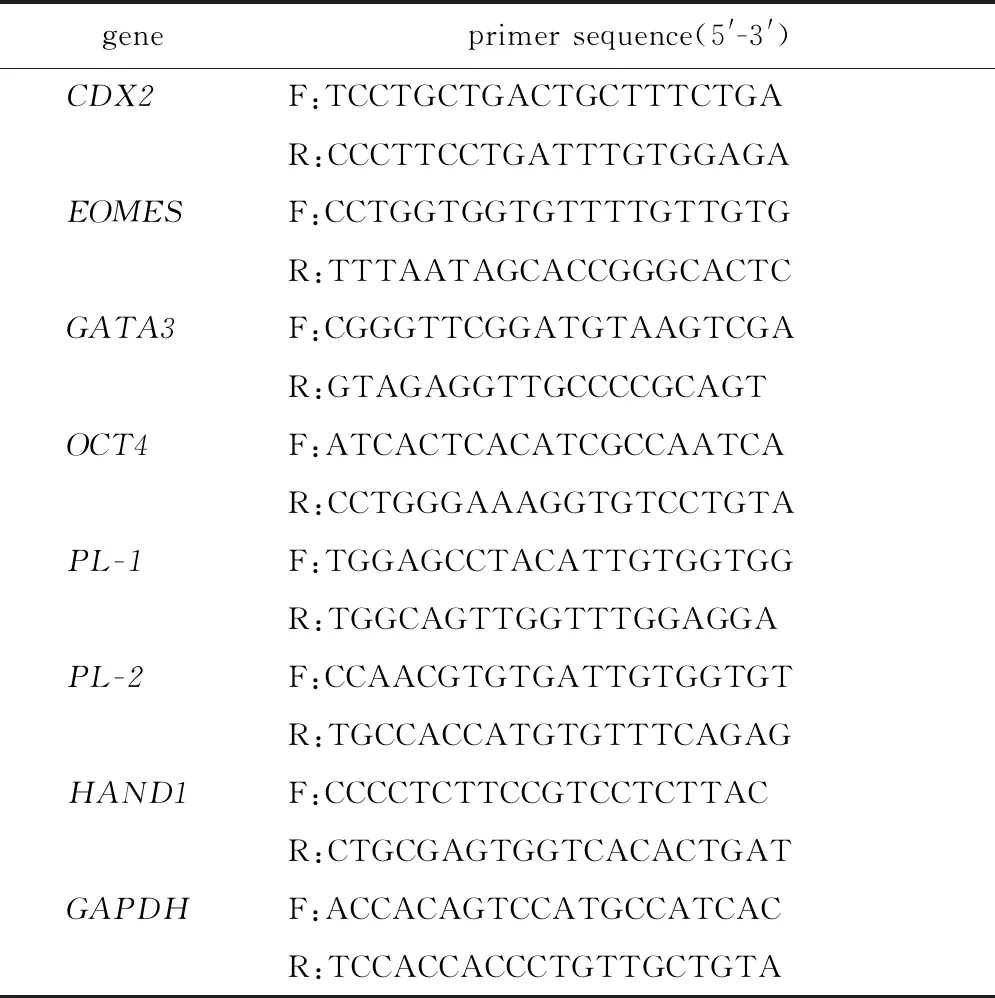
表1 RT-qPCR引物序列
1.2.6 細胞免疫熒光:細胞培養2~3 d后,4%多聚甲醛室溫固定30 min,0.1% Triton X-100室溫孵育20 min進行通透處理,3% BSA溶液封閉30 min。加入CDX2(1∶200)、EOMES(1∶200)一抗4 ℃孵育過夜。次日加入二抗及Hoechst 33342稀釋液避光染色30 min。封片并使用共聚焦顯微鏡觀察。
1.2.7 Western blot檢測蛋白表達:TTSCs消化并去除MEF細胞后,加入RIPA裂解液冰上裂解30 min,BCA法測定蛋白濃度。取20 μg樣品進行檢測,電泳、轉膜后,一抗CDX2(1∶1 000)、OCT4(1∶1 000)、GAPDH(1∶2 000)4 ℃孵育過夜。TBST清洗后,二抗室溫孵育1 h,化學發光儀檢測。GAPDH作為內參。
1.2.8 中期染色體計數:處于對數生長期的細胞加入0.2 μg/mL秋水仙素,3 h后將細胞消化成單細胞,0.5% KCl 37 ℃水浴中低滲處理30 min。新配制固定液(甲醇∶冰醋酸=3∶1)室溫固定細胞20 min,重復1次。細胞懸液滴于冰冷潔凈的載玻片上。過夜晾干,Giemsa染液染色5 min,蒸餾水沖洗晾干后,顯微鏡下觀察計數染色體數目。
1.2.9 慢病毒感染TTSCs:用PCR將2A-tdTomato元件克隆至pLVX-EF1α-eGFP-IRES-puro慢病毒表達質粒,得到pLVX-EF1α-eGFP-2A-tdTomato-IRES-puro質粒, 作為核心質粒進行慢病毒包裝(由北京伊美昂生物科技有限公司制作)。
處于對數生長期的TTSCs接種到12孔板中,次日更換含polybrene(6 μg/mL)和慢病毒的無雙抗70CM+1.5×F4H +Y27632培養基,感染4 h后換液。48 h后,熒光顯微鏡下觀察評估感染效率。在培養基中加入puromycin(5 μg/mL)進行篩選,獲得成功感染的細胞。
1.2.10 8-細胞期胚胎的顯微注射及嵌合胎盤的觀察:體質量12~14 g ICR雌鼠作為胚胎供體鼠,每只注射10 U血促性素,間隔48 h后,注射10 U 絨促性素,與雄鼠合籠。次日晨挑取見陰道栓雌鼠,當天記為E0.5 d(0.5 d)。在E2.5 d(2.5 d)時,用M2培養基收集8-細胞期胚胎。
將eGFP-2A-tdTomato標記的TTSCs消化成單細胞,每個8-細胞期胚胎注射進入5個細胞。注射后的胚胎放入KSOM培養基中培養。次日選取發育較好的囊胚進行子宮移植。E13.5(13.5 d)時,取子代小鼠胎盤進行觀察,檢測熒光標記細胞的嵌入情況。
1.3 統計學分析
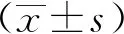
2 結果
2.1 電融合后的胚胎建立滋養層樣細胞系
2-細胞期胚胎經電融合后形成四倍體胚胎,體外培養至囊胚階段(圖1A),將其接種到MEF細胞包被的培養板中,用TS+F4H培養基進行培養。囊胚從透明帶中孵出,貼壁生長形成外長細胞團(outgrowth)(圖1B)。挑出的outgrowth重新接種,在培養板中增殖生長形成新的細胞團(圖1C),細胞團繼續傳代培養,待出現較多形態類似于TSCs的克隆后,挑取TSCs樣克隆繼續培養,得到可穩定培養的TTSCs系(圖1D)。

A.mouse tetraploid blastocysts (scale bar=100 μm); B.outgrowth from tetraploid blastocysts(scale bar=200 μm); C.cell aggregates from outgrowth (scale bar=200 μm); D.cultured TTSCs that can be passaged stably (scale bar=200 μm)
2.2 鑒定四倍體滋養層干細胞系
對來自融合胚胎的TSCs樣細胞系進行中期染色體計數后,超過60%樣品的染色體數目為80條,為正常二倍體細胞染色體數目的兩倍,說明所建立的細胞系為四倍體(圖2A)。在轉錄水平檢測上述細胞系中標志基因的表達,發現不同的TSCs樣細胞系TTSCs-1和TTSCs-2均表達TSCs特異基因CDX2和EOMES,不表達ESCs特異性基因OCT4(圖2B)。Western blot(圖2C)和免疫熒光(圖2D)結果分別驗證了TTSCs高表達CDX2、EOMES等因子。以上結果表明由融合胚胎建立的TSCs樣細胞系為四倍體細胞,并表達TSCs的標志基因。
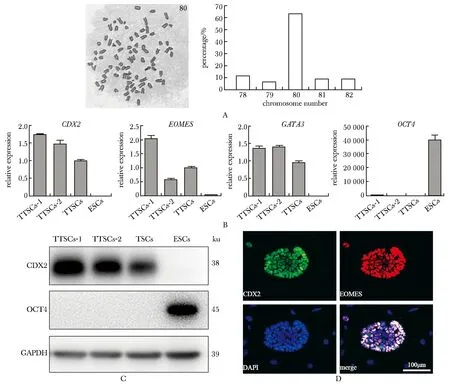
A.representative chromosome spreads and chromosome counting of TTSCs lines(×400); B.RT-qPCR analysis of TSCs marker gene (CDX2, EOMES, GATA3) and ESCs marker gene (OCT4) in TTSCs-1/2, TSCs, n=3), compared with TSCs; C.Western blot analysis of CDX2 and OCT4 in TTSCs-1/2, TSCs, ESCs; D.immunofluorescence staining of CDX2 and EOMES
2.3 TTSCs的體外分化
TTSCs在增殖條件下(圖3A)和分化條件下(圖3B)的細胞形態不同,在分化條件下(TS培養基),TTSCs的細胞核明顯增大,具有滋養層巨細胞的形態特征。用RT-qPCR對TTSCs進行滋養層巨細胞標志基因PL-1、PL-2、HAND1、GATA3的檢測。結果顯示,分化標志基因在不同的時間點,TSCs與TTSCs的表達量存在顯著差異(P<0.0001)(圖3C)。
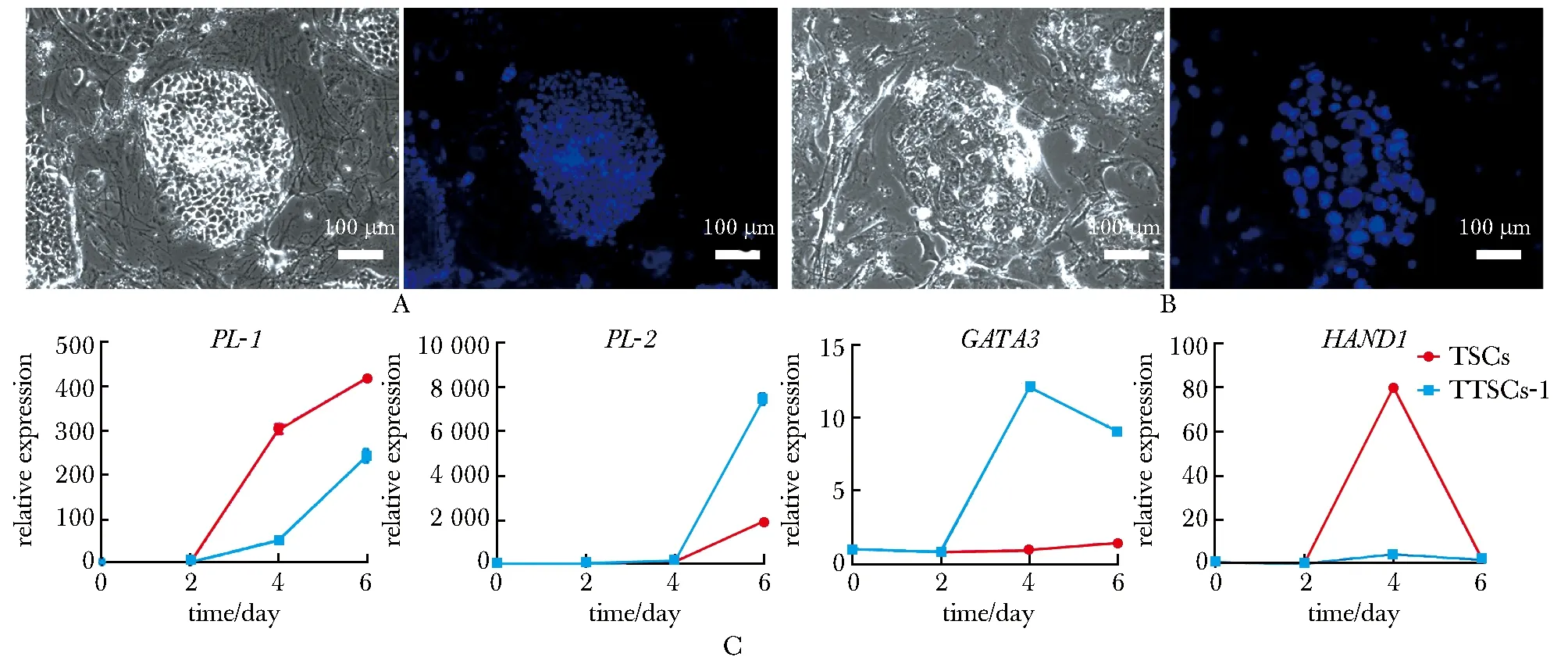
A.the morphology of TTSCs clone under proliferation condition and DAPI stained nuclei(scale bar=100 μm); B.the morphology of TTSCs clone under differentiation condition and DAPI stained nuclei(scale bar=100 μm); C.RT-qPCR analysis of the expression of PL-1,PL-2,GATA3 and HAND1 under differentiation n=3); *P<0.000 1 compared with TSCs at day 0
2.4 TTSCs的體內分化
通過慢病毒感染的方法得到同時帶有tdTomato和eGFP標記的TTSCs(圖4A)。將其注射入8-細胞期胚胎中(圖4B),并培養至囊胚期,可觀察到部分熒光標記過的細胞分布在囊胚的滋養層部分(圖4C)。將囊胚移植入假孕雌鼠體內發育至E13.5(13.5 d),子代鼠的胎盤組織中可檢測到具有雙熒光標記的細胞(圖4D)。
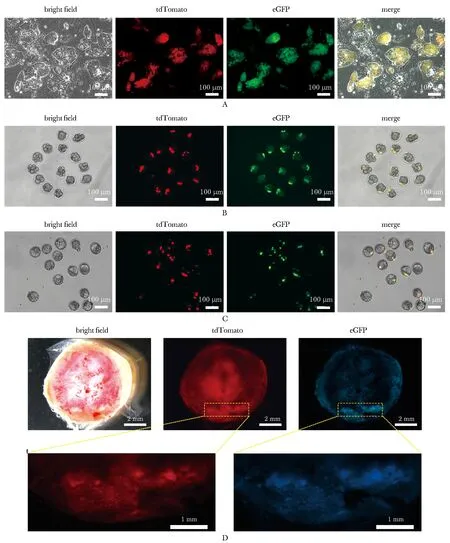
A.TTSCs were labeled with dual fluorescent reporters of tdTomato and eGFP(scale bar=100 μm); B.TTSCs were microinjected into the 8-cell embryo(scale bar=100 μm); C.blastocysts cultured for 24 hours in vitro after microinjection(scale bar=100 μm); D.the E13.5 placenta dissected for observation(scale bar=2 mm); the two amplified pictures are matched with circled part of the above pictures(scale bar=1 mm)
3 討論
本研究使用電融合的方法,獲得了四倍體胚胎,借鑒二倍體[10]及單倍體[11]TSCs的建系方法,經過建系條件和培養條件的反復測試,建立了TTSCs系,并確定了70CM+1.5×F4H+Y27632的培養條件可以穩定維持TTSCs的生長。建立的TTSCs細胞系均表達TSCs標志基因CDX2、EOMES。與二倍體TSCs相比,TTSCs培養基中需要添加更高濃度的肝素和FGF4以維持其增殖狀態,并且需要添加Rock 抑制劑Y27632,否則細胞會分化成滋養層巨細胞,說明其本身可能就具有更強的分化傾向。后續的分化實驗也顯示,在體外培養條件下,TTSCs的分化標志基因表達水平與TSCs存在顯著差異。說明在生長及分化過程中,TTSCs與TSCs并不完全相同。顯微注射實驗也證明,TTSCs可以參與到胎盤的發育中,表明TTSCs具有良好的體內發育潛能。
Wen[8]等建立的四倍體ESCs可嵌合入胚外組織,說明細胞染色體組多倍化會改變細胞的命運決定機制及發育分化方向。通過體外建立的TTSCs可以進一步分析和研究四倍體胚胎滋養層細胞的生長及分化特點,解釋細胞染色體組多倍化對細胞生命活動的影響。
綜上,本研究建立的TTSCs為研究多倍體細胞在動物生理過程中的功能和胎盤早期發育提供了重要的細胞模型,也為深入了解胎盤發育不良導致的流產、難產等問題提供了新的研究思路。

