阿膠對慢性阻塞性肺疾病大鼠肺功能及肺組織病理損傷的影響
那扎開提·艾尼瓦爾,胡 廣,張田甜,宋美月,趙紅梅,靳洪濤*,王 婧*
(1.中國醫學科學院基礎醫學研究所 北京協和醫學院基礎學院 病理生理學系,北京 100005; 2.北京中醫藥大學,北京 100029;3.中國醫學科學院 北京協和醫學院 藥物研究所 新藥安全評價研究中心,北京 100050)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)簡稱慢阻肺,是一種以持續性呼吸道癥狀和不完全可逆氣流受限為特征的呼吸系統慢性疾病,患病率高、死亡率高,是全球重要的公共衛生問題。目前臨床上多以西藥治療為主,但效果甚微,難以根治,且長期用藥不良反應多,開發新藥物是近年來的研究熱點[1]。中醫藥治療慢阻肺有一定療效,副作用小[2]。阿膠(Collacoriiasini,CCA,E’jiao, donkey-bide gelatin)是一味傳統中藥,已有兩千多年的藥用歷史,是由驢皮經過煎煮、濃縮等復雜程序制成的固體膠塊,主要成分是膠原蛋白、氨基酸、硫酸皮膚素和微量元素等[3],具有造血補血、滋陰潤肺、增強免疫力、抗感染、抗衰老、抗腫瘤、抗疲勞等多種藥理作用,并且安全性較高[4],但其具體作用機制不明。現代研究表明阿膠可以保護氣管內滴注aPM2.5致肺損傷大鼠的肺功能,可抑制肺泡巨噬細胞的增多、減輕哮喘大鼠肺組織嗜酸性粒細胞浸潤程度、逆轉氣道炎性反應小鼠Th17/Treg細胞亞群失衡[5-6],提示CCA對呼吸系統有一定的保護作用,但CCA對COPD的治療作用及其機制目前尚無研究報道。因此本研究首次通過制備大鼠慢阻肺模型,觀察CCA對其肺功能及肺組織病理損傷的影響,為CCA應用于慢阻肺治療初步提供理論依據。
1 材料與方法
1.1 材料
1.1.1 動物:SPF級雄性SD大鼠25只[北京維通利華實驗動物技術有限公司,許可證號:SCXK(京)2016-0011],9~10周齡,體質量280~300 g。于自然光照下普通動物飼料統一喂養,室溫(23±2)℃,相對濕度40%~60%,自由攝食、飲水,12 h晝夜明暗交替,清潔級適應性喂養1周后開始實驗。相關操作符合科學技術部頒發的《實驗動物管理條例》(2017版)要求。
1.1.2 試劑:實驗用卷煙(中國輻射防護研究院安全評價中心);阿膠(CCA)(山東東阿阿膠股份有限公司);蘇木素-伊紅(HE)染色試劑盒(北京中杉金橋生物技術有限公司)。
1.2 方法
1.2.1 大鼠的分組及處理:將大鼠隨機分為:對照組(control)、模型組(COPD)、阿膠低(low-dose CCA)、中劑量組(medium-dose CCA)和高劑量組(high-dose CCA)。除對照組外,參照文獻[7]采用單純卷煙煙霧暴露的方法,每日1次暴露于(1 100±10)mg/m3的煙霧濃度中90 min,連續暴露48周制備慢阻肺大鼠模型。分別以1、2、4 g/kg的劑量每日灌胃給藥1次,每次現配現用,連續28 d,每組5只。
1.2.2 肺功能的檢測:采用EMKA動物肺功能儀檢測肺功能,檢測前校正系統。將清醒大鼠置于全身體積描計箱中,適應環境10 min,記錄10 min的情況,測定潮氣量(tidal volume,TV)、每分鐘呼氣量(expiratory volume,EV)、呼氣持續時間(expiratory time,Te)、松弛時間(relaxation time,RT)、呼氣末期停頓(end expiratory pause,EEP)、支氣管收縮程度(pause enhanced,Penh)、呼氣峰流速(peak expira-tory flow,PEF)、吸氣峰流速(peak inspiratory flow,PIF)、每分鐘通氣量(minute ventilation volume,MV)、呼出50%潮氣量時呼氣流速(expiratory flow rate at 50% tidal volume,EF50)、呼吸頻率[frequency of breathing,f(B)]等肺功能指標。
1.2.3 肺組織病理形態學的觀察:肺功能檢測結束后,腹腔注射2%戊巴比妥鈉麻醉,采血處死,取出右肺組織,置于4%多聚甲醛中固定48 h,常規石蠟包埋、切片(5 μm厚度),HE染色,中性樹膠封片,光鏡下觀察各組大鼠肺組織病理形態學變化。
1.3 統計學分析
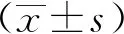
2 結果
2.1 阿膠(CCA)對肺功能的影響
與對照組比較,模型組大鼠的肺功能指標TV、EV、Te、RT、EEP、Penh均顯著增加(P<0.05),而PEF、PIF、MV、EF50、f均顯著降低(P<0.05)。與模型組比較,阿膠中劑量組大鼠Penh和高劑量組Te、RT、Penh均下降(P<0.05),而MV、PIF、EF50均明顯增加(P<0.05)(圖1)。

*P<0.05, **P<0.01, ***P<0.001 compared with control group; #P<0.05, ##P<0.01 compared with COPD model group
2.2 阿膠(CCA)對肺損傷的影響
對照組大鼠肺組織形態正常,肺泡和肺泡間隔結構完整,肺泡大小正常,充氣狀態良好,肺泡間隔無破壞,無肺氣腫改變,無炎細胞浸潤現象。模型組大鼠肺泡數目明顯減少,肺泡結構損壞,肺泡明顯擴張,肺泡壁變薄,肺泡間隔變窄、部分斷裂融合成大囊泡,形成肺氣腫,肺間質、肺泡腔、血管腔內大量炎性細胞浸潤,以淋巴細胞、中性粒細胞為主。與模型組相比,CCA高劑量組肺泡增多,肺泡結構較完整,充氣良好,可見少量萎縮肺泡,肺泡間隔大多正常,肺泡壁變薄、肺泡局部擴張融合程度明顯改善,肺間質、肺泡腔、血管腔內炎性細胞浸潤明顯減輕。CCA低、中劑量組病理改變介于模型組和CCA高劑量組之間(圖2)。

A.control group; B.COPD model group; C.low-dose CCA group; D.medium-dose CCA group; E.high-dose CCA group
3 討論
COPD是一種最常見的可以預防和治療的肺部疾病,多發于老年人群,主要表現為慢性咳嗽、咳痰、呼吸困難等癥狀,肺功能呈進行性下降,可并發肺心病、呼吸衰竭、右心衰竭等多種疾病[1]。其發病機制復雜,尚未完全明確,目前公認的主要有炎性反應機制、氧化應激機制、蛋白酶-抗蛋白酶失衡機制等學說,慢性炎性反應是核心機制,包括炎性細胞因子的釋放和免疫細胞的反應[8]。長期吸煙是COPD最重要的危險因素,患病率和吸煙的時間長短、日吸煙量呈正比,香煙煙霧中含有尼古丁、焦油、鎘等有害物質,可以刺激支氣管黏膜,使纖毛結構和功能受損,氣道自凈功能逐漸降低,同時產生大量氧自由基,刺激中性粒細胞、巨噬細胞、活化的T淋巴細胞等炎性細胞的增殖和聚集,炎性因子和彈性蛋白酶的分泌增加,進一步使蛋白酶-抗蛋白酶失衡,引起氣道、肺實質和肺血管的慢性炎性改變;且刺激黏膜下感受器使小氣道痙攣收縮,氣道阻力增加,肺功能受損[9]。
肺功能檢測和病理檢查是目前公認的評估COPD動物模型是否成功的兩種重要方法。本實驗將大鼠長期暴露于卷煙煙霧中來制備COPD模型,使模型組大鼠肺功能降低,產生肺氣腫和炎性反應的形態學改變,提示大鼠肺組織發生了病理性損傷,與臨床上COPD肺組織病理學改變相似[8]。
CCA素來以“滋陰潤肺”著稱,研究發現CCA可以通過調節抗氧化酶的活性和相關基因的表達,對氧化應激損傷起保護作用[10],顯著提高腹腔巨噬細胞的吞噬活性,促進細胞免疫和體液免疫,對免疫抑制小鼠有很好的免疫保護作用[11],可以通過逆轉Th17、Treg亞群失衡和下調IL-6、IL-17A、Foxp3細胞因子表達從而減輕煙塵所致氣道炎性反應模型小鼠肺部的炎性反應[12]。本實驗中經過CCA溶液灌胃給藥干預治療后,高劑量CCA緩解了氣流受限和阻塞性通氣障礙,使肺功能有所改善,明顯好于模型組;低、中劑量組大鼠指標雖無顯著差異,但可以看出和對照組相比肺功能均下降,給藥后呈現改善的趨勢。組織病理結果顯示高劑量組大鼠肺組織炎性反應和肺氣腫有明顯改善,無肺水腫,炎性細胞浸潤減少,肺泡壁破裂融合形成肺氣腫現象有所緩解,肺組織病理損傷明顯減輕。提示CCA具有一定程度改善COPD模型大鼠肺功能、減輕肺組織炎性反應的作用。
綜上所述,本研究采用卷煙煙霧慢阻肺大鼠模型,證明CCA對其有一定的保護作用,可以改善其肺功能、減輕肺組織病理損傷,延緩COPD病理進展。這為CCA應用于慢阻肺的治療提供了實驗依據,但其確切作用機制仍需進一步深入研究。

